硫酸高鈰分光光度法測定過氧化氫的優化研究
孫佩穎 王春璇 馮煒 張梅笑 朱兆連

關鍵詞:過氧化氫;分光光度法;硫酸高鈰;草酸鈦鉀
前言
過氧化氫(H202)是全球最重要的100種基礎化學品之一,被廣泛用于工業漂白、清洗、殺菌消毒、化學合成和污染物凈化等領域。準確、簡便測定H202的濃度對于生產和使用過程都十分重要。目前,H202主要的分析方法有常規滴定法.熒光與化學發光法、電化學法和分光光度法等,其技術性能比較見表1。
高錳酸鉀法、碘量法和鈰鹽滴定法等常規滴定法原理簡單,但操作較繁瑣,易受干擾、靈敏度低。例如,高錳酸鉀法測量精度易受還原性物質的影響,相對偏差最高可達50%;碘量法受溶液酸度影響大,而且對濃度小于70mg·L-1的H202測量偏差較大;鈰鹽滴定法測定13.60mg·L-1以下的H202時,由于滴定終點不明顯,測定誤差會高達15%以上。
熒光與化學發光法、電化學法等測定H202的優勢是靈敏度高。例如,采用人工合成血紅素酶FeMC6a化學發光法檢測H202,檢出限為0.16mg·L-1;利用Eu-MOF熒光探針測定H202的檢出限可低至1.5×10-2mg·L-1;MoS2修飾玻碳電極的檢出限可降至3.8x10-2mg·L-1。降低測試成本,提高穩定性仍然是上述方法面臨的挑戰。
分光光度法設備簡便、準確度和靈敏度較高,被廣泛用于H202檢測。目前應用最廣泛的是草酸鈦鉀分光光度法,線性范圍通常在5~100mg·L-1,加標回收率在95%~105%之間,相對標準偏差(RSD)可小于0.5%。除了草酸鈦鉀分光光度法外,也有少數研究者曾采用硫酸高鈰分光光度法測定H202,但是對于該法的最佳測定波長和體系pH的影響缺乏探討,方法的可靠性也不清楚。因此,文章系統考察pH值、反應時間等因素對硫酸高鈰分光光度法測定H202的影響,確立最佳的測定條件,計算誤差、偏差和檢出限,并與草酸鈦鉀分光光度法進行比較,評價硫酸高鈰分光光度法的優勢和應用價值。
1材料與方法
1.1所需儀器與試劑
儀器:pH計(PHS 3C型,上海雷磁儀器廠),電子天平(BSM-220.3型,上海卓精電子科技有限公司),紫外分光光度計(UV3300型,上海美譜達儀器有限公司)。
試劑:H202(30%),優級純,國藥集團化學試劑有限公司;濃硫酸,分析純(AR),上海凌峰化學試劑有限公司;四水合硫酸高鈰(Ce(S04)2.4H20),AR,西隴科學股份有限公司;草酸鈦鉀,AR,麥克林;實驗用水均為超純水。
1.2硫酸高鈰分光光度法測定H202的原理
在強酸性環境下,硫酸高鈰(Ce( S04)2)作為氧化劑,與H202發生氧化還原反應,Ce4+被還原成Ce3+,其反應方程式如下:
在反應過程中,橙黃色的Ce4+被H:02還原為無色的Ce3+,從而導致體系吸光度發生變化。固定初始Ce4+的濃度,加入一定體積的H202溶液,H202濃度越高,特定波長下體系的吸光度就越低。根據H202的濃度與體系吸光度的線性關系,確定侍測液中的H202濃度。
1.3實驗方法
1.3.1Ce(S04)2溶液初始pH值的影響
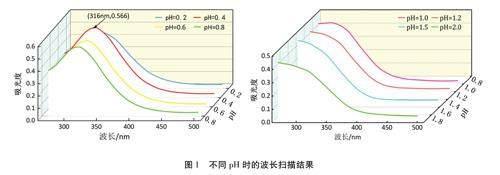
分別將0.2021gCe(S04)2.4H20溶解于120m1不同濃度的硫酸溶液,待冷卻至室溫后轉移到250ml的棕色容量瓶中定容。定容后的Ce(S04)2溶液濃度為0.002mol·L-1,pH值分別為0.2、0.4、0.6、0.8、1.0、1.2、1.5和2.0。取8支50ml比色管,分別加入5mL不同pH的Ce(S04)2溶液,然后加入20ml 2.50mg·L-1的H202溶液,反應6min后定容、搖勻,在270~500nm波長范圍內進行掃描,確定最適初始pH和最大吸收波長。
1.3.2反應時間的確定
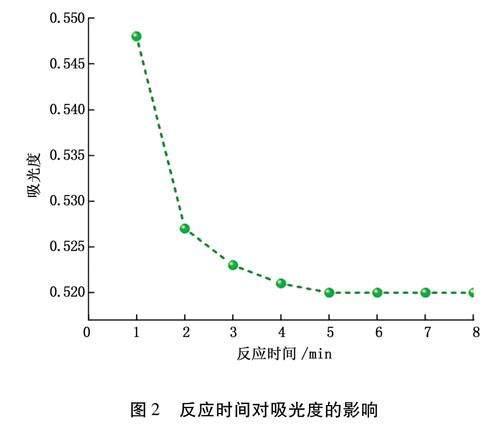
取8支50ml比色管,分別加入pH=0.4的0.002mol·L-1Ce(S04)2溶液5ml,再加入20ml50.00mg·L-1的H202溶液,控制反應時間分別為1min,2min,3min,4min,5min,6min,7min,8min,定容、搖勻后迅速在波長316nm處測定吸光度,確定最佳反應時間。
1.3.3建立測定不同濃度范圍H202的標準曲線
分別取1ml濃度為0、10.00、20.00、30.00、40.00、60.00、80.00、100.00mg·L-1的H202溶液于50ml比色管中,加入5mlpH為0.4的0.002mol·L-1Ce(S04)2溶液,反應6min后定容、搖勻,在316nm波長下測定吸光度,繪制0~100.00mg·L-1的H202測定標準曲線。分別取20ml0、1.00、2.00、3.00、4.00、5.00mg.L-1的H202溶液于50ml比色管中,按照上述相同的方法進行反應、測定吸光度,繪制0~5.00mg·L-1的H202測定標準曲線。
1. 3.4方法校驗
配制濃度為0、20. 00、40. 00、60. 00、80. 00、100.00mg·L-1的H202溶液,加入0.02mol·L-1草酸鈦鉀溶液顯色8min后,在385nm處測定吸光度,建立草酸鈦鉀分光光度法分別測定H20的標準曲線。采用硫酸高鈰分光光度法和草酸鈦鉀分光光度法分別測定不同濃度的H202溶液,計算加標回收率、相對平均偏差、相對誤差、標準偏差和相對標準偏差,確定文章方法的準確性和適用性。
2結果與討論
2.1Ce( S04)2溶液初始pH值的影響
不同初始pH值Ce(S04)2溶液與H202反應后體系在270~500nm的波長掃描結果如圖1所示。由圖1可見,當初始Ce(S04)2溶液pH值在0.2~0.8時,體系在掃描的波長范圍內有明顯的吸收峰,最大吸收波長都在316nm左右。當pH值大于1.0時,體系在掃描的波長范圍內沒有明顯吸收峰,無法確定最大吸收波長。分析原因如下:Ce(S04)2溶液中的Ce4+易水解生成Ce(OH)4,Ce(OH)4的Ksp為1.58×10,對應0.002mol.L-1Ce4+溶液的pH值為0.975。當Ce(S04)2溶液pH值大于1.0時,溶液會析出Ce(OH)4,形成膠體態的Ce(OH)4甚至絮體,從而對入射光產生反射和散射現象。因此,pH值會顯著影響Ce4+的存在形態及其與H202的氧化還原反應,導致吸光度值差異很大。在pH值為0.4時測得的吸光度值最大,吸光度值大有助于減少實驗誤差。為提高測定的準確性和靈敏度,本實驗確定最佳反應初始pH值為0.4,最大吸收波長為316nm。
2.2反應時間的確定
Ce(S04)2與H202反應時間對體系吸光度的影響如圖2所示。由圖2可知,隨著反應時間的延長,Ce4+逐步被H202還原為Ce3+,體系的吸光度隨之下降。當反應進行5min后,Ce4+已完全被H202還原為Ce3+,體系的吸光度趨于穩定,進一步延長反應時間,體系吸光度也不再發生變化。因此,文章選擇6min作為最佳反應時間。
2.3不同濃度區間H202溶液的測定標準曲線
對已知的H202濃度和測定的吸光度進行線性回歸,得到硫酸高鈰分光光度法測定過氧化氫的標準曲線。當H202濃度在0~100.00mg·L-1時,標準曲線為y=-149.81x+128.59(R2=0.9999);當H202濃度在0~5.00mg·L-1時,標準曲線為y=-7.0706x+5.9564(R2=0.9990);式中y為H202濃度(mg·L-1),x為對應的吸光度值。與0~5.00mg·L-1的低濃度范圍相比,0~100. 00mg·L-1高濃度范圍標準曲線線性關系更好。
2.4方法檢出限
根據國際純粹和應用化學聯合會(IUPAC)對檢出限DL的規定:
采用硫酸高鈰分光光度法進行了20組平行實驗后得出,當檢測H202的濃度區間為0—100.00mg·L-1時,硫酸高鈰分光光度法測得空白吸光度標準偏差為5.62×10-4,最低檢出限為0.25mg·L-1。當檢測H202的濃度區間為0~5.00mg·L-1時,測得空白吸光度的標準偏差為5.03×10-3,最低檢出限為0.11mg·L-1。因此,采用0~100.00mg·L-1的標準曲線測定高濃度的H202更精確,而0~5.00mg·L-1的標準曲線H2O2檢測限更低。
2.5方法回收率
分別以蒸餾水、地表水和生化尾水為本底,加入一定量不同濃度的H202溶液,用0~5.00mg·L-1和0~100.00mg·L-1濃度區間的標準曲線計算H202濃度,平行測定三次,結果如表2所示。由表2可見,對0.20~2.50mg·L-1和5.00~30.00mg·L-1H202測定的相應加標回收率分別為98.67%~105.00%和95.50%~107.47%,表明硫酸高鈰分光光度法能夠滿足測定0~5.00mg·L-1和0~100.00mg.L-1H202的準確性要求,適合H202溶液和一些地表水、生化尾水等體系中H202濃度的測定。
2.6方法對比和校驗
2.6.1草酸鈦鉀分光光度法測定H202的標準曲線
對H202溶液濃度及其與草酸鈦鉀反應后的吸光度進行線性回歸,得到草酸鈦鉀分光光度法測定H202的標準曲線方程為:y=1565.4x+0.6899,式中y為H202濃度(mg·L-1),x為對應的吸光度值,R2=0.9996顯示出方程的線性關系良好。
2.6.2硫酸高鈰分光光度法和草酸鈦鉀分光光度法測定結果比較
用硫酸高鈰分光光度法和草酸鈦鉀分光光度法分別對50.00mg.L-1的H202溶液進行測定,結果如表3所示。由表3可知,兩種方法對H202的6次測量平均值分別為50.19mg·L-1和51.05mg·L-1,與實際值相差不大。草酸鈦鉀分光光度法的相對平均偏差、相對誤差、標準偏差和相對標準偏差為別為1.71%、2.09%、1.14%和2.24%;硫酸高鈰分光光度法的相對平均偏差、相對誤差、標準偏差和相對標準偏差分別為0.90%、0.38%、0.50%和0.99%,后者明顯低于前者,體現出更高的精密度和準確度。
另外通過20組空白樣品平行實驗得出,草酸鈦鉀分光光度法測定空白吸光度標準偏差為7.26×10,最低檢出限為1.56mg·L-1;硫酸高鈰分光光度法測定空白吸光度標準偏差為5.62×10,最低檢出限為0.25mg·L-1;可見硫酸高鈰分光光度法測定H202濃度的靈敏度更高,比草酸鈦鉀分光光度法更適合測定低濃度的H202。2.6.30~5mg·L-1H202的檢測采用草酸鈦鉀分光光度法測定濃度為5.00mg·L-1的H202溶液,測得吸光度值為0.006,代人標準曲線方程,計算得到H202濃度為10.46mg.L-1,與實際值差距很大。主要原因在于:當H202溶液濃度較低時,與草酸鈦鉀的顯色反應很不明顯,測定的吸光度值很低,接近于空白值,且受儀器噪音干擾程度大,導致測定結果誤差很大。因此,使用草酸鈦鉀分光光度法無法測定0~5.00mg·L-1范圍的H202。
采用硫酸高鈰分光光度法對2.50mg·L-1的H202溶液進行5次重復測定,結果如表4所示。由表4可知,該方法的相對標準偏差為0.42%,表明硫酸高鈰分光光度法在檢測低濃度范圍的H2O2有較好的重現性和準確度。
3結論
Ce(S04)2與H20:的氧化還原反應受溶液初始pH影響很大,進而影響體系的吸光度。保持一定的反應時間才能使Ce(S04)2與H202充分反應。得到硫酸高鈰分光光度法測定H202的最優條件:初始Ce(S04)2濃度為0.002mol·L-1、pH=0.4、波長為316nm、反應時間為6min。硫酸高鈰分光光度法測定H202的相對平均偏差、相對誤差、標準偏差、相對標準偏差和檢出限都明顯低于草酸鈦鉀分光光度法。硫酸高鈰分光光度法測定H202的檢出限為0.11mg·L-1,測定2.00mg·L-1 H202的加標回收率在98.67%~105.00%,測定2.50mg·L-1H202的相對標準偏差為0.55%,體現出較高的靈敏度、準確性和精密度。

