醬香型大曲中產4-乙基愈創木酚芽孢桿菌的篩選、鑒定及特性研究
王成俊,李玲珊,范 梅,劉 君,3*,袁思棋*
(1.四川輕化工大學生物工程學院,四川宜賓 644000;2.四川宜賓五糧液股份有限公司,四川宜賓 644000;3.釀酒生物技術與應用四川省重點實驗室,四川宜賓 644000)
4-乙基愈創木酚(4-Ethylguaiacol,簡稱4-EG;CAS No.2785-89-9),化學名為4-乙基-2-甲氧基苯酚,呈木香、煙味、香辛料和甜香蘭素風味,具有緩和咸味等作用[1]。4-EG 是醬香型白酒重要的微量香氣成分,茅臺酒中含0.025 mg/L 的4-EG 時,賦予茅臺悠香醇厚風味,凸顯其醬香風味[2]。此物質因具有醬香特征成為醬油的重要香氣物質,醬油中蛋氨酰與4-EG 的含量分別為3.99 mg/L 與0.3 mg/L 時,能讓醬油呈現最佳風味[3],在一定程度上減輕醬油的咸味,使味道呈現圓滑的效果[4],還具有增香、防腐、殺菌等作用[1,5]。4-EG具有良好的活性氧消除功能,在抗氧化和預防心血管等多種疾病方面有一定作用[6-8],是白酒中重要的風味物質和健康因子之一[9-10],被廣泛應用于酒類、醬油、飲料、食品、煙草等行業[1,3-5,11]。
目前,生產4-EG 的方法有直接提取法[12]、人工合成法[13-14]、生物轉化法[15-16]。生物轉化法生產4-EG 是目前應用較為廣泛的方法,具有反應條件溫和,生產周期短,價格低廉,環境友好和生產成本低等優點[15-17],已引起各國研究者的高度關注。本研究擬從醬香型大曲中分離具有產4-EG能力的芽孢桿菌類微生物作為目的菌株并探索其耐受條件,旨在為后續研究4-EG 的生物合成及應用提供理論基礎。
1 材料與方法
1.1 材料、試劑及儀器
1.1.1 樣品
醬香型大曲:來自于某酒業有限公司制曲車間。
1.1.2 試劑
4-乙基愈創木酚(C9H12O2,色譜級,CAS No.2785-89-9)標準品,購于上海源葉科技生物有限公司。其他試劑和藥品均購于國內相關公司。
1.1.3 儀器設備
氣相色譜-質譜聯用儀:TSQ8000(安捷倫公司,美國);PCR 儀:5020(Thermo Fisher 公司,美國);可見光分光光度計:UV-1800 型(翱藝儀器上海有限公司)等。
1.1.4 培養基
富集培養基、分離培養基、發酵培養基、葡萄糖試驗培基、蔗糖試驗培養基、乳糖試驗培養基、淀粉試驗培養基、VP試驗培養基等培養基(表1)。富集培養基用于目的菌株的分離培養,發酵培養基只添加麩皮作為發酵前體物質進行目的菌株的復篩,葡萄糖培養基用于生理生化試驗,淀粉培養基用于檢驗菌株是否能分解淀粉,VP 培養基用于生理生化鑒定。

表1 培養基
1.2 試驗方法
1.2.1 菌種分離及篩選
1.2.1.1 富集培養
稱取10 g 大曲,粉碎后加入到50 mL 富集培養基中,185 r/min 振蕩培養4 h,取10 mL 于80 ℃水浴鍋中處理30 min,靜置,取1 mL 上清液加入到裝有50 mL 的富集培養基中,37 ℃、180 r/min 培養過夜。
1.2.1.2 初篩
過夜培養的菌懸液按10 倍梯度稀釋到10-7,分別取10-5、10-6、10-7的稀釋液0.1 mL 涂布于分離培養基,37 ℃培養24 h,根據菌落形態大小、顏色等挑取菌落劃線分離純化,將純化后的純菌落接種到斜面培養基上,37 ℃培養24 h。過濾發酵液,通過GC-MS 檢測4-EG 相對含量,選擇出產4-EG 較高的菌株進行后續復篩。
1.2.1.3 復篩
初篩分離得到的菌株經活化后,培養成種子菌懸液,按5 %的接種量接入復篩培養基,于37 ℃、180 r/min 培養6 d,同時設置空白組。過濾發酵液,通過GC-MS檢測4-EG相對含量。
1.2.2 菌種鑒定
1.2.2.1 菌種的形態學鑒定
復篩得到的目的菌株,將其菌懸液梯度稀釋后,涂布于平板上,37 ℃培養32 h,觀察菌落形態,挑單個菌落進行革蘭氏染色和芽孢染色,用光學顯微鏡觀察個體形態。
1.2.2.2 分子系統學鑒定
分子系統學鑒定:離心收集對數期的培養菌液,采用Bacterial DNA Kit 試劑盒提取總DNA,提取得到的總DNA 采用0.8 %瓊脂糖凝膠電泳檢測。以目標菌株的總DNA 為模板,采用16S rDNA通用引物(27F:5'-AGAGTTTGATCCTGGCTCAG-3',1492R:5'-GGTTACCTTGTTACGACTT-3'),進行PCR 擴增。擴增后產物送至上海生物生工公司進行測序。測序獲得的數據進行人工比對和校正,在NCBI 數據庫中BLAST 進行比對和數據相似性分析,借助MEGA7.0 軟件[18],將目的基因序列與相關序列用Clustal W 算法進行序列比對,利用p-distance計算[19]并構建N-J法系統發育樹[20]。
1.2.3 菌株的生理生化實驗
菌株生理生化鑒定包括接觸酶試驗、厭氧生長試驗(澆筑法)、檸檬酸鹽試驗、糖發酵試驗、淀粉水解試驗、V-P 試驗、明膠試驗。以上實驗的操作流程按照實驗流程進行。
1.2.4 菌種耐受性分析
1.2.4.1 耐酒精能力測定
分別制備初始酒精度為0、4 %vol、8 %vol、10 %vol 和12 %vol 的LB 液體培養基,將培養好的目的菌株按2%的接種量分別接到各培養基中,于37 ℃、185 r/min 培養24 h,600 nm 測其吸光度,每個樣品平行測3次取其平均值。
1.2.4.2 耐酸性能力測定
分別制備初始pH值為3.5、4.0、4.5、5.0、5.5、6.0的LB 液體培養基,將培養好的目的菌株按2 %的接種量分別接到各培養基中,于37 ℃、185 r/min 培養24 h,600 nm 測其吸光度,每個樣品平行測3 次取其平均值。
1.2.4.3 耐糖性能力測定
分別制備初始葡萄糖質量分數為0 %、5 %、10 %、15 %、20 %、25 %的LB 液體培養基,將培養好的目的菌株按2 %的接種量分別接到各培養基中,于37 ℃、185 r/min 培養24 h,600 nm 測其吸光度,每個樣品平行測3次取其平均值。
1.2.5 4-EG的GC-MS分析
初篩發酵液前處理方式:各發酵液在8000 r/min下離心5 min,離心2 次,得到的上清液用0.22 μm過濾器過濾,將濾液和95%乙醇1∶1 均勻混合。通過GC-MS進行檢測,采用外標法進行定量分析。
復發酵實驗發酵液前處理方式:將發酵液8000 r/min 離心5 min,離心2 次,取離心后的發酵液5 mL,加氯化鈉(約1.4 g)至飽和,振蕩搖勻,加入2 mL 二氯甲烷,振蕩搖勻后充分萃取1 min,8000 r/min離心5 min,取下層清液,進行定量測定[20]。
色譜條件:進樣口溫度250 ℃,初始溫度250 ℃;分流模式;初始柱溫50 ℃,保持1 min,以30 ℃/min 的速度升溫至280 ℃,保持2 min,分析時間10 min。
質譜條件:全掃描模式;離子源溫度280 ℃;掃描范圍40~500 amu。
2 結果與分析
2.1 菌落及形態學觀察
醬香型大曲樣品經過多次稀釋和劃線分離,根據平板上菌落的形態、顏色、菌落邊緣隆起情況、菌落的透明度等菌落特征(表2),并聞香初步識別篩選分離獲得10 株目的菌株。從形態上判斷10 株菌株均為細菌,分別對這些菌株進行產4-EG試驗。
以上10 株篩選獲得的菌株,觀察菌落形態(表2),結果表明所有菌株的形態學結果顯示在培養基上生長時一部分菌株菌落顏色為奶白色,另一部分為半透明,菌落扁平,除菌株wsp-3-3 邊緣不規則外,其余菌株的邊緣均表現出規則狀態,僅有菌株wsp-1-3菌落較小,其余菌落均較大。
對所有篩選的目的菌株進行3 次革蘭氏染色實驗(表3),結果顯示,除wsp-2-2 和wsp-4-1 外,其余均為革蘭氏陽性菌(圖1、圖2)。菌株wsp-2-2菌株的3 次染色實驗在顯微鏡下觀察為紅紫色,少量芽孢未染色成功,呈現藍色(圖2),判斷為革蘭氏陰性菌,同樣,菌株wsp-4-1 為革蘭氏陰性菌(圖2)。
圖1 菌株wsp-3-1革蘭氏染色和芽孢染色
圖2 菌株wsp-2-2和wsp-4-1革蘭氏染色和芽孢染色
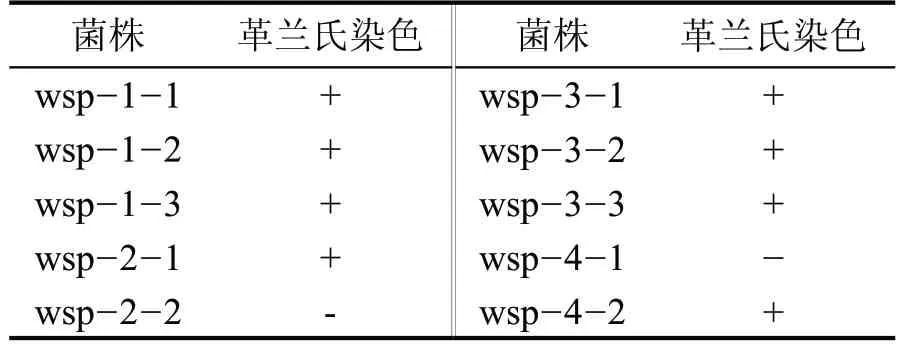
表3 菌株革蘭氏染色結果
2.2 菌株產4-EG能力測定
產4-EG 試驗發酵產物經過前處理后利用GC-MS 檢測發酵產物中揮發性組分,以揮發性組分中的4-EG 含量為基準,篩選獲得4-EG 產量較高的菌株(圖3)。外標法確定4-EG 的線性方程為y=2076576454.970x-135388350.970(R2=0.9927>0.99),可計算出各單菌落發酵液中4-EG 的含量(圖3)。
根據測定的實驗數據(圖3),除空白組外,其余菌株全部檢測出4-EG,wsp-3-1 發酵液中4-EG含量最高為149.53 μg/L,菌株wsp-2-2 的發酵液中4-EG 含量為141.30 μg/L,其余菌株相對較低(130 μg/L左右)。
將以上產量較高的菌株wsp-2-1、wsp-2-2、wsp-3-1 和wsp-4-1 進行復發酵實驗。發酵液經過改良的前處理后進行GC-MS 檢測,復發酵后菌株wsp-2-2 中4-EG 產量為245.3 μg/L,明顯高于菌株wsp-3-1中4-EG含量(121.3 μg/L),其余菌株產量均低于120 μg/L。
2.3 部分生理生化實驗鑒定
挑選產4-EG 較多的菌株wsp-2-1、wsp-2-2、wsp-3-1 和wsp-4-1 進行生理生化實驗,結果如表4所示。
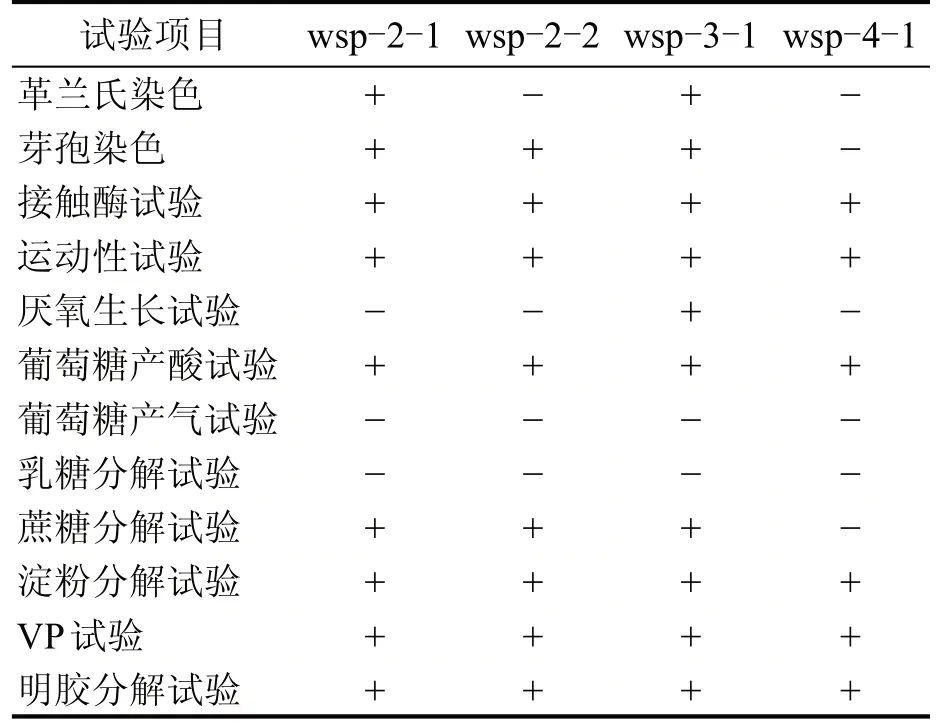
表4 生理生化結果
4株目的菌株革蘭氏染色、芽孢染色、接觸酶試驗、運動性試驗、葡萄糖產酸試驗、淀粉分解試驗、VP 試驗、明膠分解試驗均為陽性,葡萄糖產氣試驗、乳糖分解試驗為陰性。厭氧生長實驗菌株wsp-3-1 為陽性,蔗糖分解試驗菌株wsp-4-1 為陰性。
查閱《伯杰氏細菌鑒定手冊》和《常見細菌鑒定手冊》中芽孢桿菌屬的描述,發現以上4 株菌株有芽孢桿菌屬或類似芽孢桿菌屬微生物的特征,需要進一步的分子生物學鑒定。
2.4 菌株分子生物學鑒定
提取菌株wsp-2-1、wsp-2-2、wsp-3-1、wsp-4-1 的基因組DNA,以總DNA 為模板,經過PCR 擴增獲得16S rDNA 序列,擴增后的目標片段約1500 bp(圖4)。
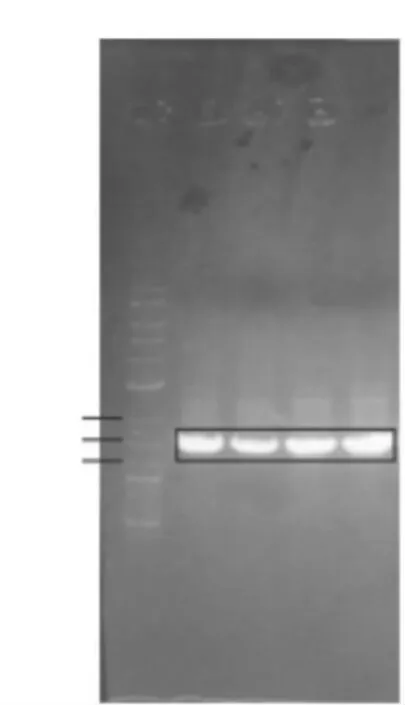
圖4 菌株DNA PCR產物電泳圖
根據擴增片段測序結果,菌株wsp-2-1、wsp-3-1、wsp-4-1 經過多次DNA 擴增,測序結果均為雙峰,以上3 菌株暫時未進行分子生物學鑒定。采用NCBI 提供的BLAST 程序將菌株wsp-2-2 的PCR 測序結果與GenBank 中已注冊的16S rRNA基因序列進行同源性比對,結果顯示,該菌株與芽孢桿菌屬(Bacillus sp.)的幾個種之間同源性均達到98%以上。因此,初步判斷菌株wsp-2-2 屬于芽孢桿菌屬Bacillus物種。
下載同源性已知序列和本實驗中的序列進行MEGA7.0 比對和人工校正,采用基于p 距離(pdistance)的鄰近法分別構建系統發育樹(圖5)。除Bacillus mesophilusACCC03113(序列號MK881071.1)序列長度為956 bp 外,其余菌株的序列長度在1415 bp 左右;堿基T、C、A、G 平均比例分別為20.8、23.0、25.6、30.7,菌株wsp-2-2 與上述平均比例基本一致(表5)。
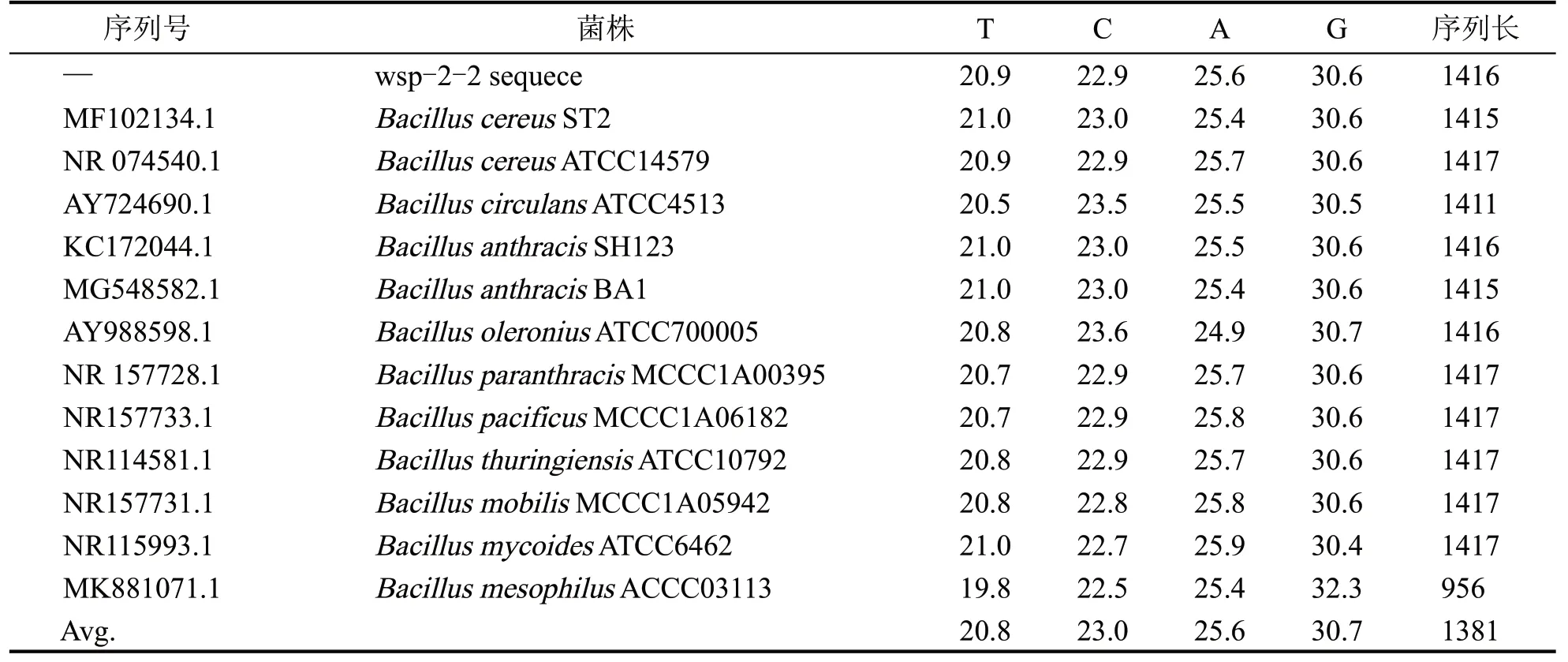
表5 序列簡介組成情況
根據序列的所有信息,選用p 距離(p-distance)和替換模型為轉換和顛換(substitutions to include d:Transitions +Transversions)進行序列間遺傳距離計算,所有序列的遺傳距離為0.000~0.073 之間,平均遺傳距離為0.029。菌株wsp-2-2 遺傳距離與Bacillus circulansATCC4513(0.06)、Bacillus oleroniusATCC700005(0.072)和Bacillus mesophilusACCC03113(0.066)均大于平均遺傳距離,推測菌株wsp-2-2 直接的系統發育關系較遠,與其余的物種距離較近(<0.029)。
基于以上序列信息,采用p 距離(p-distance)和替換模型為轉換和顛換(substitutions to include d:Transitions+Transversions)構建N-J 系統發育樹(圖5),可以看出:(1)Bacillus circulansATCC4513、Bacillus oleroniusATCC700005 和Bacillus mesophilusACCC03113 聚為一個單系,其余物種全部聚為一個單系;(2)菌株wsp-2-2 的序列與蠟樣芽孢桿菌Bacillus cereusATCC14579 聚為一支(自展值為85),表現出很近的親緣關系。上述結果與遺傳距離的結果基本一致。

圖5 基于p距離的菌株wsp-2-2構建N-J系統進化樹

表6 基于p距離的序列間遺傳距離(替換模型為轉換和顛換)
因此,結合形態學、生理生化實驗和系統發育樹結果,菌株wsp-2-2 確認為蠟樣芽孢桿菌Bacillus cereus,命名為Bacillus cereuswsp-2-2。
2.5 耐受性分析
根據單菌株發酵實驗產4-EG 的能力,選取菌株wsp-2-2進行耐受性分析。
2.5.1 耐酒精能力的測定
對篩選得到的蠟樣芽孢桿菌wsp-2-2 進行耐酒精能力的測定,從圖6 可以看出,隨著培養基中酒精濃度增加,在吸光度為600 nm 時的OD 值呈現出不斷下降的趨勢,當酒精濃度達到8%vol 時,菌株wsp-2-2 表現出基本上不生長,OD 值接近0,即在酒精濃度超過8 %vol 時菌株的生長受到明顯抑制。
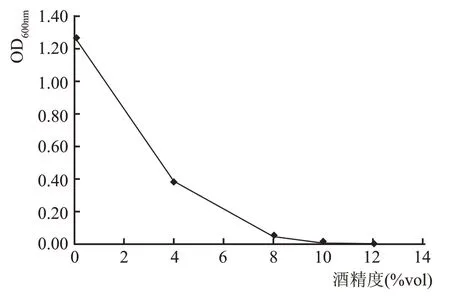
圖6 菌株wsp-2-2耐酒精能力
2.5.2 耐糖能力的測定
對篩選得到的菌株wsp-2-2 進行耐糖能力的測定(圖7),結果顯示,隨著培養基中糖度增加,在吸光度為600 nm 時的OD 值呈現出先上升后下降的趨勢。可能是隨著糖度的不斷增加,當糖度為10%時,菌株能夠充分利用糖進行生長,提供生長充足的碳源和良好的生長環境;當糖度小于10 %時,提供的碳源相對不足,造成生長速度相對緩慢;當糖度大于10 %時(特別是超過15 %時),糖度較高形成了高滲透壓的環境,生長曲線急劇下降,使菌的生長受到了顯著的限制。
2.5.3 耐酸能力的測定
對篩選得到的菌株wsp-2-2 進行耐酸能力的測定(圖8),結果顯示,隨著培養基中pH 值不斷上升,OD600nm呈現不斷增加的趨勢,當pH 值小于5時,OD600nm基本接近0,菌株的生長明顯受到抑制,當pH 值為5.5 時,菌株基本上可以正常生長,說明該菌株在偏酸性的培養基或者培養環境中生長。
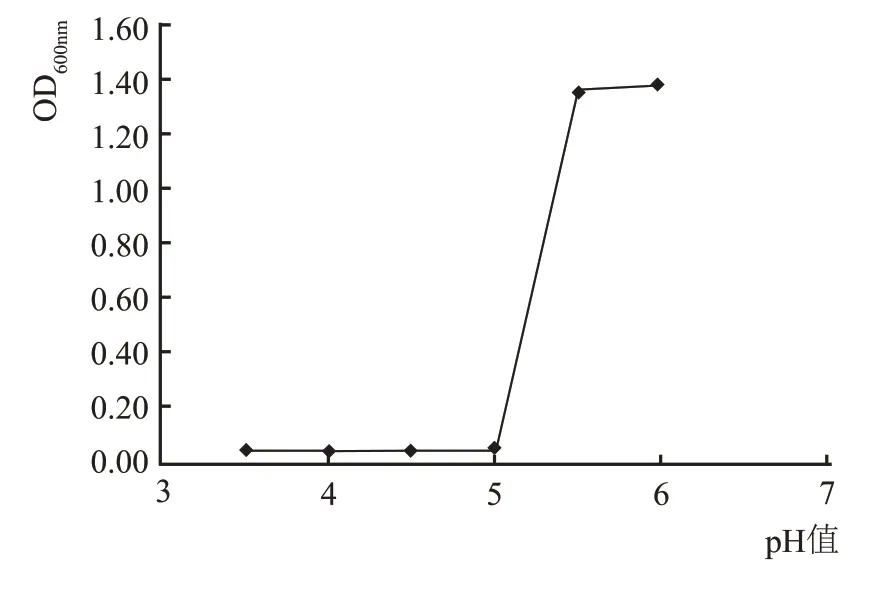
圖8 菌株wsp-2-2耐酸能力
3 結論
本實驗以醬香型大曲為原料,進行80 ℃高溫處理,經過富集、初篩和復篩,以及發酵實驗,獲得4-EG 含量最高的菌株為wsp-2-2(245.3 μg/L)。生理生化試驗顯示,菌株wsp-2-2 革蘭氏染色鏡檢陰性,葡萄糖試驗產酸不產氣,能分解蔗糖和淀粉,不能分解乳糖,接觸酶試驗呈陽性,明膠分解試驗呈陽性,運動性試驗呈陽性,VP 試驗呈陽性,都符合芽孢桿菌屬的描述,初步判定為芽孢桿菌屬物種。通過16S rDNA 測序,在NCBI 上Blast 比對后可以確定其種屬,菌株的系統進化樹結果顯示菌株wsp-2-2 為蠟樣芽孢桿菌Bacillus cereus。菌株wsp-2-2 耐受性試驗結果表明菌株wsp-2-2 耐4 %vol 酒精度、15 %的糖度和pH5.5 的酸堿度,為白酒生產中控制4-EG 的含量提供了一定的參考,也為生產健康保健功效的醬香型白酒打下了基礎。

