非小細胞肺癌免疫治療相關超進展預測分析
張夢,高佳男,張國俊,常靜俠
(鄭州大學第一附屬醫院 呼吸與危重癥醫學科,河南 鄭州 450052)
肺癌是全球病死率最高的惡性腫瘤,約85%的患者病理類型是非小細胞肺癌(non-small cell lung cancer,NSCLC),對于晚期NSCLC,傳統放化療治療效果有限,患者的5 a生存率不足5%[1-2]。近年來,腫瘤邁入“精準治療”時代,免疫檢查點抑制劑(immune checkpoint inhibitors,ICIs)的誕生改變了晚期NSCLC治療的格局,ICIs主要通過阻斷T細胞的程序性死亡受體-1(programmed death-1,PD-1)與腫瘤細胞表達的程序性死亡受體配體-1(programmed death-ligand 1,PD-L1)結合或細胞毒性T淋巴細胞相關抗原-4(cytotoxic T lymphocyte antigen 4,CTLA-4)抗體與CD80(B7-1)的結合,改變腫瘤細胞的微環境,恢復T淋巴細胞的免疫功能,從而抑制腫瘤的免疫逃逸。目前多個PD-1/PD-L1抑制劑已獲批用于晚期NSCLC的一線、二線治療[3-4]。雖然ICIs在晚期NSCLC治療中的優勢毋庸置疑,也有報道稱部分患者會出現短期內腫瘤快速進展的現象,在2016年,Chubachi等[5]首次報道了1例NSCLC患者接受免疫治療后短期內出現了疾病的迅速進展。在2017年,Champiat等[6]首次將免疫治療后腫瘤出現迅速進展的現象命名為超進展(hyperprogressive disease,HPD)。先前多項研究通過治療失敗時間(time to treatment failure,TTF)及影像學評估腫瘤生長率對HPD進行定義[7-9],但此定義存在一定的缺陷,如臨床實踐中往往無法獲得完整的3次(ICIs前6周內、基線時、ICIs后8周內)影像資料,且忽視了臨床狀況(如體力狀態)的變化、不同進展模式如遠處轉移、或非靶病灶進展情況。后Lo Russo等[10]的研究將體力評分、非靶病灶變化情況納入,制定了臨床及影像學標準。HPD并不是免疫治療特有的現象,但對接受免疫治療患者的預后結局有影響。目前對于NSCLC免疫治療相關HPD危險因素的研究較少,為了避免ICIs治療過程中的潛在風險,有必要積極探索與HPD發生相關的危險因素,本研究探究了晚期NSCLC患者免疫治療相關的HPD,并對一些臨床參數進行回顧性分析,旨在構建預測HPD發生的列線圖評分系統,為臨床醫生早期識別高危患者提供參考。
1 對象與方法
1.1 研究對象納入2019年1月至2021年6月在鄭州大學第一附屬醫院接受免疫治療的316例晚期NSCLC患者為研究對象,按照第8版國際肺癌TNM分期標準[11]進行臨床分期。該研究征得醫院醫學倫理委員會批準,倫理批號為2023-KY-0029。
1.2 納入標準(1)患者≥18歲;(2)經病理組織學或細胞學確診為NSCLC,腫瘤TNM分期為ⅢB~Ⅳ期;(3)規律連續應用免疫治療至少2個周期;(4)有2次CT影像學資料(基線時、用藥后8周內),2次評估至少間隔2周;(5)基于實體腫瘤反應評估標準RECIST 1.1[12]判斷目標病變變化。CT掃描結果由2名資深放射科醫生進行評估。
1.3 排除標準(1)合并其他部位的原發性惡性腫瘤;(2)有嚴重的免疫系統疾病或精神疾病等;(3)心、腎、肝等重要器官嚴重功能障礙;(4)孕期及哺乳期婦女。
1.4 HPD標準(1)TTF<2個月;(2)基線和第1次放射學評估之間靶病灶直徑總和至少增加50%;(3)基線和第1次放射學評估之間已經受累的器官中出現至少2個新進展;(4)基線和第1次放射學評估之間出現新的器官轉移病灶;(5)臨床癥狀惡化,治療后2個月內東部腫瘤協作組體力狀態評分(Eastern Cooperative Oncology Group performance status,ECOG PS)降低≥2分[13]。滿足以上至少3個臨床或放射學標準的患者被定義為HPD患者,而根據RECIST 1.1評估為腫瘤進展,但不滿足以上至少3個標準的患者被定義為非HPD的腫瘤進展患者[10,14]。
1.5 研究方法檢索鄭州大學第一附屬醫院病歷系統,回顧性收集患者的一般資料、影像及實驗室檢查、治療方案及預后信息等,隨訪采用電話隨訪的形式。總生存時間(overall survival,OS)定義為接受免疫治療至患者因任何原因死亡或隨訪結束的時間;無進展生存期(progression-free survival,PFS)定義為接受免疫治療開始到評估疾病進展、死亡或隨訪結束的時間;TTF定義為從免疫治療開始到因任何原因(包括副反應、進展、患者選擇新的治療方法或死亡)而停止治療的持續時間。
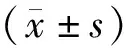
2 結果
2.1 HPD與臨床病理特征的關系共有316例接受PD-1/PD-L1抑制劑患者納入本研究,根據上述HPD評價標準將患者分為非HPD組和HPD組。非HPD組與HPD組患者的性別、年齡、吸煙史、組織學類型、PD-L1表達、臨床分期、肝轉移、腦轉移、區域淋巴結轉移、是否放療、EGFR、ALK、KRAS基因突變狀態等方面差異無統計學意義(P>0.05)。非HPD組和HPD組T分期、轉移位置數目、骨轉移、對側肺及胸膜轉移、治療方式比較,差異有統計學意義(P<0.05)。見表1。

表1 HPD與臨床病理特征的關系
2.2 各亞組生存及治療反應狀態HPD組的中位OS(4.0個月)較非HPD組(11.7個月)縮短(P<0.05)。非HPD組中疾病控制狀態的患者中位OS為21.0個月,疾病進展患者中位OS為11.0個月,各亞組生存曲線見圖1。ICIs治療后首次評估顯示,患者客觀緩解率、疾病控制率分別為35.13%、86.08%,其中非HPD組患者1 a生存率為47.19%,HPD組患者的1 a生存率為7.69%。見表2。

A為HPD組與非HPD組的Kaplan-Meier生存曲線;B為HPD組、疾病進展組和疾病控制組的生存曲線。

表2 ICIs治療后首次評估患者的臨床反應狀態
2.3 晚期NSCLC患者免疫治療相關HPD發生的影響因素單因素logistic回歸結果顯示,轉移位置數目、乳酸脫氫酶(lactate dehydrogenase,LDH)基線值及變化量、糖類抗原125(carbohydrate antigen 125,CA125)、cyfra21-1基線值及首次評估時百分比變化、癌胚抗原(carcinoembryonicantigen,CEA)首次評估時變化率與HPD發生有關。對P<0.05的變量進行多因素logistic回歸分析,結果顯示轉移位置數目≥3個、LDH變化量、CA125百分比變化是HPD發生的獨立危險因素。見表3、4。

表3 自變量賦值情況說明
2.4 晚期NSCLC患者免疫治療相關HPD的風險列線圖建立及驗證運用R語言對上述3個獨立危險因素構建列線圖預測模型。見圖2A。ROC曲線分析列線圖預測模型的預測能力,曲線下面積為0.95(95% CI為0.819~1.000),說明該模型預測能力良好。見圖2B。使用Bootstrap對模型進行內部驗證,獲得校正曲線,3條曲線走向一致且靠攏,校正曲線表現良好,顯示列線圖模型與理想模型一致性尚可,并且經內部驗證,結果顯示模型具有良好的預測靈敏度。見圖2C。

A為接受免疫治療的NSCLC發生HPD風險的列線圖;B 為HPD風險預測模型的ROC曲線;C 為HPD風險預測模型的校準曲線。
2.5 晚期NSCLC患者免疫治療中的假性進展免疫治療另一個特別的進展方式是假性進展,指初始評估時疾病進展,繼續治療達到完全或部分緩解或持續超過6個月的疾病穩定狀態,病理主要表現為腫瘤周圍免疫細胞浸潤、水腫和壞死,一般不影響患者的生存結局[15]。本研究通過條形圖描述了2種進展模式不同的治療反應,結果顯示316例接受免疫治療的NSCLC患者有13例(4.11%)發生HPD,3例(0.95%)發生假性進展。見圖3。

表4 晚期NSCLC的病理參數與HPD發生的單因素及多因素回歸分析

1~13為HPD患者,14~16為假性進展患者。
3 討論
免疫治療主要通過阻止腫瘤的免疫逃逸發揮作用,研究表明阻斷PD-1/PD-L1通路能夠恢復T淋巴細胞的活性,發揮免疫系統抗腫瘤的作用[16]。多項臨床研究已經證明無論PD-1或PD-L1表達狀態如何,晚期NSCLC患者均可在免疫治療中獲益[17-19]。
HPD是指ICIs治療后短期內出現腫瘤負荷迅速增大或臨床癥狀迅速惡化,組織病理學常表現為腫瘤細胞的增殖,發生HPD的患者往往預后極差[20]。HPD的發生可能與ICIs阻斷PD-1/PD-L1后調節性T淋巴細胞上調、效應T細胞耗竭介導抑制性的腫瘤微環境、免疫抑制性細胞因子分泌增加以及致癌通路的激活直接影響腫瘤細胞等有關[15]。HPD的發生究竟是與免疫治療相關還是只是腫瘤生長的自然現象尚存在爭議。
Kim等[21]對多種惡性腫瘤免疫治療期間的HPD現象進行薈萃分析,發現與HPD相關的臨床病理指標分別是高于正常值上限的LDH、2個以上轉移部位、肝轉移、ECOG PS評分≥2分、PD-L1表達狀態。在其他研究中,年齡≥65歲、實驗室檢查如NLR、LDH水平等也與HPD的發生相關[6,22-23]。本研究中轉移位置數目≥3個、LDH變化量、CA125變化率是HPD發生的獨立危險因素,同時根據上述危險因素構建預測HPD發生的列線圖評分系統。已有研究證明基線時較高的LDH與抗PD-1/PD-L1治療期間HPD的高風險相關,血清LDH升高已被確定是腫瘤預后不良的標志物,LDH升高反映腫瘤組織缺氧和細胞外環境的酸化,而高LDH水平和酸性的環境可能會導致腫瘤細胞增殖、抗凋亡能力增強,并影響抗體的功能和抗原的構象,從而影響ICIs的特異性和親和力[24-25]。CA125是一種應用廣泛的腫瘤標志物,NSCLC患者血清中CA125的陽性率較高,雖然多數患者會出現CA125的升高,但其短期內升高的百分比是預測HPD發生的有效預測因子,本研究發現接受免疫治療的NSCLC患者短期內LDH及CA125升高程度可能對HPD的發展具有指示性作用。
多研究表明相較于聯合化療或抗血管治療,單藥ICIs治療的患者HPD發生率較高,化療及抗血管生成藥物與免疫治療具有協同作用,能夠提高抗腫瘤活性[22,25]。對于HPD的高危患者應避免單藥免疫治療,聯合化療或抗血管治療可能降低HPD發生的風險,此外發生HPD后的化療和/或抗血管生成藥物的挽救治療可能為患者帶來生機,對于HPD高危患者,評估間歇可適當縮短,并盡早進行影像學評估或病理活檢,早期識別HPD現象能夠最大限度地使HPD患者獲益于免疫治療后的挽救治療。HPD的危險因素及發生率在現有不同研究中結果不完全一致,可能與樣本量較小或評價標準不一致有關,對于免疫治療相關的HPD現象需要更大樣本的深入研究。
綜上所述,本研究探索了晚期NSCLC患者免疫治療相關的HPD,并對一些臨床參數進行基線時和用藥兩周期動態評估,發現轉移位置數目≥3個、LDH變化量、CA125百分比變化是HPD發生的獨立危險因素,根據HPD發生的高危因素,構建了預測HPD發生的列線圖預測模型,將有助于為臨床醫生的治療決策提供參考。

