山慈菇多糖對肝癌腹水荷瘤小鼠癥狀的改善機制
張志強,魏毅強,楊亞莉,張曉菲
1.新鄉市第一人民醫院消化內科一病區,新鄉 453000;2.鄭州大學第一附屬醫院消化內科,鄭州 450000
肝癌是迄今為止已發現的腫瘤中異質性極強的惡性疾病[1],主要危險因素包括乙型肝炎/丙型肝炎病毒感染、飲酒、黃曲霉毒素B1和代謝紊亂等[2]。手術切除是治療肝癌的首選方式[3];在轉移性病例中,化療是有效選擇,但其在提高惡性腫瘤患者的生存率的同時,往往伴隨著嚴重不良反應[4-5]。山慈菇具有抗炎、抗菌、抗腫瘤、抗血管生成等多種藥理活性[6],可用于抗癌[7]。山慈菇多糖為山慈菇的主要生物活性成分,可提高機體免疫、抑制H22肝癌小鼠腫瘤細胞生長[8]。本研究擬通過構建肝癌腹水荷瘤小鼠模型,探討山慈菇多糖的作用,并檢測哺乳動物雷帕霉素靶蛋白(mammalian rapamycin target protein,mTOR)通路相關蛋白表達情況,以闡明山慈菇多糖對模型小鼠癥狀的改善作用機制。
1 儀器與材料
1.1 儀器
多功能酶標儀購自美國Thermo Fisher Scientific有限公司;化學發光凝膠成像系統(FluorChem FC3)購自美國Protein Simple公司。
1.2 試藥
山慈菇多糖(質量分數≥90%,編號WKQ-0008303)購自四川省維克奇生物科技有限公司;環磷酰胺對照品(編號03121693)購自上海甄準生物科技有限公司;胎牛血清(編號12657-029)購自美國Invitrogen有限公司;Beclin1(編號PB9076)、B細胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2,Bcl-2)(編號BM0200)、Bcl-2相關X蛋白(Bcl-2 related X protein,Bax)(編號A00183)抗體均購自武漢博士德生物工程有限公司;血小板內皮細胞粘附分子1(platelet endothelial cell adhesion molecule 1,CD31,編號bs-0468R)、磷脂酰肌醇-3激酶(phosphatidylinositol-3 kinase,PI3K,編號bs-6423R)、p-PI3K(編號bs-6417R)抗體購自北京博奧森生物技術有限公司;蛋白激酶B(protein kinase B,AKT,編號YT636)、p-AKT(編號YT637)抗體、mTOR(編號YT823)抗體購自北京百奧萊博科技有限公司;p-mTOR(編號sc-101738)抗體購自Santacruze公司;血管內皮生長因子(vascular endothelial growth factor,VEGF,編號AV202)抗體購自上海碧云天生物技術有限公司。
1.3 實驗動物與細胞株
6周齡C57BL/6小鼠55只,SPF級雄性近交系,購自濟南朋悅實驗動物繁育有限公司,許可證號為SCXK(魯)2019-0003,小鼠體質量為(20±5) g;腹水型肝癌H22細胞株購自中國科學院上海細胞庫。
2 方法
2.1 細胞培育與收集
H22細胞接種至RPMI 1640培養基(含100 mL·L-1胎牛血清及100 U·mL-1青-鏈霉素),于37 ℃、體積分數5%的二氧化碳培養箱內培養。收集細胞并調整其密度為2×106個·mL-1,吹打均勻后于5只小鼠腹腔內注射0.2 mL,7 d后抽取乳白色腹水,以1 000 r·min-1離心5 min,棄上清,生理鹽水重懸并稀釋細胞至密度為1×106個·mL-1,備用。
2.2 造模、分組及給藥
小鼠于室溫(22±2) ℃,相對濕度為50%~70%環境下普通飼養,12 h光照-黑暗交替,適應1周后,隨機選取10只小鼠作為正常組,剩余40只小鼠用于構建肝癌腹水荷瘤小鼠模型[9]。吸取稀釋后的H22細胞懸液0.2 mL,接種于右前腋皮下。小鼠放回籠內并持續觀察,若接種部位觸摸有實體樣結節、腹部脹大即為建模成功,所有小鼠均成功建模。后隨機分為模型組、山慈菇多糖低劑量、高劑量組及環磷酰胺組,每組各10只。山慈菇多糖低劑量、高劑量組[10]及環磷酰胺組腹腔注射給藥量分別為200、400、20 mg·kg-1·d-1,正常組及模型組小鼠均腹腔注射等體積生理鹽水0.2 mL,1天1次,連續14 d。
2.3 樣品采集與處理
各組小鼠末次給藥結束后,觀察并稱定質量;抽取小鼠腹水并記錄腹水體積;眼眶靜脈叢取血,血細胞計數板計RBC和WBC總數;脫頸致死后,迅速解剖剝離瘤體,清理并擦拭表面液體后稱定質量;清理并擦拭脾臟、胸腺表面液體后稱定質量;瘤體一部分保存于40 g·L-1多聚甲醛中,一部分置于液氮中保存,備用。
2.4 小鼠抑瘤率計算
用抑瘤率評估藥物抗腫瘤活性,抑瘤率(%)=(模型組小鼠平均瘤質量-治療組小鼠平均瘤質量)/模型組小鼠平均瘤質量×100%。
2.5 小鼠臟器指數計算
通過胸腺指數和脾臟指數評估治療對免疫器官功能的影響。脾臟指數(mg·g-1)=脾臟質量/體質量;胸腺指數(mg·g-1)=胸腺質量/體質量。
2.6 腫瘤組織病理學染色
正常小鼠肝臟及造模小鼠腫瘤組織經多聚甲醛過夜固定,常規石蠟包埋,并制備為4 μm厚度組織切片,二甲苯、乙醇脫蠟至水,蘇木素染液染核3 min,伊紅染液染色30 s,梯度乙醇脫水,二甲苯透明,晾干后中性樹膠封片,鏡下觀察并采集圖片。
2.7 TUNEL染色檢測腫瘤細胞凋亡指數
組織切片經二甲苯洗滌,梯度乙醇脫水,無DNase蛋白酶K溶液處理20 min,TUNEL反應液反應1 h,顯色,蘇木精復染,梯度乙醇脫水,二甲苯透明,中性樹膠封片。見細胞質或細胞核中有棕色顆粒,即呈染色陽性,細胞凋亡指數=(TUNEL陽性細胞數/細胞總數)×100%。
2.8 免疫組化檢測血管生成
組織切片經二甲苯和梯度乙醇脫蠟、水合,用過氧化氫溶液淬滅內源性過氧化物酶活性,抗原修復,山羊血清封閉,將切片與CD31抗體(1∶500稀釋)于4 ℃孵育過夜,后于二抗溶液中孵育1 h,DAB顯色,蘇木精復染細胞核,乙醇脫水,Image-Pro Plus 軟件觀察并計數陽性染色細胞,評估血管生成情況。
2.9 檢測瘤組織mTOR通路相關蛋白表達情況
取液氮中肝臟及腫瘤組織,稱取100 mg并碾碎裂解,以12 000 r·min-1離心10 min,取上清。統一蛋白質量濃度并加熱變性,用SDS-PAGE凝膠電泳分散蛋白(壓縮膠60 V,20 min;分離膠120 V,65 min),轉移蛋白至PVDF膜(200 mA,2 h);PVDF膜于脫脂乳中封閉2 h后直接與稀釋后一抗(1∶1 000)于4 ℃孵育過夜;次日換液洗膜,辣根過氧化物酶標記的羊抗兔IgG(H+L)二抗(1∶8 000稀釋)孵育2 h,洗膜,ECL發光液反應顯影,用化學發光凝膠成像系統曝光并拍照記錄。用Image J軟件分析條帶灰度值,以目的蛋白Beclin1、Bcl-2、Bax及VEGF蛋白相與內參GAPDH灰度值比值表示蛋白的相對表達量,以p-PI3K/PI3K、p-AKT/AKT及p-mTOR/mTOR比值評價蛋白活性。
2.10 統計學分析
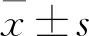
3 結果
3.1 小鼠體征及體質量
正常組小鼠飲食活動及精神狀態正常,被毛光滑,皮膚、黏膜顏色未見異常;模型組小鼠反應遲緩,食物及飲水減少,腹脹、機體消瘦,皮膚暗沉,被毛無光澤,小便發黃;治療組小鼠較模型組癥狀有所改善。體質量比較結果顯示,5組小鼠體質量差異無統計學意義(P>0.05)。見表1。
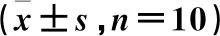
表1 各組小鼠治療后體質量比較
3.2 小鼠腹水形成情況
抽取模型小鼠腹水,見模型組小鼠黏稠血性腹水,3個給藥組小鼠腹水均呈不同程度的血色渾濁。模型組、山慈菇低劑量、高劑量組及環磷酰胺組小鼠腹水體積差異具有統計學意義(P<0.05)。與模型組比較,山慈菇多糖低劑量、高劑量組及環磷酰胺組小鼠腹水體積減少(P<0.05);與山慈菇多糖低劑量組比較,高劑量組及環磷酰胺組小鼠腹水體積減少(P<0.05),環磷酰胺組小鼠腹水體積最少(P<0.05)。見表2。
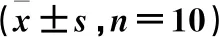
表2 各組小鼠腹水體積比較
3.3 小鼠外周血RBC、WBC總數
計數結果顯示,5組小鼠外周血RBC、WBC總數差異具有統計學意義(P<0.05)。進一步兩兩比較結果顯示,與正常組比較,模型組小鼠RBC總數減少,WBC總數增加(P<0.05);與模型組比較,3個給藥組小鼠RBC總數增加,WBC總數減少(P<0.05);與山慈菇多糖低劑量組比較,高劑量組及環磷酰胺組RBC總數增加,WBC總數減少(P<0.05),環磷酰胺組小鼠RBC總數最高,WBC總數最低(P<0.05)。見表3。
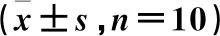
表3 RBC、WBC總數比較
3.4 小鼠腫瘤質量及抑瘤率
結果顯示,4組模型小鼠腫瘤質量差異有統計學意義(P<0.05)。與模型組比較,3個給藥組小鼠腫瘤質量降低(P<0.05);與山慈菇多糖低劑量組比較,高劑量組及環磷酰胺組小鼠腫瘤質量降低(P<0.05),環磷酰胺組小鼠腫瘤質量最低(P<0.05)。經抑瘤率計算,結果顯示山慈菇多糖低劑量組抑瘤率最低(P<0.05)。見表4。
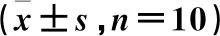
表4 各組小鼠腫瘤質量及抑瘤率比較
3.5 小鼠脾臟、胸腺指數
結果顯示,5組小鼠脾臟指數、胸腺指數差異有統計學意義(P<0.05)。與正常組比較,模型組小鼠脾臟指數、胸腺指數均降低(P<0.05);與模型組比較,3個給藥組小鼠脾臟指數、胸腺指數均升高(P<0.05);與山慈菇多糖低劑量組比較,高劑量組及環磷酰胺組小鼠脾臟指數、胸腺指數均升高(P<0.05),環磷酰胺組小鼠脾臟指數、胸腺指數最高(P<0.05)。見表5。
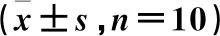
表5 各組小鼠脾臟指數、胸腺指數比較
3.6 小鼠腫瘤組織學觀察
HE染色結果顯示,與正常組肝組織比較,模型組腫瘤細胞結構完整,排列整齊,生長良好,異型性高,血管豐富;與模型組比較,3個給藥組小鼠腫瘤細胞皺縮、破碎、凋亡,排列不規則,壞死區域逐漸擴大。見圖1。

注:A.正常組;B.模型組;C.山慈菇多糖低劑量組;D.山慈菇多糖高劑量組;E.環磷酰胺組。
3.7 小鼠腫瘤細胞凋亡指數
TUNEL染色結果顯示,3個給藥組小鼠腫瘤組織見有明顯凋亡陽性細胞。計量結果顯示,4組小鼠腫瘤細胞凋亡指數差異具有統計學意義(P<0.05)。與模型組比較,3個給藥組小鼠腫瘤細胞凋亡指數升高(P<0.05);與山慈菇多糖低劑量組比較,山慈菇多糖低劑量、高劑量組及環磷酰胺組小鼠腫瘤細胞凋亡指數升高(P<0.05),環磷酰胺組小鼠腫瘤細胞凋亡指數最高(P<0.05)。見圖2、表6。
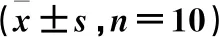
表6 腫瘤細胞凋亡指數比較

注:A.正常組;B.模型組;C.山慈菇多糖低劑量組;D.山慈菇多糖高劑量組;E.環磷酰胺組。
3.8 小鼠腫瘤組織血管生成情況
免疫組化結果顯示,各組小鼠肝臟、腫瘤組織中CD31陽性血管數差異具有統計學意義(P<0.05)。與正常組比較,模型組腫瘤組織中CD31陽性血管數增多(P<0.05);與模型組比較,3個給藥組小鼠腫瘤組織中CD31陽性血管數減少(P<0.05);與山慈菇多糖低劑量組比較,山慈菇多糖高劑量組及環磷酰胺組小鼠腫瘤組織中CD31陽性血管數減少(P<0.05),環磷酰胺組小鼠腫瘤組織中CD31陽性血管數最少(P<0.05)。見表7、圖3。
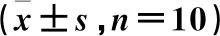
表7 各組小鼠CD31陽性血管數比較
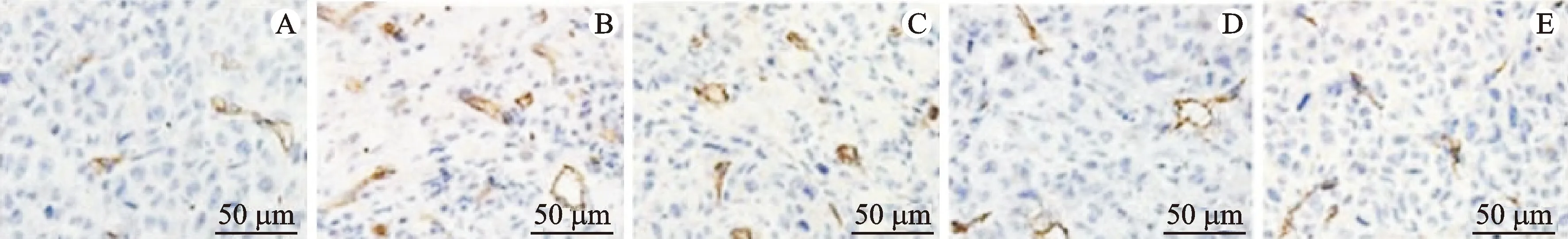
注:A.正常組;B.模型組;C.山慈菇多糖低劑量組;D.山慈菇多糖高劑量;E.環磷酰胺組。
3.9 mTOR通路相關蛋白表達情況
Western blot結果顯示,5組大鼠組織中p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR、Beclin1、Bcl-2、Bax及VEGF蛋白相對表達水平差異有統計學意義(P<0.05)。與正常組比較,模型組p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR、Bcl-2及VEGF蛋白相對表達水平升高,Beclin1及Bax蛋白相對表達水平降低(P<0.05);與模型組比較,3個給藥組p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR、Bcl-2及VEGF蛋白相對表達水平降低,Beclin1及Bax蛋白相對表達水平升高(P<0.05);與山慈菇多糖低劑量組比較,多糖高劑量組及環磷酰胺組小鼠腫瘤組織中p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR、Bcl-2及VEGF蛋白相對表達水平降低,Beclin1及Bax蛋白相對表達水平升高(P<0.05),環磷酰胺組改變最明顯(P<0.05)。見圖4、表8。

注:A.正常組;B.模型組;C.山慈菇多糖低劑量組;D.山慈菇多糖高劑量組;E.環磷酰胺組。
表8 各組小鼠腫瘤組織中mTOR通路相關蛋白相對表達水平
4 討論
本研究用H22細胞腹水接種成功構建肝癌腹水荷瘤小鼠模型,經山慈菇多糖低劑量、高劑量治療,結果顯示,山慈菇多糖可降低腫瘤體質量,山慈菇多糖低劑量、高劑量抑瘤率分別為25.31%、45.57%,并可促進腫瘤組織中心細胞壞死,提示山慈菇多糖可有效抑制腫瘤生長,延緩癌癥發展。
免疫系統在阻止腫瘤發展并抑制已形成腫瘤方面發揮重要作用,在免疫缺陷背景下癌癥的增殖和轉移更容易發生[11]。脾臟和胸腺指數反映了機體的免疫功能,指數增加表明免疫增強[12]。本研究結果顯示,模型組小鼠脾臟指數及胸腺指數降低,且血液中WBC總數升高,提示機體免疫功能低下;而經山慈菇多糖低劑量、高劑量治療后,臟器指數增加,WBC總數減少,提示山慈菇多糖具有抗腫瘤活性的免疫調節特性;惡性腹水治療對于改善腹部惡性腫瘤的預后具有重要意義,本研究表明,模型組小鼠血性腹水量多,血液中RBC總數減少,提示機體貧血;經山慈菇多糖低、高劑量治療后,出血性腹水減少,RBC總數增加,提示山慈菇多糖可改善機體機能,減少腹水形成,抑制不良病理進展。
轉移是癌癥發展的重要標志,涉及多種因素,如腫瘤血管生成、炎癥性腫瘤微環境的發展和程序性細胞死亡的缺陷[13]。轉移過程的成功依賴于惡性細胞逃避凋亡的能力[14],而細胞凋亡可通過殺死錯位細胞阻止轉移[15]。自噬在癌癥轉移中的作用復雜,可通過過度地自我消化和凋亡激活直接或間接誘導自噬細胞死亡,從而抑制腫瘤進展[16];自噬缺陷增加氧化應激、DNA損傷和基因組不穩定性,從而促進癌癥的發生和發展[17]。CD31用于評估腫瘤血管生成,VEGF是一種重要的促血管生成因子,Bcl-2為抗細胞凋亡因子,Bax與Bcl-2作用相反,通過Bax過表達可促進肝癌細胞凋亡[18],Beclin1為自噬標記物。本研究結果顯示,山慈菇多糖可顯著減少CD31陽性血管數,降低Bcl-2及VEGF蛋白表達,促進Bax及Beclin1蛋白表達,提示山慈菇多糖可能通過減少血管生成、促進自噬及凋亡,從而抑制腫瘤生長。研究表明,自噬激活可抗血管生成,促進腫瘤細胞凋亡[19],而mTOR是自噬負調控和抗腫瘤藥物的藥理學靶點,PI3K/AKT/mTOR信號通路與腫瘤發生發展密切相關[20]。本研究結果顯示,模型組小鼠PI3K/AKT/mTOR活性升高,山慈菇多糖可顯著降低PI3K/AKT/mTOR活性,提示山慈菇多糖的抗腫瘤作用可能與抑制PI3K/AKT/mTOR激活、誘導自噬發生,進而抑制血管生成并促進腫瘤細胞凋亡有關。
綜上所述,山慈菇多糖可抑制腫瘤生長、調節機體免疫,延緩癌癥發展,有效改善模型小鼠病理癥狀,其機制可能與抑制PI3K/AKT/mTOR通路激活有關。

