TBX15在結直腸癌組織中的表達及其臨床意義
陳代儒,羅香蓉,李 勝,喻遠尤,張 斌,劉天云
(南華大學附屬邵陽醫院,湖南 邵陽 422000)
結直腸癌是我國最常見的惡性腫瘤之一。其發病率在我國所有惡性腫瘤中居于第3 位,致死率居于第5 位(在城市地區僅次于肺癌居于第2 位)[1]。2015 年全國新發和死亡的結直腸癌患者分別占全部惡性腫瘤患者的9.87% 和8.01%[2]。內鏡手術切除+術后輔助放化療是結直腸癌標準的治療方式。有研究指出,結直腸癌較容易發生轉移,14% ~25% 的結直腸癌患者在原發腫瘤確診時就發生了轉移,高達50% 的患者在發病過程中會發生肝轉移,最終會有40% ~50% 的患者死于結腸癌遠處轉移[3-4]。局部淋巴結轉移及遠處轉移是影響結直腸癌患者預后的重要因素,Ⅲ、Ⅳ期結直腸癌患者的五年生存率僅為58.4%、14.4%[5]。TNM 分期是目前預測結直腸癌患者預后的最佳指標。近年來臨床上發現了一些預測指標能夠協助判斷結直腸癌患者的預后。TBX15 是T-box家族中的一員,在人體生長發育中發揮著多種生理作用。TBX15 基因的突變缺失可能導致人類及小鼠外耳形態發育異常[6],TBX15 在人類前脂肪細胞中過表達會降低細胞內甘油三酯的積累量,抑制線粒體的呼吸作用、負向調節氧化作用。其能夠驅動脂肪細胞中糖酵解代謝的增加。有研究指出,TBX15 在前脂肪細胞中的表達水平與糖酵解代謝標志物水平呈正相關,與肥胖程度呈負相關,其可能成為肥胖治療的靶點[7-8];同時其在骨骼肌的糖酵解中發揮著重要作用,其缺失可能導致代謝綜合征表型的發展,包括肥胖、肝脂肪變性和葡萄糖耐受不良[9]。研究表明,TBX15 在多種腫瘤的發生發展中扮演著重要的角色,TBX15 過表達能增強腫瘤細胞抗凋亡特性,促進腫瘤細胞的生長和轉移。在轉染TBX15 48 小時后,甲狀腺癌細胞的增殖能力會顯著增強,其抗凋亡性也會得到增強[10]。有研究指出,TBX15 在腎透明細胞癌組織中的過表達能夠促進癌細胞的增殖、遷移和侵襲[11]。TBX15 有可能成為腫瘤的潛在治療靶點。TBX15 與結直腸癌的關系目前臨床上暫無報道。本研究主要是通過采用免疫組化法檢測TBX15 蛋白在結直腸癌組織中的表達來探究其與結直腸癌患者臨床病理特征及預后的關系。
1 資料與方法
1.1 標本及數據收集
收 集2016 年7 月1 日 至2017 年7 月31 日 在 南華大學附屬邵陽醫院經手術切除的結直腸癌組織標本103 例及癌旁正常組織50 例。通過南華大學附屬邵陽醫院住院電子病理系統收集患者臨床病理資料的相關信息(包括年齡、性別、腫瘤位置、大體類型、組織學類型、分化程度、浸潤深度、最大直徑、淋巴結轉移、神經脈管浸潤、臨床分期等)。納入標準:(1)術后病理提示結直腸癌,且術前未接受放化療及免疫靶向治療;(2)患者知情同意參與研究;(3)臨床資料完整。排除標準:(1)有其他惡性腫瘤病史;(2)合并其他臟器的嚴重病變及功能不全。本研究使用的標本均為手術治療后采集標本,標本采集前均經患者同意(已簽署同意書)。術后隨訪主要通過電話回訪、門診復查、術后化療追蹤等形式展開,隨訪截止時間為2022 年8 月31 日,隨訪時間為60 個月。患者總生存時間為手術治療日期至末次隨訪日期或死亡日期(死亡原因均為結直腸癌及其復發或轉移)。
1.2 主要試劑及相關儀器
兔 抗 人TBX15 多 克 隆 抗 體 購 于 上 海ABMART 公 司,DAB 染 色 液、PBS 緩 沖 液 及 二 抗〔MaxVisionTMHRP(Mouse/Rabbit)IHC Kit〕購 于福州邁新生物技術開發有限公司。手動切片機購自德國Leica 公司,PT Link 抗原修復儀購于丹麥Dako 公司,光學顯微鏡購自日本OLPMPUS 公司。
1.3 實驗過程及結果判讀
所有組織均用10% 的中性甲醛固定,行石蠟包埋。由同一切片機以4 μm 厚行連續切片,65℃干烤1 h 或60℃烤箱過夜,常規脫蠟至水。以ETDA(pH 9.0)行98℃ 20 min 抗原修復,PBS 緩沖液沖洗3 min×3次,3% 雙氧水阻斷內源性過氧化物酶。PBS 緩沖液沖洗3 min×3 次,滴加一抗后置入4℃冰箱孵育過夜(一抗濃度為1:150)。PBS 緩沖液沖洗3 min×3次,滴加二抗孵育20 min。PBS 緩沖液沖洗3 min×3次,DAB 顯色10 min,流水沖洗1 min,蘇木素染液復染5 min。流水沖洗1 min,1%鹽酸水溶液分化3 s,飽和碳酸鋰返藍30 s。流水沖洗5 min,濕封片。以PBS 代替一抗作為陰性對照。結果由兩位高年資病理醫師在盲法條件下獨立評估,結果不同則重新閱片確定最終結果。采用免疫組化積分法(總得分= 陽性腫瘤細胞百分比的得分× 染色強度的得分)進行染色結果的判定。陽性細胞百分比小于25% 計為1 分,25% ~50%計為2 分, 大于50% 計為3 分;無色計為0 分, 淡黃色計為1 分, 棕黃色計為2 分, 棕褐色計為3 分。總得分小于6 分定為低表達,大于或等于6 分定為高表達。
1.4 TCGA 數據分析
從癌癥基因圖譜TCGA 數據庫(https://portal.gdc.cancer.gov) 中下載經統一標準化的TBX15 基因在結直腸癌及癌旁組織中的表達數據,導入R 軟件(Version 3.64)進行進一步數據分析。納入標準:(1)病理確診為結直腸癌。(2)研究對象接受手術治療。最后納入結直腸癌患者380 例,癌旁正常組織樣本50 例,其中包含32 對配對樣本。
1.5 統計學方法
運用SPSS 27.0 及R 軟件對數據進行統計學分析。TBX15 的表達情況與結直腸癌臨床病理的關系選用χ2 檢驗。TCGA 數據計量資料均以±s表示,非配對樣本差異性采用Wilcoxon Rank Sum Tests,配對樣本差異檢驗使用t檢驗;采用Kaplan-Meier 法繪制生存曲線,Log-ranks 法比較兩組生存曲線的差異性,檢驗水準α=0.05。
2 結果
2.1 TBX15 蛋白在結直腸癌組織和正常組織中的表達情況。
HE 染色如圖1 所示,結直腸癌組織呈篩狀并浸潤性生長,細胞有異形,核漿比高,染色質粗染,可見病理性核分裂象,而正常結腸組織呈腺管狀,排列均勻,細胞質紅染。
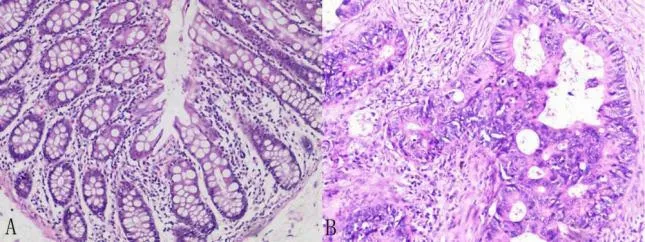
圖1 正常結腸組織和結直腸癌組織的HE 染色結果(10×10)
免疫組化結果如圖2 所示,在50 例正常結直腸組織中高表達6 例,低表達44 例。在103 例結直腸癌組織中36 例患者TBX15 蛋白高表達,67 例低表達,差異有統計學意義(χ2=8.903,P<0.05)。
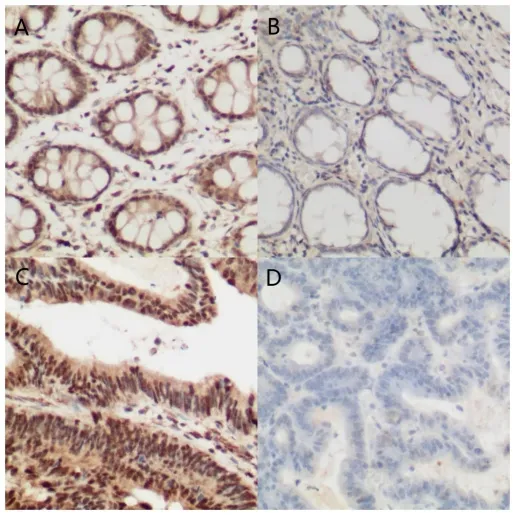
圖2 正常結直腸組織與結直腸癌組織的TBX15 免疫組化結果(10×20)
2.2 TBX15 表達與結直腸癌臨床病理的關系
進行TBX15 蛋白表達情況與103 例結直腸癌患者臨床病理特征關聯性分析的結果顯示,TBX15 蛋白的表達與神經侵犯、脈管浸潤相關,數據差異有統計學意義(χ2=9.482,P=0.002;χ2=7.690,P=0.006);與年齡、性別、腫瘤位置、大體類型、組織學類型、分化程度、浸潤深度、最大直徑、淋巴結轉移、臨床分期等臨床病理特征均無明顯的相關性。見表1。根據TBX15 蛋白表達情況繪制生存曲線,如圖3 所示。由圖3 可見,TBX15 高表達患者的生存時間短于低表達患者(χ2=8.337,P=0.004)。這表明,TBX15 蛋白低表達患者有著更好的預后。
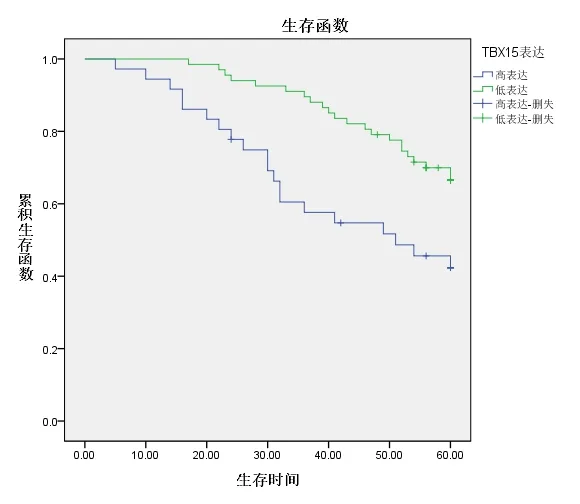
圖3 不同TBX15 表達情況結直腸癌患者的生存曲線
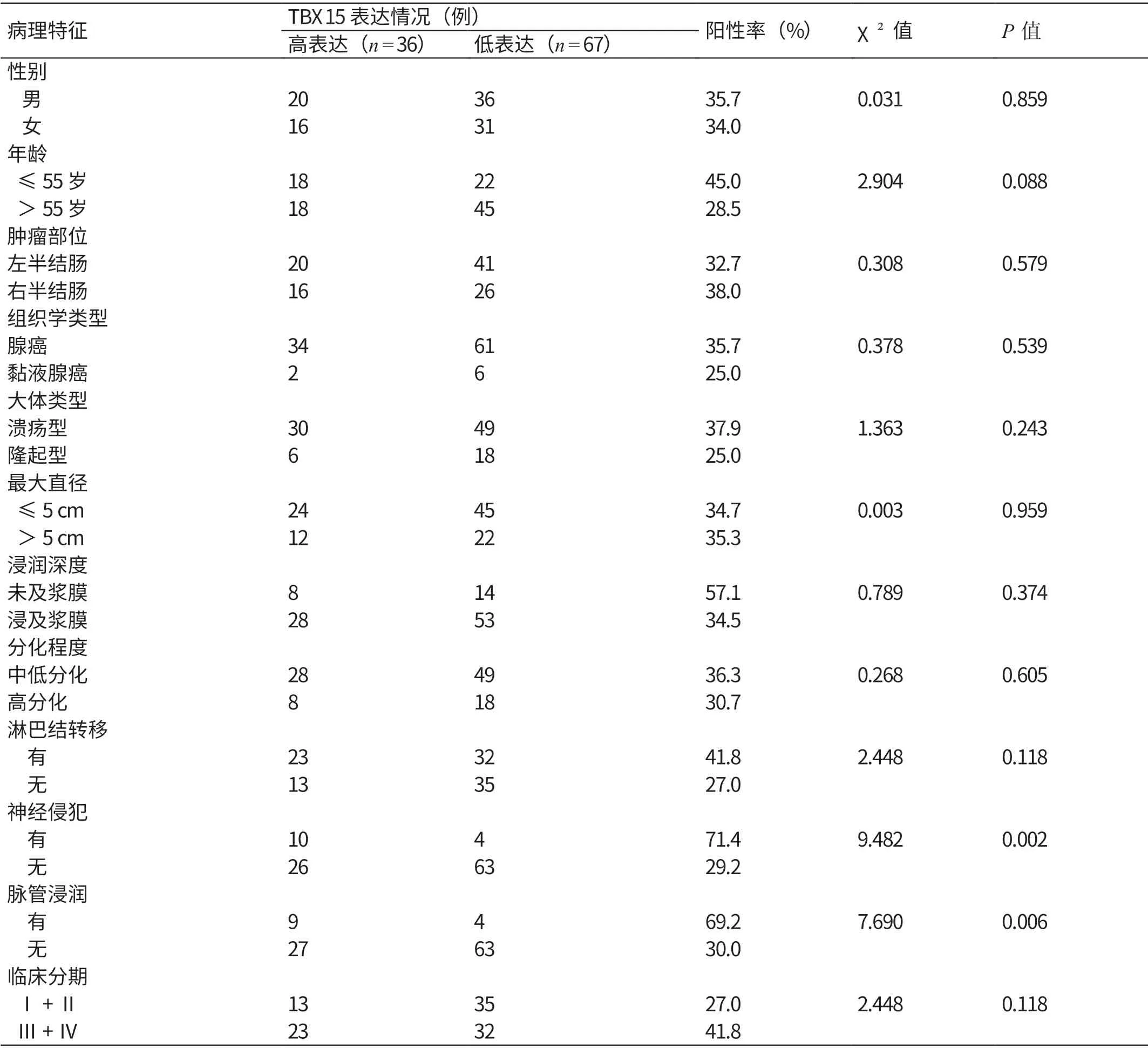
表1 TBX15 蛋白表達情況與103 例結直腸癌患者臨床病理特征的關聯性分析
2.3 TBX15mRNA 在正常結直腸組織及結直腸癌組織中表達情況的分析
2.3.1 TBX15 mRNA 在癌組織和癌旁組織中的差異表達 用R 軟件(version 3.6.4) 分析50 例結直腸正常樣本和380 例腫瘤樣本TBX15 mRNA 表達的差異性,使用非配對的Wilcoxon Rank Sum Tests 進行差異顯著性分析, 結果顯示結直腸癌組織的TBX15 mRNA 表達(-2.42±1.60)較正常結直腸組織(-5.13±1.41)顯著上調(P<0.0001)。見圖4。
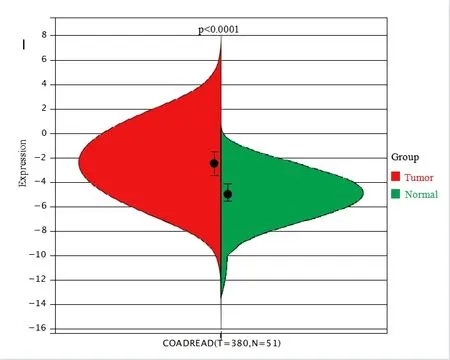
圖4 TBX15 mRNA 在結直腸組織和結直腸癌組織中的表達情況
2.3.2 TBX15 mRNA 在配對癌組織和癌旁組織中差異表達的分析 用R 軟件分析32 例配對樣本中TBX15 mRNA 的差異性表達,差異檢驗使用配對樣本的t檢驗。結果顯示,TBX15 mRNA 在配對癌組織和癌旁組織中的表達(-2.40±1.42 VS -4.92±1.44)相比,具有顯著差異(P<0.0001)。見圖5。這表明,癌組織中的TBX15 mRNA 表達較配對正常組織樣本明顯升高。
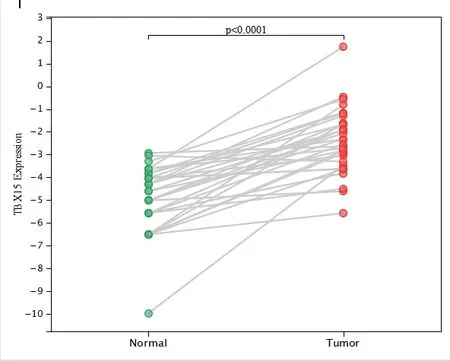
圖5 TBX15 mRNA 在結直腸組織與結直腸癌組織中表達的差異性
2.3.3 分析TBX15 mRNA 表達與總生存時間的相關性根據380 例結直腸癌患者TBX15 mRNA 的表達高低百分位數(50%)將患者分成高低兩組,進一步使用R 軟件包survival 的survfit 函數分析兩組的預后差異,并繪制K-M 曲線。利用logrank test 方法評估兩組樣本之間預后差異的顯著性。結果顯示,兩組間存在顯著的預后差異(P=0.03)。TBX15 mRNA 低表達患者的生存時間較長,TBX15 mRNA 高表達患者的預后較差。見圖6。
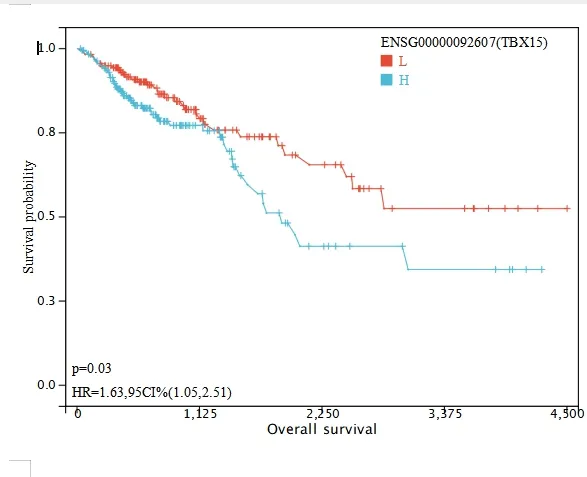
圖6 TBX15 mRNA 的表達水平與結直腸癌患者生存時間的關系
3 討論
box 基因家族是一個古老的基因家族,在所有后生動物體內均能夠檢測到(在其整個生物發育過程中具有重要意義)。在哺乳動物體內至少存在17 個T-box 基因,包括5 個亞科(T、Tbx1、Tbx2、Tbx6和Tbr1)。在人類發育過程中,T-box 基因在控制胚胎發育,參與癌癥的進展和轉移及在癌癥轉移治療的抗性中都發揮著重要的作用。T-box 基因的上調或下調與多種不同類型癌癥相關,并有可能是促進腫瘤形成的因素[12-13]。Tbx2 亞科中Tbx2、3 水平的升高與多種癌癥相關,如黑色素瘤、胰腺癌、乳腺癌等;其可通過調節細胞增殖、腫瘤形成、轉移、細胞存活和耐藥性來促進腫瘤發展[14-15]。T 亞科中Brachyury的過表達與上皮間質轉化(EMT)、腫瘤轉移、癌癥干細胞標志物的表達及對化療和放療的抵抗有關[16]。Tbr 亞科中的Tbx21 能夠間接影響腫瘤的轉移,通過影響NK 細胞的正常發育來影響機體適應性抗腫瘤免疫反應,從而使機體對轉移性癌癥的易感性大大增加[17]。TBX15 是T-box 基因家族中Tbx2 亞科中的一員。TBX15 的表達與甲狀腺癌和腎細胞癌相關。有研究指出,TBX15 在前列腺癌組織中的高表達與其不良預后顯著相關,此指標已被推薦作為前列腺癌的標志物[18]。Wu TI 等[19]在研究中指出,TBX15 作為多種表觀遺傳生物標志物之一, 可用于診斷卵巢癌,其在聯合AMPD3、NRN1 時具有較高的靈敏度,有望成為宮頸癌篩查的指標。GOZZI 等[20]在研究中發現, 有82% 的卵巢癌病例存在TBX15 基因高甲基化、TBX15 蛋白表達水平較低的情況,而在所有甲基化水平低的卵巢腫瘤樣本的幾乎所有腫瘤細胞中都可觀察到TBX15 蛋白的表達。GOZZI 認為,TBX15 可作為卵巢癌的生物標志物,用于相關早期檢測、治療及進展監測等各方面。對于TBX15 在結直腸癌組織中的表達情況及其與結直腸癌臨床病理及預后等的關系目前臨床上暫未見報道。本實驗通過免疫組織化學法檢測TBX15 蛋白在結直腸癌組織及癌旁正常組織中的表達情況,發現TBX15 蛋白在103 例結直腸癌組織標本中高表達36 例,低表達67 例;在50 例癌旁正常結腸組織中高表達6 例,低表達44 例;組間差異有統計學意義。TBX15 表達與神經侵犯和脈管浸潤有關。與其他臨床病理特征無明顯關聯。這表明,TBX15 蛋白的表達與結直腸癌的發生與發展存在密切關系。結合K-M 曲線可知,TBX15 高表達患者的生存率更低,生存時間更短。這些結果表明,TBX15 可作為判斷結直腸癌患者預后的分子標志物。TCGA 數據庫為臨床基礎研究特別是腫瘤的研究提供了大量、充足的基因組及臨床數據,為研究腫瘤的臨床病理特征及腫瘤發生發展與相關基因的關系提供了大量的數據基礎。在本研究中,我們通過對TCGA 數據進行分析發現,TBX15 mRNA 在同一個體結直腸癌組織中表達較正常組織高,TBX15 低表達患者的總生存期更長。
綜上所述,TBX15 與多種癌癥的發展和轉移相關,其可成為判斷結直腸癌患者預后的分子標志物,未來更可能成為治療結直腸癌的新靶點。在此之前,我們需要更多的臨床及病理數據支持,需要進行更多的臨床前實驗去驗證。而TBX15 影響結直腸癌發生發展及預后的作用機制仍有待進一步的研究探討。

