轉錄因子TaMADS2在小麥-葉銹菌互作中的功能研究
王率伍 秦 昭 趙世佳 劉子豪 路亞南 馬保站 肖繼斌 程 琨 鄭文明 劉 娜
(河南農業大學 生命科學學院/小麥玉米作物學國家重點實驗室,鄭州 450002)
小麥葉銹病是由葉銹菌(Pucciniatriticina)侵染引起的在世界范圍內廣泛分布的真菌病害,發生嚴重時可造成小麥5%~45%的減產[1]。小麥葉銹菌是專性寄生的活體營養型真菌,該菌分布范圍廣,發生頻繁,在世界范圍內造成小麥產量的嚴重損失,包括亞洲、北美洲、歐洲、澳洲以及非洲等地區[2]。銹病防治最經濟有效的方法是抗病品種的培育[3],因此新型葉銹病抗性基因的挖掘對減輕葉銹病的危害以及實現葉銹病的持久防治具有重要意義。
在長期進化過程中,植物形成了一套多層次的識別防御系統,從而抵御病原菌的侵染。植物可以在病原菌的侵染部位啟動超敏反應(Hypersensitive response,HR)和局部程序性細胞死亡[4],從而阻止病原菌的進一步繁殖與擴散。超敏反應通常包括病程相關基因(Pathogenesis-related,PR)表達、活性氧(Reactive oxygen species,ROS)爆發以及信號分子的傳遞等[5]。病程相關蛋白(Pathogenesis-related proteins,PRs)是一類水溶性蛋白,主要功能包括攻擊病原物、降解病原物毒素以及抑制病毒外殼蛋白同植物受體結合等[6]。PR1被證實具有抑制病毒擴展、抵抗真菌入侵以及保護植物抵御逆境脅迫等功能[7-8]。PR2基因編碼β-1,3-葡聚糖酶,可以與幾丁質酶一起降解真菌細胞壁,從而造成菌絲體頂端膨脹、破碎,最終死亡[9-10]。病程相關基因PR1和PR2是植物抗病反應的標志基因,檢測這些基因的表達可側面反應植物抗病反應的強弱。病原菌侵染引起的HR反應會促進活性氧(O2-和H2O2)的產生,不斷積累的活性氧可以進一步刺激產生效應子觸發的免疫反應(Effectors-triggered immunity,ETI)。ROS在細胞中積累能夠控制和抑制病原菌的生長,同時可作為細胞壁內的抗菌小分子抑制病原菌的侵入,并作為次級信使觸發額外的免疫反應,如基因表達或者氣孔關閉[11-12]。
病毒誘導的基因沉默(Virus-induced gene silencing,VIGS)是一種利用反向遺傳學的原理研究基因功能的方法,將目的基因特異性片段插入病毒載體后侵染宿主植物,導致目的基因局部雙鏈RNA形成,從而引起目的基因的沉默[13]。VIGS技術避免了對寄主植物進行遺傳轉化,研究周期短,是一種簡單有效的基因功能研究方法,從而極大的推動了植物基因組功能研究的發展。最早追溯到1995年,Kumagai等[14]首次將插有一段八氫番茄紅素脫氫酶(Phytoene desaturase,PDS)的重組煙草花葉病毒(Tobacco mosaic virus,TMV)導入本氏煙中,成功的沉默了煙草的PDS基因。由于PDS是類胡蘿卜素合成所必需的酶,其基因沉默會引起所感染植物的葉片產生光漂白表型[15],因此常被用來作為VIGS體系的指示基因。張蕊等[16]利用VIGS技術沉默TaSPX3基因的表達,發現TaSPX3基因正向調控小麥對葉銹菌的抗性;宋姍姍等[17]通過BSMV-VIGS技術證明TaRanGAP2基因在小麥抵抗葉銹菌侵染的HR反應中發揮重要的作用;蔣軍等[18]利用VIGS技術沉默TaCTSB基因的表達,減弱了小麥對條銹菌的抗性。Guo等[19]通過VIGS技術沉默TaBln1的表達增強了小麥對條銹菌的防御反應;而Wan等[20]發現瞬時沉默TaRaf46可以抑制小麥葉片中條銹菌的侵染。另外有報道稱,在寄主小麥中通過VIGS能夠沉默小麥條銹菌致病基因的表達,從而顯著降低條銹菌的危害[21]。
轉錄因子在生物脅迫與非生物脅迫的信號通路中發揮關鍵作用。MADS-box轉錄因子是一類廣泛存在于真核生物中的古老轉錄因子家族,參與植物生長的各個環節,在植物的生長發育、信號轉導以及脅迫響應中發揮不可替代的作用[22]。普通六倍體小麥的全基因組表達譜分析發現,MADS-box家族多種轉錄因子在病原菌(赤霉菌、葉枯菌、條銹菌以及白粉菌)誘導下呈差異表達,因此MADS-box轉錄因子可能在小麥抵抗病原菌的侵染過程中發揮作用[23]。Guo等[24]研究發現I型MADS-box基因TaMADS2受條銹菌侵染后,在小麥與條銹菌親和/非親和互作早期上調表達,36和48 h之后出現下調表達,推測該基因可參與調控小麥對條銹菌的抗性。
本試驗前期發現葉銹菌與小麥的親和/非親和互作早期TaMADS2基因的表達量均受到葉銹菌的誘導呈上調表達,且在非親和互作中TaMADS2的上調表達時期較親和互作更早。目前,關于TaMADS2參與小麥抗葉銹病過程的作用機制研究尚未見報道。因此,本研究擬利用BSMV-VIGS技術沉默小麥中TaMADS2基因的表達,對沉默植株接種葉銹菌后進行研究,旨在明確TaMADS2在小麥受葉銹菌侵染過程中的功能,為進一步闡明TaMADS2基因的功能機制奠定基礎。
1 材料與方法
1.1 試驗材料
供試小麥葉銹菌生理小種為Pt15,單孢菌系,該菌系為實驗室前期鑒定并保存;供試小麥品種為‘鄭麥9023’(ZM9023,Pt15非親和互作)和‘中國春’(CS,Pt15親和互作)。
1.2 大麥條紋花葉病毒(Barley stripe mosaic virus, BSMV)介導的TaMADS2基因沉默
本試驗中所用BSMV的α、β和γ載體由河南農業大學農學院王道文教授課題組惠贈。TaMADS2基因cDNA全長822 bp,由試驗前期從‘鄭麥9023’中克隆得到。利用帶有NheⅠ酶切位點的引物TaMADS2-VIGS-F/R從本研究已有的TaMADS2-T重組質粒上擴增一段204 bp的特異性片段作為VIGS的靶標序列,使用NheⅠ將γ載體酶切線性化,使用一步克隆法構建TaMADS2的VIGS重組載體γ-TaMADS2。
將病毒載體α、γ(Empty vector)、γ-PDS以及重組載體γ-TaMADS2使用Mlu Ⅰ進行線性化,β使用Spe Ⅰ進行線性化,使用RiboMAXTM-T7試劑盒進行體外轉錄。轉錄產物定量后分別將γ、γ-PDS、γ-TaMADS2與α、β等體積混合,組裝為BSMV:EV、BSMV:PDS和BSMV:TaMADS2這3種病毒,采用摩擦接種的方法接種于二葉一心期小麥的第二片葉。接種BSMV:PDS的小麥作為陽性對照來觀察沉默效果,PDS為八氫番茄紅素脫氫酶基因,若PDS被沉默則小麥葉片會出現白化表型;接種BSMV:TaMADS2的小麥作為試驗組,檢測TaMADS2基因沉默小麥對葉銹菌的抗性變化;空質粒BSMV:EV為陰性對照。病毒接種后第14天觀察接種BSMV:PDS小麥葉片的白化現象。將葉銹菌夏孢子Pt15均勻接種于BSMV:TaMADS2和BSMV:EV小麥葉片上。在接種葉銹菌后分別取樣進行后續試驗,并在接種葉銹菌后的第10天觀察小麥葉片感病表型,分析TaMADS2基因沉默對于小麥抗病性的影響。
1.3 qRT-PCR檢測
接種葉銹菌后第12天分別對沉默組和對照組取樣,使用Trizol Reagent(CW0580S)和HiScript Ⅱ QRT SuperMix for qPCR(Vazyme,R223-01)分別提取樣品RNA并反轉為cDNA。使用qRT-PCR檢測TaMADS2、PR1和PR2的相對表達量,分析TaMADS2的沉默效率以及葉銹菌侵染早期TaMADS2基因沉默對病程相關基因的轉錄水平影響。
接種葉銹菌10 d后分別對試驗組和陰性對照組取樣。提取樣品DNA后通過絕對定量測定各樣品中葉銹菌單拷貝基因PtRTP1和小麥單拷貝基因TaEF1的CT值,代入前期測定的特異性標準曲線[25]得到2個基因的拷貝數,計算PtRTP1和TaEF1基因的比例,獲得樣品的真菌生物量[26]。
1.4 組織學與活性氧染色觀察
接種葉銹菌后的24和48 h分別對沉默組和對照組小麥葉片進行隨機取樣,參考肖繼斌[27]所列方法使用WGA-Alexa-488熒光染料對沉默組和對照組24及48 h樣品進行處理,用二氨基聯苯胺(DAB)活性氧染料對沉默組和對照組的48 h樣品進行處理,在熒光顯微鏡下觀察菌絲生長與活性氧的積累情況。
2 結果與分析
2.1 VIGS重組質粒的構建
以TaMADS2-T載體為模板,使用引物TaMADS2-VIGS-F/R進行目的片段的擴增,克隆得到204 bp的特異靶標序列。對擴增產物進行回收,將回收產物與線性化γ載體連接并轉化大腸桿菌,挑取單克隆菌落,使用VIGS-text-F/R進行單克隆測序,與靶標序列一致即重組質粒構建完成可進行下一步操作。將驗證成功的菌落的質粒進行酶切線性化,重組質粒片段小于線性化質粒,說明重組質粒成功線性化。將線性化的質粒進行體外轉錄,獲得病毒α、β、γ、γ-PDS以及γ-TaMADS2的RNA,用于后續試驗。
2.2 BSMV-VIGS沉默體系效果檢測
為驗證本試驗BSMV-VIGS沉默體系是否有效,在感染病毒14 d后觀察BSMV:PDS沉默表型。如圖1(a)所示,‘中國春’和‘鄭麥9023’小麥葉片在接種BSMV:PDS病毒后出現白化,而作為陰性對照的BSMV:EV未出現變化,證明本研究所用沉默體系能夠有效沉默小麥基因。利用qRT-PCR檢測感染BSMV病毒的小麥在接種葉銹菌后12 h葉片中TaMADS2基因的表達水平,進一步證實TaMADS2基因是否被成功沉默。如圖1(b)和(c)所示,與感染BSMV:EV的小麥相比,感染BSMV:TaMADS2病毒的小麥的TaMADS2基因表達量顯著降低,結果表明感染BSMV:TaMADS2病毒有效的沉默了‘鄭麥9023’和‘中國春’中的TaMADS2基因表達。
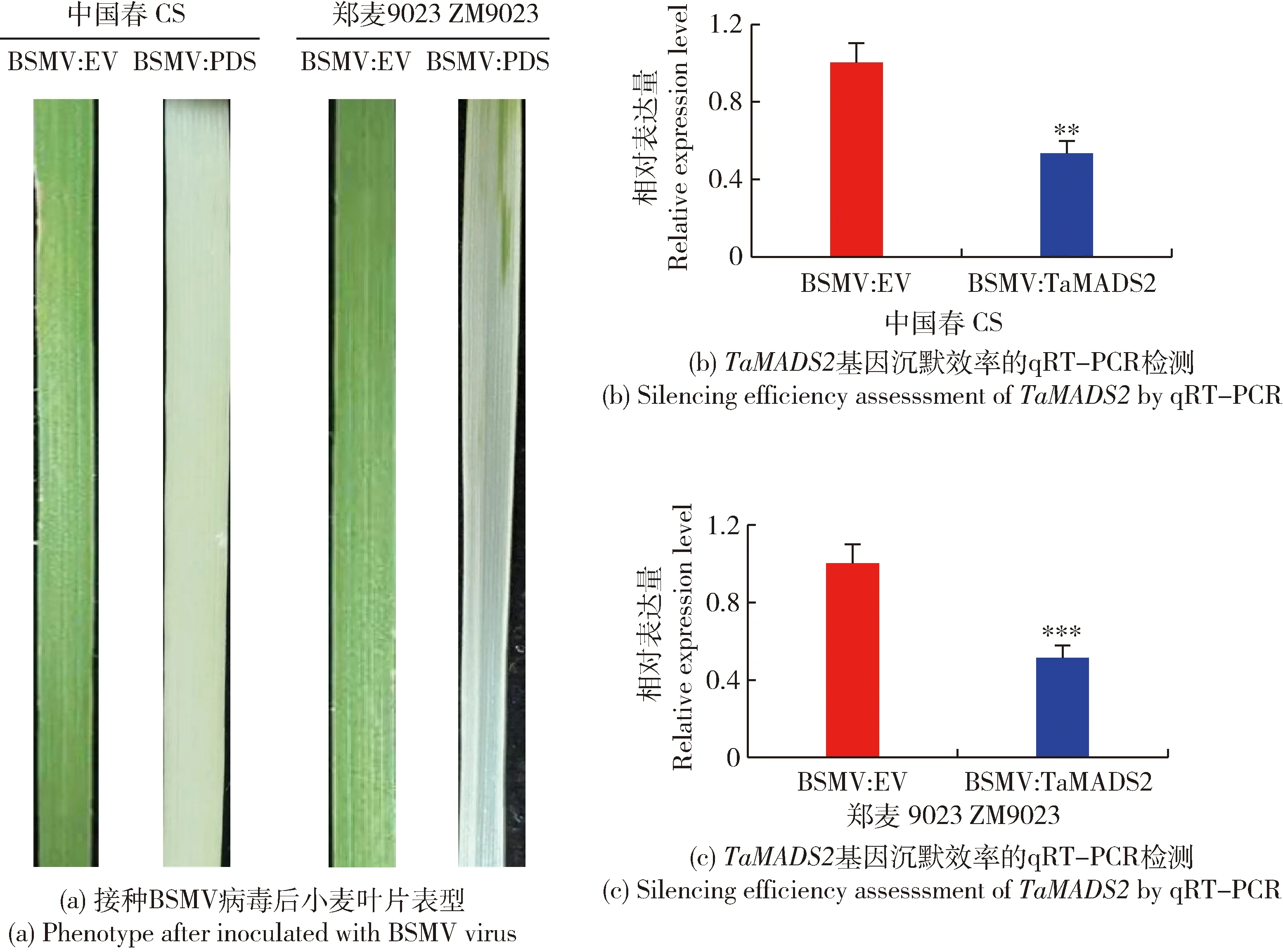
BSMV:EV為陰性對照,BSMV:PDS為PDS基因沉默的小麥植株,BSMV:TaMADS2為TaMADS2基因沉默的植株。顯著性分析(*P<0.05,**P<0.01,***P<0.001)。下同。BSMV: EV is the negative control, BSMV: PDS is the PDS-silenced wheat plants, BSMV: TaMADS2 is the TaMADS2-slienced wheat plants. Significance analysis (*P<0.05, **P<0.01, ***P<0.001). The same below.圖1 接種BSMV病毒的小麥葉片表型及沉默效率檢測Fig.1 Phenotype and silencing efficiency of wheat leaves inoculated with BSMV virus
2.3 TaMADS2基因沉默后小麥抗病性分析
為解析TaMADS2基因在小麥抗葉銹病中的功能,分別對感染BSMV:EV和BSMV:TaMADS2病毒的小麥葉片接種葉銹菌,在第10天,觀察葉片感病表型。如圖2(a)所示,2個不同品種小麥感染病毒后,BSMV:TaMADS2的小麥葉片明顯比BSMV:EV的小麥葉片產生更多的葉銹菌孢子堆。對2種不同小麥葉片進行分子病情指數檢測,與表型觀察結果相同,BSMV:TaMADS2小麥葉片的真菌生物量高于BSMV:EV的小麥葉片(圖2(b)和(c)),表明TaMADS2基因的沉默降低小麥對葉銹病的抗病性。
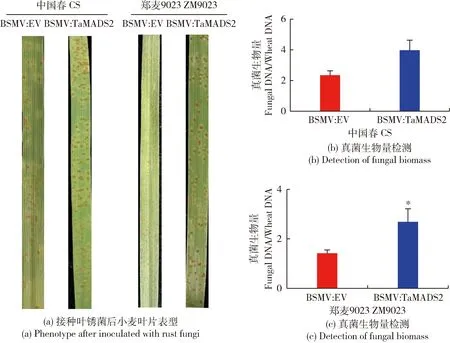
圖2 TaMADS2沉默植株及對照植株接種葉銹菌后的葉片表型及真菌生物量檢測Fig.2 Leaf phenotype and detection of fungal biomass of TaMADS2-slienced plants and control plants
對葉銹菌侵染的小麥葉片經DAB染色后在組織學水平觀察活性氧積累上的變化,經WGA染色,在組織學水平觀察葉銹菌在TaMADS2沉默植株中的生長情況。DAB染色后的活性氧觀察結果如圖3所示,在48 h時BSMV:EV樣品內活性氧積累量顯著大于BSMV:TaMADS2樣品。WGA染色后的組織學觀察結果如圖4所示,在24和48 h,處理組BSMV:TaMADS2和對照BSMV:EV均可觀察到氣孔下囊和入侵菌絲,但處理組BSMV:TaMADS2中的氣孔下囊較對照BSMV:EV相比更大且入侵菌絲更長,表明TaMADS2基因的沉默可能促進葉銹菌侵染初期入侵菌絲的擴展。以上結果表明沉默TaMADS2基因可降低小麥對葉銹病的抗性。
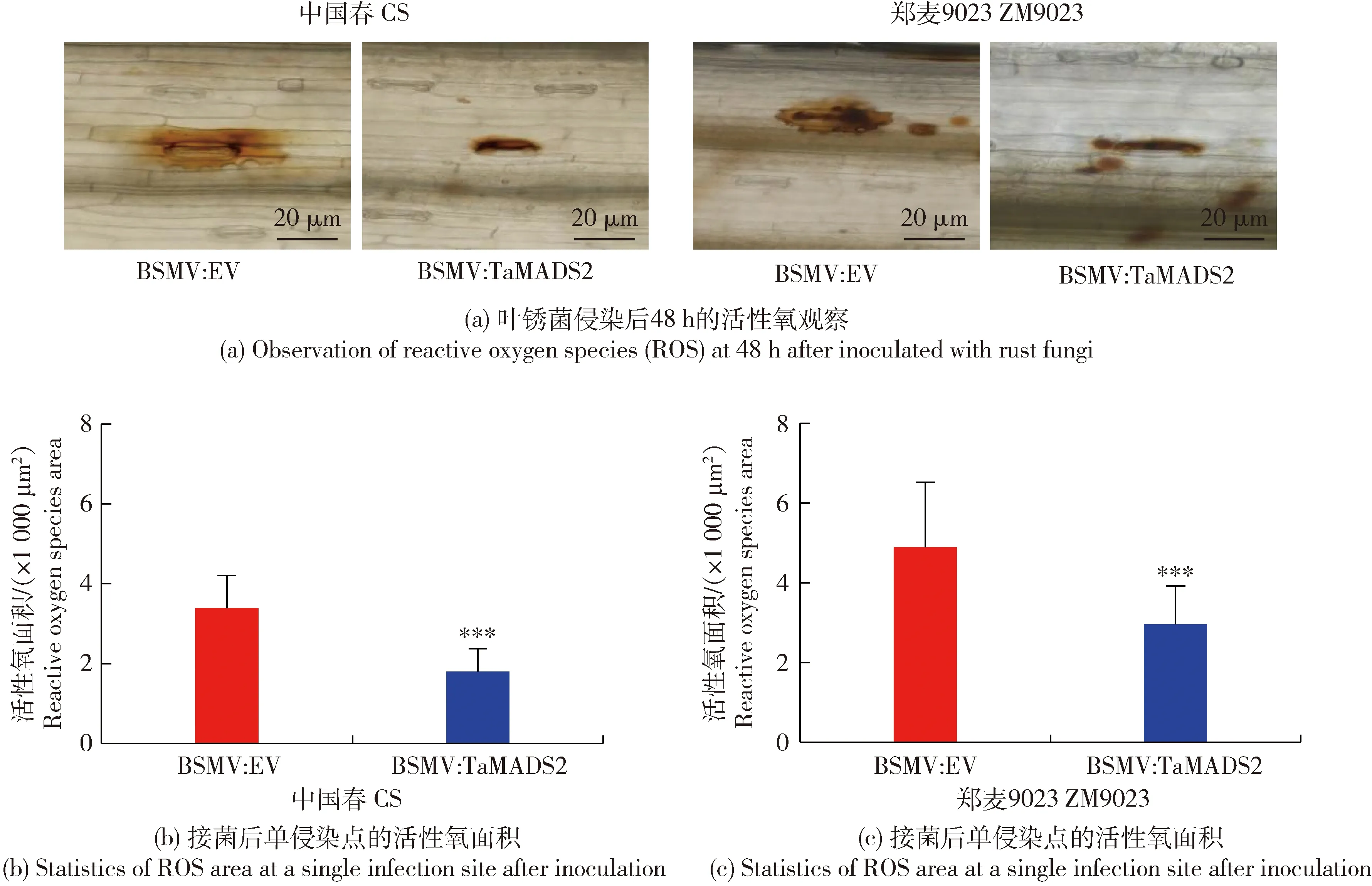
圖3 葉銹菌侵染后的活性氧觀察及數據統計Fig.3 Observation of reactive oxygen species (ROS) and data statistics after inoculated with rust fungi
在接種葉銹菌后的12 h取樣檢測病程相關基因以及活性氧清除相關基因的轉錄水平變化,其中PR1、PR2和CAT基因的表達量變化顯著。如圖5所示,同對照組BSMV:EV相比,感染BSMV:TaMADS2的2種小麥的PR1基因的表達量均降低,其中親和小麥品種‘中國春’中PR1表達量顯著降低90.22%,非親和小麥‘鄭麥9023’降低14.73%;感染BSMV:TaMADS2的2種小麥中PR2基因的表達量顯著低于感染BSMV:EV的小麥,分別下降46.67%和36.38%,表明TaMADS2的沉默顯著抑制了2個品種小麥中PR2的表達。CAT基因的表達量在感染BSMV:TaMADS2的小麥中相對于感染BSMV:EV的小麥分別降低17.80% 和24.15%,表明在葉銹菌侵染早期,TaMADS2基因可能通過活性氧清除酶(TaCAT)維持植株體內活性氧的動態平衡。對這2種小麥表達分析發現,TaMADS2基因沉默后在親和/非親和小麥中PR1、PR2和CAT的表達量均呈下調,表明TaMADS2基因可能通過PR1、PR2和CAT調控小麥葉銹菌抗性。
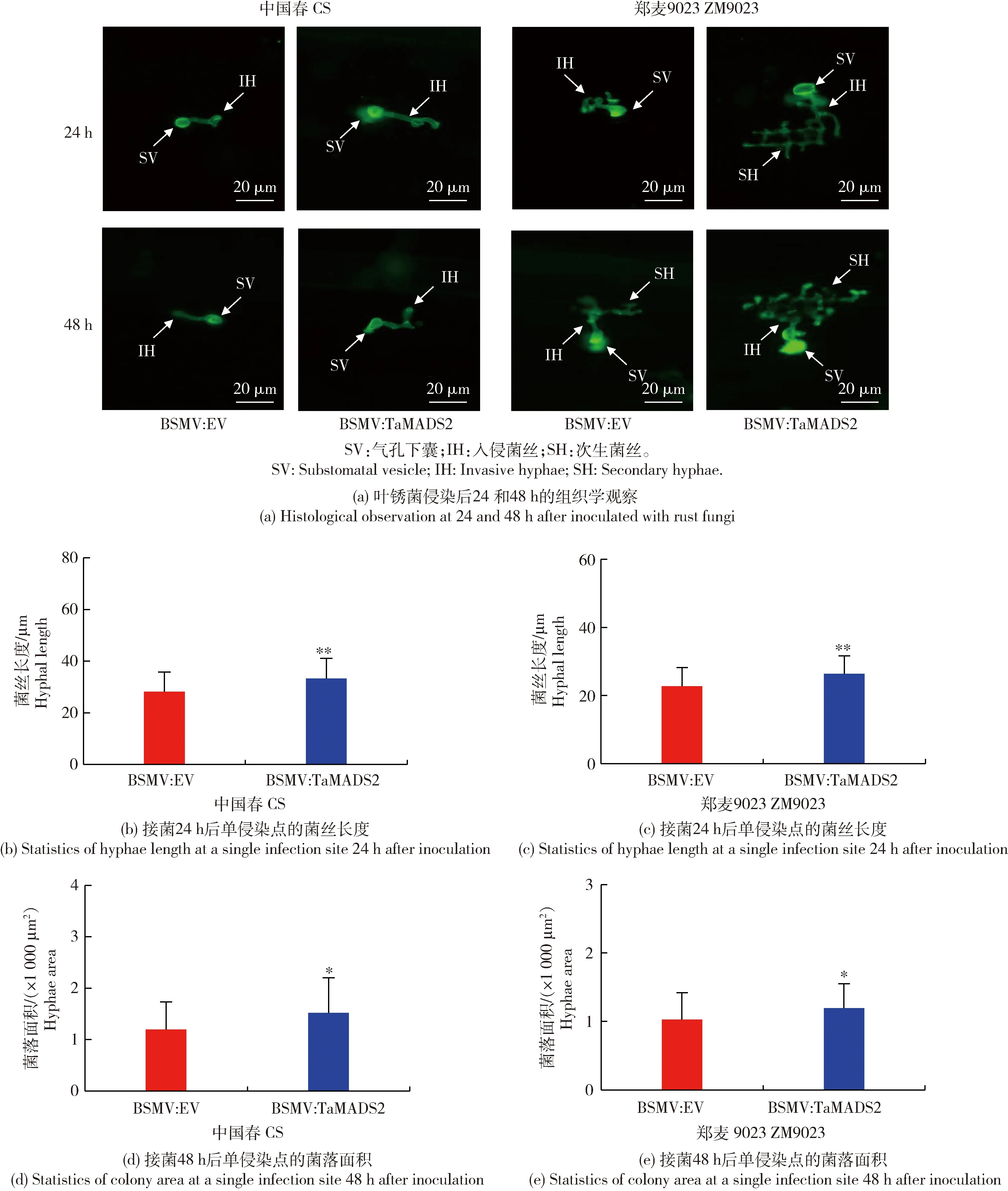
數據為40個數據的平均值。Values are the average of 40 data.圖4 沉默TaMADS2后葉銹菌的組織細胞學分析Fig.4 Histocytology analysis of rust fungi growth in TaMADS2-silenced plants
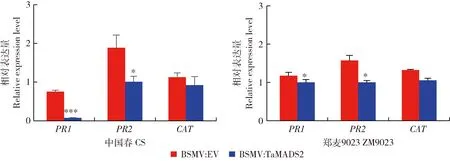
圖5 TaMADS2沉默植株和對照植株接種葉銹菌后PR1、PR2和CAT基因的相對表達量Fig.5 The relative expression levels of PR1、PR2 and CAT genes in TaMADS2-silenced plants compared to control plants after inoculated with rust fungi
3 結論與討論
植物在生長發育的過程中為應對多變的環境進化出了復雜的調控網絡,各種轉錄因子在調控網絡中發揮著至關重要的作用。MADS-box轉錄因子不僅是植物生長發育各個環節的關鍵調控因子,同時也在植物響應逆境脅迫中發揮重要作用[28]。MADS-box轉錄因子在植物抗病過程中的作用越來越受到廣大研究者的關注,Khong等[29]發現水稻OsMADS26基因負調控水稻抗寒性以及對稻瘟病、白葉枯病的抗性。Guo等[24]發現小麥與條銹菌親和/非親和互作過程中,I型MADS-box基因TaMADS2在受到條銹菌的侵染早期上調表達,在36和48 h分別出現下調表達,推測該基因可能參與調控小麥的條銹菌抗性。Ma等[23]通過六倍體小麥的全基因組表達譜分析發現MADS-box家族多種轉錄因子在赤霉菌、條銹菌和白粉菌等病原菌誘導下差異表達。本研究前期發現葉銹菌與親和/非親和小麥早期互作過程中,TaMADS2的表達量均受到葉銹菌誘導上調表達,且在非親和小麥中TaMADS2的響應時期較親和小麥更早。本研究選取葉銹菌小種Pt15的非親和品系‘鄭麥9023’以及親和品系‘中國春’,利用BSMV-VIGS技術分別沉默TaMADS2基因表達,解析TaMADS2基因在小麥抗葉銹病中的功能。在接種病毒14 d后檢測TaMADS2基因的表達量,感染BSMV:TaMADS2的小麥中TaMADS2基因的表達水平顯著降低,TaMADS2基因沉默株系葉片上的葉銹菌孢子堆數量增多,分子病情指數增加。組織學觀察和活性氧觀察結果發現感染BSMV:TaMADS2的小麥葉片中病原菌生長速度更快,菌絲分枝數增多,活性氧積累量減少,說明沉默TaMADS2基因的表達降低了小麥對葉銹菌的抗性。
目前,病程相關蛋白(PRs)在植物抗病性以及系統獲得抗性中的作用已有廣泛報道,已經發現的PRs中PR1、PR2和PR5是植物抗病反應和SAR(Systemic acquired resistance)的標記基因[30]。PR1是在受到病原菌和SA大量誘導表達的PR蛋白[31],受侵染的組織中PR1的表達水平可以提高10 000倍,占整個葉片蛋白含量的1%~2%[32],因此被廣泛認為是植物防御反應的標記基因。β-1,3-葡聚糖酶屬于PR2家族成員,而β-1,3-葡聚糖是很多植物病原菌細胞壁的重要組成成分,β-1,3-葡聚糖酶能夠催化β-1,3-葡聚糖多聚體的水解,從而抑制真菌的生長與增殖[33]。本研究中TaMADS2的沉默抑制了PR1和PR2基因的表達,表明TaMADS2可能通過病程相關蛋白途徑抑制病原菌的生長,提高小麥對葉銹菌的抗性。
在早期的HR反應中病原菌的侵染會引起活性氧的爆發,活性氧可以直接作為抗菌物質發揮作用[34]。過氧化氫酶(CAT)是生物防御系統中的關鍵的活性氧清除酶類,能夠清除超氧化物陰離子自由基,將H2O2降解為無毒的H2O和O2-,保護植物免受活性氧毒害,在植物防御、脅迫應答及控制細胞的氧化平衡中發揮重要的作用[35-36]。病程的發展伴隨著ROS的大量產生,而活性氧清除酶基因CAT的表達量也會隨之變化,常做為調控植物抵御病原菌的抗性參照指標[37]。本研究在葉銹菌侵染早期,TaMADS2沉默植株中活性氧積累量減少,CAT的表達量亦下降,表明TaMADS2基因可能通過調控侵染點活性氧的積累影響葉銹菌的侵染過程。本試驗測定了侵染早期(12 h)TaCAT轉錄水平的相對變化,呈現下調趨勢但未達顯著差異水平,表明其受到了TaMADS2表達變化的影響,可能參與了這一抗性調控。但更準確描述CAT在TaMADS2調控小麥對葉銹菌抗性中作用,尚有待進一步的研究。
本研究利用BSMV-VIGS技術初步驗證了TaMADS2基因在小麥抗葉銹病中的功能,葉銹菌侵染下TaMADS2基因抑制表達植株的葉銹菌孢子堆增多,病菌生物量增加,菌絲生長速度顯著加快,活性氧積累量顯著減少,病程相關基因PR1和PR2表達量顯著減少,表明TaMADS2基因的沉默表達降低了小麥對葉銹菌的抗性。研究結果為進一步解析TaMADS2基因在小麥抗葉銹病中的作用機理奠定基礎,也為抗病性小麥品種的遺傳改良和利用提供了基因資源。

