低溫產甲烷菌群對玉米秸稈低溫厭氧消化的生物強化作用
張新杰,孫永明,閆 淼,李金平,李 穎
·農業生物環境與能源工程·
低溫產甲烷菌群對玉米秸稈低溫厭氧消化的生物強化作用
張新杰1,2,3,4,孫永明1,2,3,閆 淼2,3,李金平1,4,李 穎2,3※
(1. 蘭州理工大學能源與動力工程學院,蘭州 730050;2. 中國科學院廣州能源研究所,廣州 510640;3. 中國科學院可再生能源重點實驗室,廣州 510640;4. 甘肅省生物質能與太陽能互補供能系統重點實驗室,蘭州 730050)
為研究產甲烷菌群對秸稈低溫厭氧消化的生物強化作用,試研究將長期馴化的低溫產甲烷菌群投加至秸稈厭氧消化體系中,對比不同添加劑量(3%、6%、9%、12%、15%和18%)對低溫(20 ℃)批式厭氧消化性能的影響。對產甲烷性能、中間代謝產物進行統計學和動力學分析,評價生物強化效果,確定最佳劑量,結合微生物群落分析揭示生物強化作用機制,結果表明:生物強化可促進秸稈低溫厭氧消化,提高甲烷率1.27~2.24倍,促進乙酸和丙酸的降解,避免酸抑制,相比對照組縮短厭氧消化時間(80)12~19 d;動力學分析表明:生物強化可縮短厭氧消化的延滯期;統計學分析表明:強化甲烷產量的最佳劑量為12%,單位質量菌群強化甲烷產量的最佳劑量為6%;微生物群落分析顯示生物強化促進低溫厭氧消化的主要原因是提高了產甲烷菌和相對豐度。
甲烷;玉米秸稈;低溫厭氧消化;生物強化;微生物群落
0 引 言
厭氧消化技術可減少有機廢棄物的環境污染,并實現廢棄物的資源化利用[1]。近年來,厭氧消化處理有機廢棄物的沼氣工程規模化興起,因低溫氣候條件影響,北方沼氣產業規模顯著滯后于南方[2]。低溫下運行的沼氣工程因產氣低、保溫成本高、效益差,導致部分處于閑置狀態。地下式沼氣工程無需加熱,可常年維持在20℃左右,但產氣較少,約(0.2~0.5) m3/(m3·d)。地上沼氣工程通過鍋爐、發電余熱或太陽能[3]等加熱方式,雖能維持中溫(約35 ℃)發酵溫度,但保溫成本高。北方冬季平均氣溫-20 ℃,若在35 ℃下運行一個3 000 m3的發酵罐,其保溫耗能約3 025 kW·h/d(根據熱損方程計算),相當于消耗每天產氣量(以產氣率0.8 m3/(m3·d)計)的59%用于保溫,低溫運行不具經濟性。秸稈是重要的生物質資源,在中國北方資源量豐富[4],研究提高秸稈低溫消化產甲烷性能的方法,對推進中國乃至世界寒區秸稈沼氣工程應用具有重要的科學意義[5]。
與中溫(35 ℃)和高溫(55 ℃)厭氧消化相比,低溫(≤20 ℃)厭氧消化性能不佳,主要因為溫度影響微生物的活性,溫度降低使細胞膜上運輸蛋白通道變窄,細胞攝入物質能力下降,導致細胞生長緩慢,數量變少。古菌比細菌對低溫更敏感,導致反應器內揮發性脂肪酸(volatile fatty acids,VFA)積累和pH值下降,啟動及運行困難,甲烷產量低[6]。
目前,提高低溫厭氧消化產甲烷的方法主要有:馴化低溫接種物提高微生物耐受性[7-8];降低有機負荷(organic loading rate,OLR)避免酸抑制[9];加入顆粒活性炭[10]、磁鐵礦、石墨烯[11]等導電材料促進直接電子轉移;共發酵優化C/N[12]、反應器優化改造[13]和生物強化技術[14]等。其中,生物強化是通過添加具有特定功能微生物來提高消化性能的一種直接的方法[15-16]。
此前,利用本實驗室已馴化的丙酸產甲烷菌群對能源草[17]、雞糞[18-19]和餐廚垃圾[20]的中溫厭氧消化進行生物強化,證實產甲烷菌群可恢復酸敗、緩解氨抑制并提高產甲烷率。此外,嘗試了利用中溫丙酸產甲烷菌群強化低溫連續厭氧發酵[21]和低溫批式牛糞-秸稈共發酵[22],雖然產甲烷性能比未強化的低溫發酵有所提升,但與中溫產甲烷水平還具有一定差距。因此,為進一步提高低溫厭氧發酵的生物強化性能,本實驗室又馴化出了低溫丙酸產甲烷菌群,目前,利用低溫產甲烷菌群強化低溫厭氧消化的研究鮮有報道,因此有必要探究低溫產甲烷菌群對秸稈低溫厭氧消化的生物強化作用。
生物強化菌群添加量是影響強化效果及成本的重要因素,因此,本研究探究菌群劑量對秸稈低溫厭氧消化生物強化效果的影響,確定最佳劑量,并揭示生物強化的微生物機理,為提高低溫厭氧消化性能提供理論基礎和指導。
1 材料與方法
1.1 原料、接種物及生物強化菌系
原料為玉米秸稈(maize stover,MS),粉碎至粒徑為1 mm備用。接種物為牛糞沼液,接種前分別進行一周的低溫(20 ℃)或中溫(37 ℃)馴化(纖維素為碳源,OLR為0.5g/(L·d)。低溫和中溫接種物微生物群落組成詳見2.5.1和2.5.2節,接種前進行一周的脫氣處理,0.4 mm網孔紗布過濾。生物強化菌系(bioaugmentation seeds,BS)為丙酸產甲烷菌群,取自中國科學院廣州能源研究所長期穩定運行的70 L低溫(20±1)℃厭氧消化罐,其產甲烷水平與中溫(35 ℃)條件下相當,利用丙酸的VS產甲烷率為390 mL/g,是理論產甲烷率的74%。菌系添加形式為菌泥,將菌液離心(4 000 r/min,5 min)后獲得。表1為各試驗原料的基本參數。

表1 原料、接種物、生物強化菌系基本特性
1.2 試驗設計
試驗設置發酵TS濃度為8%,反應器為1 000 mL,工作體積為800 mL,設置9個試驗組,6個生物強化組,為R1~R6,生物強化劑量(g/g,以VS計)分別為3%、6%、9%、12%、15%、18%;另設置3組對照組,分別為RM:中溫不加菌系對照組;R0:低溫不加菌系對照組,RIn:生物強化對照組,添加18%的秸稈發酵液菌泥(發酵液離心)。各反應器分別在低溫(20±1)℃培養箱和中溫(37±1)℃水浴鍋中運行。定期測定產氣量、甲烷含量、pH值、VFAs,定期取樣置于-80 ℃保存,用于微生物分析。
1.3 測試及分析方法
TS和VS按照標準方法測定[23],秸稈木質纖維素成分分析按照美國可再生能源實驗室標準方法測定(LAP,NREL)[24]。C、H、N元素含量通過Vario EL(elementar analysensysteme gmbh,Hanau,Germany)元素分析儀測定,pH值通過便攜式pH計測定(梅特勒-托利多FE28),測試前用pH值為4.00、7.00、10.01的標準緩沖溶液進行校準,VFAs濃度使用高效液相色譜儀(Model e2698,Waters,US)測定。色譜儀配有 Bio-RAD 色譜柱,溫度設置為50 ℃,流動相為0.005 mM H2SO4,流速為0.5 mL/min。氣體成分采用氣相色譜(島津 GC-2014 型)測定。
1.4 動力學分析
修正的Gompertz方程已經被廣泛應用于批式厭氧消化過程的模擬分析,利用此方程對產甲烷潛力、最大產甲烷速率和延滯期進行模擬[25]。
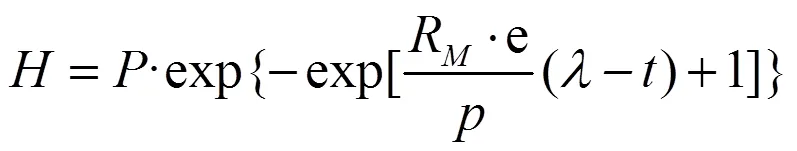
式中為時刻單位VS底物的累積甲烷產量,mL/g;為最終累積VS甲烷產率,mL/g;R為日最大VS甲烷產率,mL/(g·d);e為自然對數常數,其值為2.713;為延滯期,d;為試驗時間,d。
1.5 高通量測序分析方法
高通量測序用于分析發酵系統中微生物群落組成結構。樣品提取DNA后,利用 Qubit4.0 DNA 檢測試劑盒對基因組 DNA 精確定量,進行兩輪PCR 擴增,對 DNA 純化回收,經等量混合后進行高通量測序。測序后得到的有效序列采用RDP 分類算法進行分類學分析,通過識別古菌和細菌序列、物種豐富度,在不同生物分類水平進行群落結構的分析。
2 結果與分析
2.1 生物強化菌系劑量對低溫厭氧消化產甲烷性能的影響
不同生物強化劑量對秸稈低溫厭氧消化累積產甲烷率的影響如圖1a所示,與不加強化菌系的R0相比,所有劑量的生物強化組產氣性能均有不同程度的提升,當添加劑量不高于12%時,累積VS產甲烷率隨菌系添加量增加而升高,與之相反,劑量高于12%時,隨添加量增加而降低,這可能是由于添加的強化菌系過多,底物被菌群降解用于自身生長,消耗了部分產甲烷的底物。因此,在試驗設置的劑量范圍內,最佳劑量為12%,即R4,其累積VS產甲烷率最高,達134.1 mL/g,比R0提高2.35倍,達到中溫組RM的66%,其余劑量的生物強化組累積產甲烷率從高到低依次為15%(R5)、9%(R3)、6%(R2)、18%(R6)、3%(R1),提高產甲烷率1.3~2.4倍,此外,除最低劑量3%的R1外,其余添加丙酸產甲烷菌系的試驗組均比添加18% 的秸稈發酵液菌泥強化的RIn的產甲烷率高,提升了30%~54%,但3%(R1)在前15 d內產甲烷優于RIn,由此可見,添加丙酸產甲烷生物強化菌系進行針對性強化,可有效提升低溫厭氧消化產甲烷性能。在此前利用中溫丙酸產甲烷菌系強化牛糞與秸稈低溫共發酵研究中,投加14%的最佳劑量下,累積VS產甲烷率提升至36.0 mL/g[22],不到中溫產甲烷的40%,與之相比,本研究利用低溫丙酸產甲烷菌系強化,可達到中溫條件下產甲烷率的66%,效果更優。
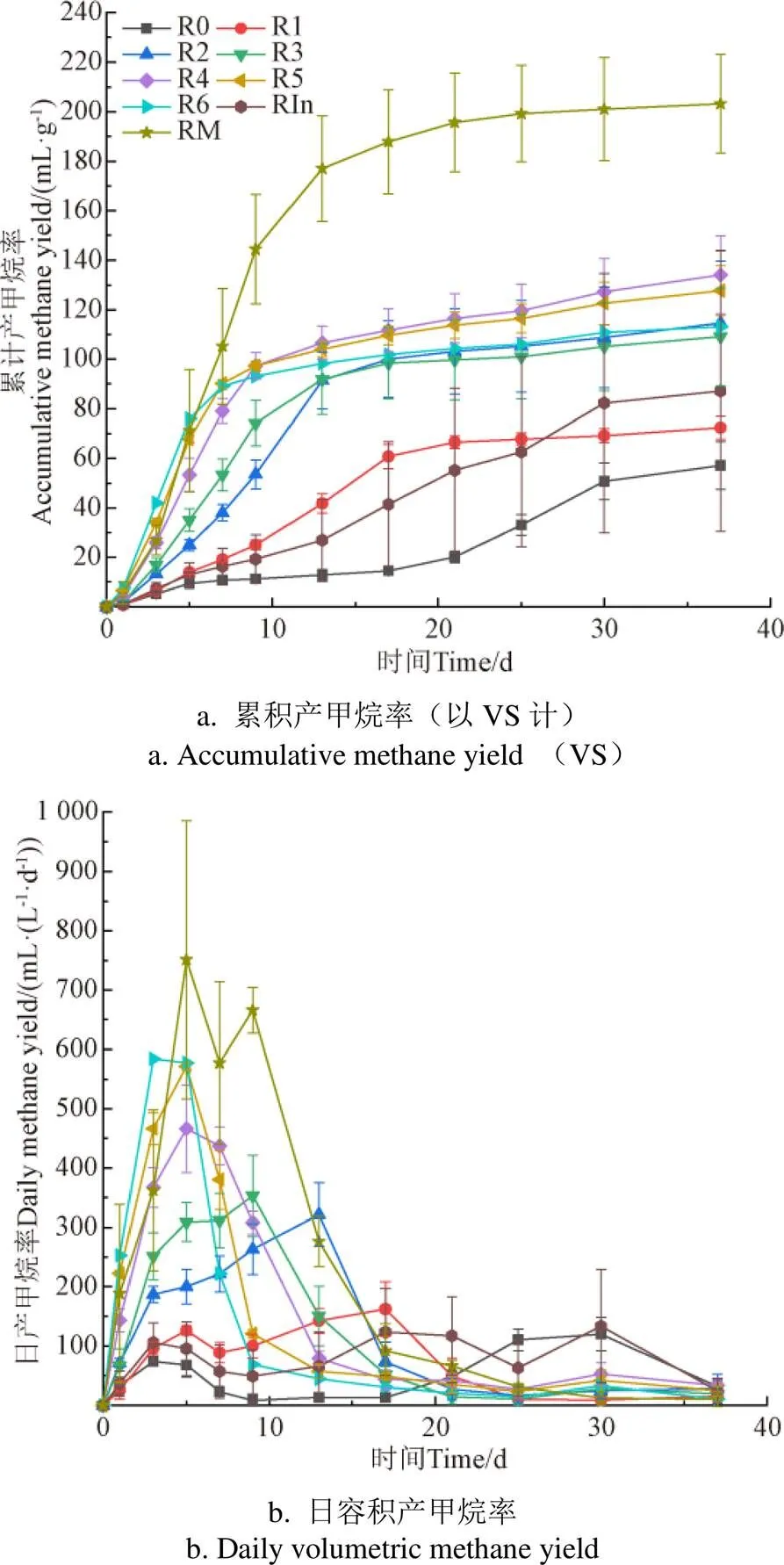
注:R0:低溫對照組,R1~R6:添加不同劑量生物強化菌系,R1:3%,R2:6%,R3:9%,R4:12%,R5:15%,R6:18%,RIn:添加18%秸稈發酵液離心菌泥,RM:中溫對照組,下同。
從日產甲烷率(圖1b)可以看出,所有生物強化組在試驗的前18 d產氣性能均比R0有所提升,菌群添加量越大,日產甲烷率越高,且達到最大產甲烷率需要的時間越短,R6在第3天內達到最大值,達到584.26 mL/(L·d),是R0的4.8 倍,是RIn的4.3倍,達到中溫(RM)最大日產甲烷量的77%,這表明投加生物強化菌群可加快產甲烷進程,且強化體系的產氣率高峰時間和菌群添加量呈正相關。
2.2 生物強化菌系劑量對低溫厭氧消化VFAs和pH的影響
不同生物強化劑量對VFAs的影響如圖2a所示,所有試驗組VFAs均呈現先升高后下降的趨勢,添加丙酸產甲烷菌群生物強化組VFAs濃度始終低于R0和RIn,R0和RIn的VFAs濃度在試驗第12天內和9天內達到最大值,分別為9.6和6.0 g/L,RM的VFAs在第0天達到最大值5.22 g/L后一直下降,而生物強化組VFAs濃度最大范圍處于0.89~4.5 g/L,較R0、RIn、RM組分別減少53.03%~90.71%、24.87%~85.14%、12.28%~83.82%,表明添加生物強化菌系可加快VFAs的降解,VFAs積累程度取決于菌系添加量,菌系添加劑量越高,VFAs積累程度越小。
試驗過程中各組VFAs組分變化如圖2b~2d所示,在整個發酵過程中,乙酸和丙酸是主要的揮發酸,同時檢測到少量丁酸、異丁酸、戊酸、異戊酸。低劑量組R1和R2在第6天乙酸達到最大值,分別為2.33和1.74 g/L。高劑量組R3、R4、R5、R6的乙酸一直無明顯積累,9 d內基本降解,濃度小于0.5 g/L。R0和RIn乙酸濃度分別在12 d和9 d內達到最大值,分別為4.43和2.94 g/L,RM最初就達到最大值2.7 g/L,迅速降解。額外添加菌群可促進乙酸降解產甲烷,但投加秸稈發酵液離心后的菌泥對乙酸降解速率和效率遠遠低于投加丙酸產甲烷菌群系。丙酸變化趨勢與乙酸基本一致,高劑量組R3、R4、R5、R6丙酸無明顯累積,基本呈下降趨勢,在12 d內全部降解;R1和R2丙酸濃度分別在9 d內和6 d內達到最大值,分別為1.97和1.49 g/L,在20 d和15 d全部降解,丙酸濃度大于1 000 mg/L對產甲烷菌有抑制作用[20,26],這是低劑量生物強化后產甲烷率仍然不高的原因。R0丙酸濃度在12 d內達到最大值3.88 g/L,后期積累的丙酸一直無明顯降解,導致pH降低及產甲烷率下降。RIn丙酸濃度在12 d達到最大值2.65 g/L,直至試驗結束才全部降解,說明添加秸稈發酵液離心的菌泥可以緩解丙酸積累,但是依然不能解除酸抑制,RM初始丙酸濃度最高,達2.22 g/L,在12 d內就全部降解。從丙酸濃度來看,生物強化菌群劑量越高,降解丙酸能力越強,生物強化可極大地促進丙酸降解,解除低溫消化酸抑制,從而提高產甲烷率,加快反應進程。這與本實驗室前期利用丙酸產甲烷菌群強化不同原料中溫厭氧發酵生物強化的結果類似,即均可有效降解丙酸及乙酸,避免酸抑制,從而提高產甲烷率[18-22]。

圖2 低溫生物強化對總揮發性脂肪酸濃度和各組分揮發酸濃度的影響
圖3為不同菌系劑量添加對發酵體系內pH值的影響。各試驗組都呈現先下降后上升的趨勢,這是因為在試驗反應初期發酵系統主要進行水解產酸,VFAs的積累導致pH值下降。后期升高說明系統內的VFAs被降解,未添加生物強化菌系組pH值比強化組波動大,表明:加入低溫強化菌系可維持系統pH值穩定,并且可看出,在一定范圍內,菌系劑量越高,pH值波動幅度越小,系統越穩定。R0、RIn與RM的pH值在試驗初期呈現急劇下降的趨勢,而R0直至第9天內下降到最低值6.5,說明低溫抑制產甲烷微生物活性,導致揮發酸不能被及時利用,形成酸抑制,這是低溫消化啟動慢、產甲烷性能差的原因。
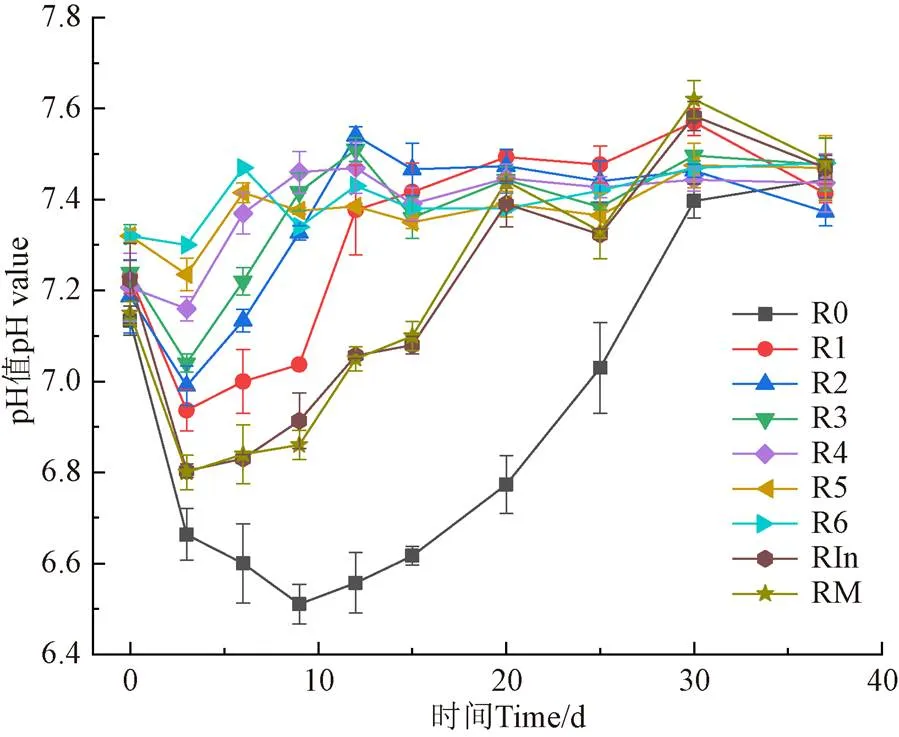
圖3 低溫生物強化對 pH值的影響
2.3 低溫厭氧消化生物強化效果的統計分析
表2詳細對比了不同菌系添加量對秸稈低溫批式厭氧消化的生物強化效果,可以看出各劑量的生物強化均可提高累積產甲烷率,產甲烷增強倍數反映了累積產甲烷率的提升效果,菌系添加量為12% 的R4產甲烷增強倍數最高,較R0提高2.4倍,其他反應器增強倍數從大到小依次為R5、R2、R6、R3、R1,分別提升了2.24、2.01、1.98、1.91、1.27倍。因此,在甲烷增強倍數方面,12%的低溫菌系劑量最佳。

表2 低溫厭氧消化生物強化效果的統計分析
注:生物強化效率=(生物強化組產甲烷率-R0產甲烷率)/菌劑添加量;Ino是秸稈發酵液離心收集的菌泥,80為累積產甲烷量達到總產甲烷量80%所需的時間。
Note: Bioaugmentation efficiency = (methane yield of bioaugmented reactors- methane yield of R0) / Bioaugmentation seeds adding mass. Ino is the microbial sediment collected from stover digestate.80is the time required for cumulative methane production to reach 80% of total production.
然而,生物強化效率隨菌系添加量先增加后降低,最大的生物強化效率在6%的劑量下獲得,達到31.3 mL/g(以VSBS計),其次為R4,達到20.9 mL/g(以VSBS計),因此,從單位質量菌劑強化的效果考慮,6% g (VSBS/VSMS)劑量的R2生物強化效率最高。
80是累積產甲烷量達到總產甲烷量80%所需的時間,反映發酵體系底物甲烷化快慢的重要指標之一。80越短,表明產甲烷效率越高。從表看出,不同劑量的生物強化組的80均有所提前,比低溫對照組縮短12~19 d。生物強化組80隨菌系增加而縮短,R3、R4、R5的80與中溫的80(12 d)相當,R6的80僅9 d,比中溫的80提前3 d。此前利用中溫丙酸產甲烷菌系強化牛糞與秸稈低溫共發酵的80為42 d[22],說明投加低溫丙酸產甲烷菌系的生物強化,顯著縮短了80,大大加快低溫厭氧消化產甲烷。
2.4 厭氧消化過程中甲烷生成的動力學分析
不同菌系添加量產甲烷動力學分析如表3所示。修正的Gompertz方程很好地模擬了不同菌系添加量對低溫消化的影響,決定系數2均在0.95以上,說明擬合程度較高。延滯期表示產甲烷活性,可表示厭氧消化過程中微生物對底物的利用情況,添加產甲烷菌群系會縮短延滯期,菌系劑量越大,延滯期越短,R表示日最大產甲烷率,R隨菌系添加量增加而提高,且添加18% 秸稈發酵液離心的菌泥對照組的和R低于所有添加丙酸產甲烷菌系組。說明生物強化可縮短低溫消化延滯期和提高VS產甲烷速率。
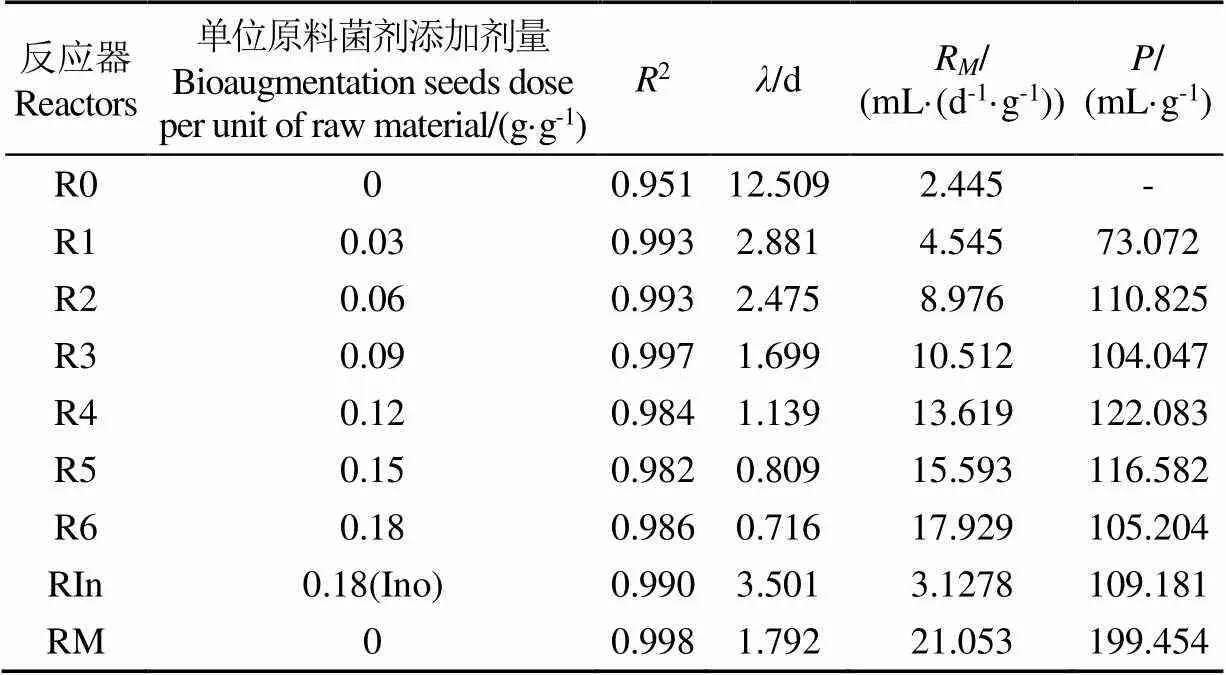
表3 不同菌群添加量下的修正Gompertz模型的參數
2.5 生物強化對發酵體系微生物群落結構的影響
2.5.1 對細菌群落結構的影響
接種物及各反應器內細菌在屬水平的群落結構如圖 4所示,低溫接種物(P-Ino)和中溫接種物(M-Ino)優勢菌屬有較大差異,說明溫度影響微生物的群落組成,低溫接種物優勢水解菌屬為(8.49%),(7.63%),(7.18%),(7.04%),(5.78%);中溫接種物優勢水解菌屬為(17.51%),(9.00%),(6.68%),(5.92%)。其中是產氫產乙酸菌[27],中溫優勢菌屬為纖維素降解菌,而低溫接種物纖維素降解菌相對豐度較低,這是秸稈在低溫和中溫水解程度差異明顯的主要原因。低溫生物強化菌群(P-BS)優勢菌屬為(23.43%),(16.15%),(12.12%),(4.50%),(4.43%),(4.27%),(3.41%).是綠彎曲菌門中的主要屬,在厭氧條件下參與碳水化合物發酵[28]。通過代謝丙酸,最終生成乙酸[29]。在低溫消化組中所有反應器之間群落結構沒有明顯差異,與未生物強化組相比,前期生物強化組的相對豐度分別增加了1.47~8.77 倍,主要參與纖維素、淀粉的水解[30]。相對豐度后期提高4.19~10.79倍,屬主要參與厭氧發酵產酸階段,以大分子碳水化合物為底物,代謝產物為氫氣和VFAs[31]。相對豐度提高2.35~4.05倍,主要功能為降解糖類基質為乙酸[32]。相對豐度提高0.46~2.12倍,主要參與氨基酸降解[33]。而添加秸稈發酵液離心的菌泥對菌群結構無顯著影響。中溫對照組中的水解菌屬遠高于低溫試驗組,因此秸稈在中溫水解程度更徹底,產甲烷率高。以上結果表明添加生物強化菌群可以提高水解菌系的豐度,為秸稈轉化為甲烷提供了更多的中間產物。
2.5.2 對古菌群落結構的影響
接種物及各反應器內古菌在屬水平的群落結構如圖 5所示。
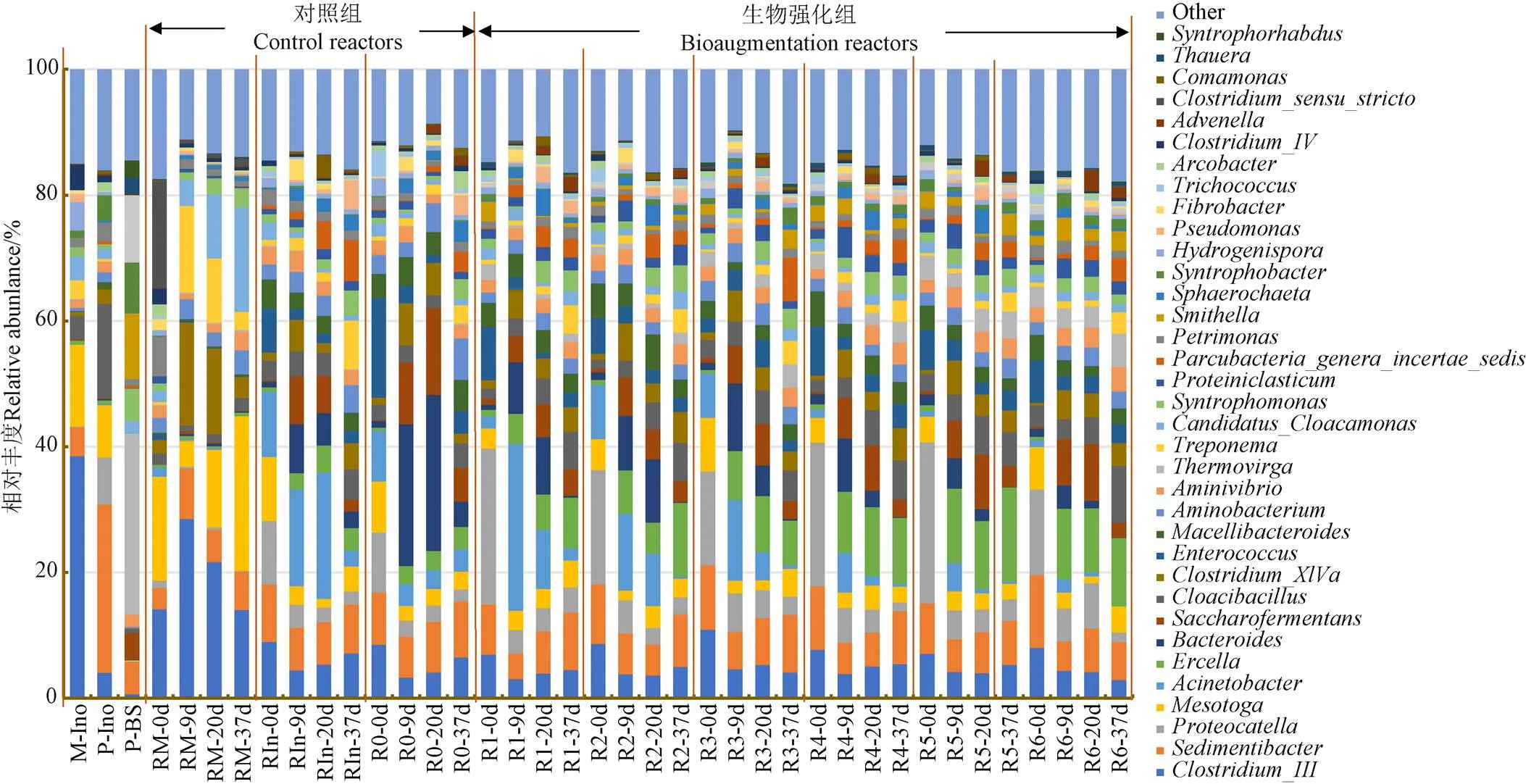
注:M-Ino:中溫接種物,P-Ino:低溫接種物,P-BS:低溫生物強化菌系;RIn:添加18%秸稈發酵液離心菌泥,下同。
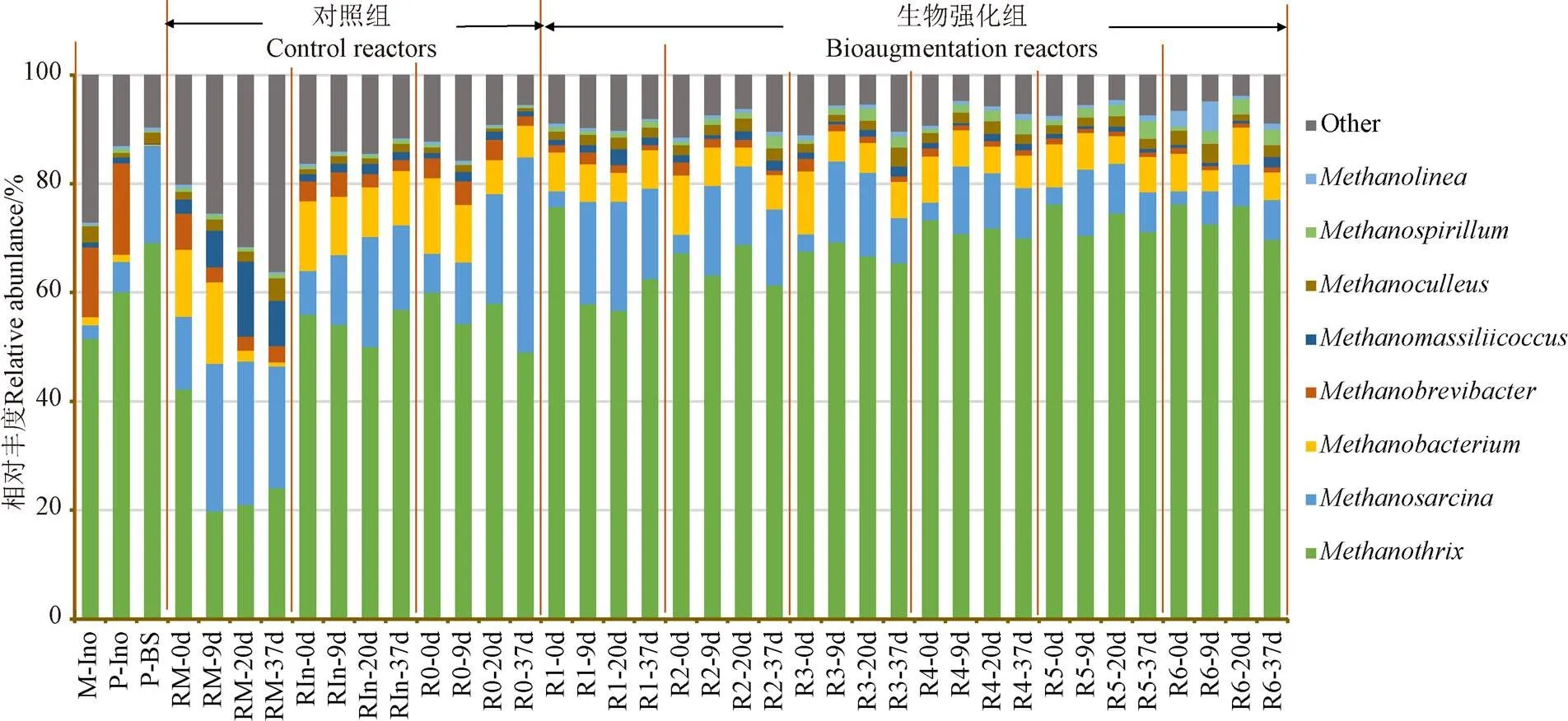
圖5 產甲烷古菌群落在屬水平上的演替
低溫接種物(P-Ino)和中溫接種物(M-Ino)的古菌屬群落結構差異不大,優勢菌屬均為乙酸型產甲烷菌和甲烷桿菌屬,而低溫生物強化菌系(PBS)的優勢菌屬為(69.17%)與(17.85%),為乙酸型產甲烷菌,將乙酸代謝為甲烷;是厭氧系統中常見的產甲烷菌屬,能利用多種產甲烷基質,可通過3種代謝途徑產甲烷(甲醇及甲胺類物質、乙酸、氫)[34]。在生物強化組內,隨著菌群添加量的增加,的相對豐度逐漸上升,相對豐度從 55.23%依次上升至63.23%、64.93%、67.24%、71.62%、73.19%、 73.92%。強化系統中的相對豐度的增加,加快了乙酸的降解速率,增強了產甲烷古菌的代謝途徑,這也是體系內產甲烷性能提升的主要原因。因此,投加低溫生物強化菌群可以維持產酸、產甲烷階段相平衡,避免中間產物酸的累積。秸稈發酵液離心的菌泥強化組(RIn)和對照組(R0) 相比產甲烷菌屬的豐度并沒有提高,生物強化體系的相對豐度均低于RIn和R0,且相對豐度隨菌群添加量增加而降低,是低pH下的一種酸耐受菌[35],這也可以解釋生物強化組緩解VFAs積累避免了pH值下降。中溫組優勢菌屬也是19.80%~42.21%)和13.38%~27.12%),但豐度隨消化時間而提高,這可說明中溫條件更有利于其繁殖生存。
綜上,添加生物強化菌群增加了與的相對豐度,加速了乙酸降解,提高產甲烷率。這與前期投加中溫丙酸產甲烷菌系強化中溫厭氧發酵的試驗結果類似,即通過提高的相對豐度促進產甲烷[36-37]。
3 結 論
1)生物強化可促進秸稈低溫厭氧消化,提高產甲烷率、縮短厭氧發酵時間,菌系添加量為6%時,單位VS菌系提升產甲烷率最高,達到31.3 mL/g;菌系添加量為12%時,促進產甲烷效果最佳,累積VS產甲烷率達到134.1 mL/g,提升產甲烷率2.35倍,菌系添加量為18%時,日產甲烷率達到584.26 mL/(L·d),是空白對照的4.8倍,達到中溫的77%,強化體系的產氣率高峰時間和菌群添加量呈正相關,且最大產甲烷率對應的時間越短,80縮短12~19 d,與中溫厭氧消化時間相當。
2)生物強化可促進秸稈低溫厭氧消化體系內揮發性脂肪酸的降解,尤其乙酸和丙酸,高劑量的生物強化體系(9%、12%、15%、18%)中乙酸和丙酸無明顯積累;低劑量組(3%、6%)乙酸和丙酸稍有累積;而未生物強化組乙酸和丙酸積累達到4.43和3.88 g/L,嚴重抑制產甲烷,導致產甲烷率較低。生物強化加快揮發酸降解,避免酸抑制,提高甲烷產率。
3)修正Gompertz方程可很好地模擬添加產甲烷菌群系對秸稈的厭氧消化的影響,決定系數均在0.95以上,隨生物強化菌系添加量的增加,延滯期縮短,單位VS產甲烷率提高。添加產甲烷菌群系生物強化低溫消化可有效縮短延滯期和提高甲烷產率。
4)低溫生物強化增加了產甲烷古菌與的相對豐度,從而提高了低溫秸稈產甲烷率;此外,生物強化還可提高水解細菌的相對豐度,促進秸稈水解及甲烷轉化進程。
[1] 奚永蘭,劉洋,高娣,等. 農村生活垃圾厭氧發酵產沼氣潛力研究[J]. 農業工程學報,2020,36(23):222-228. XI Yonglan, LIU Yang, GAO Di, 2et al. Potential of biogas produced from anaerobic fermentation of rural household wastes[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(23): 222-228. (in Chinese with English abstract)
[2] MU L, ZHANG L, ZHU K, et al. Semi-continuous anaerobic digestion of extruded OFMSW: Process performance and energetics evaluation[J]. Bioresource Technology, 2018, 247: 103-115.
[3] 李金平,曹崗林,曹忠耀,等. 蘭州太陽能與發電余熱增溫沼氣工程的性能研究[J]. 中國沼氣,2017,35(2):90-95. LI Jinping, CAO Ganglin, CAO Zhongyao, et al. Performance of biogas project increasing temperature by solar energy and waste heat from power generation[J]. China Biogas, 2017, 35(2): 90-95. (in Chinese with English abstract)
[4] 叢宏斌,孟海波,于佳動,等. “綠色”引領下東北地區秸稈產業發展長效機制解析[J]. 農業工程學報,2021,37(13):314-321. CONG Hongbin, MENG Haibo, YU Jiadong, et al. Analysis of long-term mechanism for development of straw industry in northeast China under guidance of “Green-concept”[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(13): 314-321. (in Chinese with English abstract)
[5] 朱瑞清,牛永艷,毛婷,等. 低溫厭氧發酵對奶牛養殖廢水沉降特征的影響[J]. 農業工程學報,37(5):224-230. ZHU Ruiqing, NIU Yongyan, MAO Ting, et al. Influence of low-temperature anaerobic fermentation on sedimentation characteristics of dairy wastewater[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(5): 224-230. (in Chinese with English abstract)
[6] DEV S, SAHA S, KURADE M B, et al. Perspective on anaerobic digestion for biomethanation in cold environments[J]. Renewable & Sustainable Energy Reviews, 2019, 103: 85-95.
[7] AKILA G, CHANDRA T S. Performance of an UASB reactor treating synthetic wastewater at low-temperature using cold-adapted seed slurry[J]. Process biochemistry, 2007, 42(3): 466-471.
[8] SAADY N M C, MASSé D I. Psychrophilic anaerobic digestion of lignocellulosic biomass: A characterization study[J]. Bioresource Technology, 2013, 142: 663-671.
[9] MARTI-HERRERO J, SORIA-CASTELLON G, DIAZ-DE-BASURTO A, et al. Biogas from a full scale digester operated in psychrophilic conditions and fed only with fruit and vegetable waste[J]. Renewable Energy, 2019, 133: 676-684.
[10] ZHANG J, ZHANG R, WANG H, et al. Direct interspecies electron transfer stimulated by granular activated carbon enhances anaerobic methanation efficiency from typical kitchen waste lipid-rapeseed oil[J]. Science of the Total Environment, 2020, 704: 1-8.
[11] LIN R, CHENG J, DING L, et al. Improved efficiency of anaerobic digestion through direct interspecies electron transfer at mesophilic and thermophilic temperature ranges[J]. Chemical Engineering Journal, 2018, 350: 681-691.
[12] WEI S, ZHANG H, CAI X, et al. Psychrophilic anaerobic co-digestion of highland barley straw with two animal manures at high altitude for enhancing biogas production[J]. Energy Conversion and Management, 2014, 88: 40-48.
[13] LIU D, ZHANG L, CHEN S, et al. Bioelectrochemical enhancement of methane production in low temperature anaerobic digestion at 10 ℃[J]. Water Research, 2016, 99: 281-287.
[14] ZHOU H, LI X, XU G, et al. Overview of strategies for enhanced treatment of municipal/domestic wastewater at low temperature[J]. Science of the Total Environment, 2018, 643: 225-237.
[15] MA H, ZHAO Y, YANG K, et al. Application oriented bioaugmentation processes: Mechanism, performance improvement and scale-up[J]. Bioresource Technology, 2021, 344(PB): 126192.
[16] GAO D, ZHAO H, WANG L, et al. Current and emerging trends in bioaugmentation of organic contaminated soils: A review[J]. Journal of Environmental Management, 2022, 320: 115799.
[17] LI L, LI Y, SUN Y, et al. Effect of bioaugmentation on the microbial community and mono-digestion performance of Pennisetum hybrid[J]. Waste Management, 2018, 78: 741-749.
[18] HE L, LI L, LI Y, et al. Bioaugmentation with methanogenic culture to improve methane production from chicken manure in batch anaerobic digestion[J]. Chemosphere, 2022, 303: 135127.
[19] LI Y, WANG C, XU X, et al. Bioaugmentation with a propionate-degrading methanogenic culture to improve methane production from chicken manure[J]. Bioresource technology, 2021, 346: 126607.
[20] JIANG J, LI L, LI Y, et al. Bioaugmentation to enhance anaerobic digestion of food waste: Dosage, frequency and economic analysis[J]. Bioresource Technology, 2020, 307: 123256.
[21] YAN M, WANG C, LI Y, et al. Effect of bioaugmentation on psychrotrophic anaerobic digestion: Bioreactor performance, micriobial community, and cellular metabolic response[J]. Chemical Engineering Journal, 2023, 455: 140173.
[22] XU X, SUN Y, SUN Y, et al. Bioaugmentation improves batch psychrophilic anaerobic co-digestion of cattle manure and corn straw[J]. Bioresource Technology, 2022, 343: 126118.
[23] LUCJAN P. Standard methods for the examination of water and wastewater, 18th edition: Arnold E. Greenberd, Lenore S. Clesceri, Andrew D. Eaton (Editors) Water Environment Federation, Alexandria, USA, 1992; 1025 pp; US$120 (Hardcover); ISBN 0-87553-207-1[J]. Science of the Total Environment, 1994, 142(3): 227-228.
[24] SLUITER J B, RUIZ R O, SCARLATA C J, et al. Compositional analysis of lignocellulosic feedstocks. 1. review and description of methods[J]. Journal of Agricultural and Food Chemistry, 2010, 58(16): 9043-9053.
[25] 徐文倩,董紅敏,尚斌,等. 典型畜禽糞便厭氧發酵產甲烷潛力試驗與計算[J]. 農業工程學報,2021,37(14):228-234. XU Wenqian, DONG Hongmin, SHANG Bin, et al. Experiment and calculation on the biochemical methane potential of typical livestock and poultry manure in anaerobic digestion[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(14): 228-234. (in Chinese with English abstract)
[26] XING L, WANG Z, GU M, et al. Coupled effects of ferroferric oxide supplement and ethanol co-metabolism on the methanogenic oxidation of propionate[J]. Science of the Total Environment, 2020, 723: 137992.
[27] 李建政,孫倩,劉楓,等. 一種產氫產乙酸菌互營共培養體的篩選及其群落結構解析[J]. 科技導報,2009,27(16):78-82.
[28] WANG H, CHEN N, FENG C, et al. Research on efficient denitrification system based on banana peel waste in sequencing batch reactors: Performance, microbial behavior and dissolved organic matter evolution[J]. Chemosphere, 2020, 253: 126693.
[29] LOUBINOUX J, VALENTE F M A, PEREIRA I A C, et al. Reclassification of the only species of the genus Desulfomonas, Desuffomonas pigra, as Desulfovibrio piger comb. nov[J]. International Journal of Systematic and Evolutionary Microbiology, 2002, 52: 1305-1308.
[30] BARRAGáN-TRINIDAD M, CARRILLO-REYES J, BUITRóN G. Hydrolysis of microalgal biomass using ruminal microorganisms as a pretreatment to increase methane recovery[J]. Bioresource Technology, 2017, 244: 100-107.
[31] LIU Z, ZHANG C, WANG L, et al. Effects of furan derivatives on biohydrogen fermentation from wet steam-exploded cornstalk and its microbial community[J]. Bioresource Technology, 2015, 175: 152-159.
[32] FENG D, XIA A, LIAO Q, et al. Carbon cloth facilitates semi-continuous anaerobic digestion of organic wastewater rich in volatile fatty acids from dark fermentation[J]. Environmental Pollution, 2021, 272: 116030.
[33] WANG Z, ZHANG C, WATSON J, et al. Adsorption or direct interspecies electron transfer? A comprehensive investigation of the role of biochar in anaerobic digestion of hydrothermal liquefaction aqueous phase[J]. Chemical Engineering Journal, 2022, 435: 135078.
[34] CONKLIN A, STENSEL H D, FERGUSON J. Growth kinetics and competition between Methanosarcina and Methanosaeta in mesophilic anaerobic digestion[J]. Water Environment Research, 2006, 78(5): 486-496.
[35] LIU Y, B W W. Metabolic, phylogenetic, and ecological diversity of the methanogenic archaea[J]. Annals of the New York Academy of Sciences, 2008, 1125(1): 171-189.
[36] LI Y, LI L, SUN Y, et al. Bioaugmentation strategy for enhancing anaerobic digestion of high C/N ratio feedstock with methanogenic enrichment culture[J]. Bioresource Technology, 2018, 261: 188-195.
[37] LI Y, YANG G, LI L, et al. Bioaugmentation for overloaded anaerobic digestion recovery with acid-tolerant methanogenic enrichment[J]. Waste Management, 2018, 79: 744-751.
Bioaugmentation of psychrophilic methanogenic microbial consortia on psychrophilic anaerobic digestion of maize stovers
ZHANG Xinjie1,2,3,4, SUN Yongming1,2,3, YAN Miao2,3, LI Jinping1,4, LI Ying2,3※
(1.,,730050,;2.,,510640,; 3.,,510640,; 4.,730050,)
A large number of maize stover can be generated per year in recent years. Sustainable treatments of maize stover can be expected to produce the renewable energy. Among them, anaerobic digestion is a friendly biotechnology to recover the renewable energy from maize stover. Especially, the psychrophilic anaerobic digestion can only require less energy input, compared with the commonly-used mesophilic and thermophilic digestors. However, a psychrophilic environment can inhibit the microbial activity, causing the low efficiency of methane production. In this study, the bioaugmentation of psychrophilic propionate-degrading consortia (the mixture of propionic-degrading consortia and acetogenic methanogen) was conducted to boost the anaerobic digestion of corn straw in psychrophilic batch reactors, with the different dosages of 3%, 6%, 9%, 12%, 15%, and 18% at low temperature (20 ℃). The concentrated indigenous inoculum with the dosage of 18% was introduced as the control. The reactor performance, microbial metabolites, and microbial community dynamics were analyzed to investigate the optimum dosage and mechanism. The results showed that the bioaugmentation consortia was improve the methane production rate under a psychrophilic anaerobic environment, as evidenced by 1.27 to 2.24 times increase in the bioaugmented groups, compared with the control (without bioaugmentation). The bioaugmentation dosage in the range of 3% to 12% was positively correlated with the methane yields. The optimal dose was 12%, with the methane yields of 134.1 mL/g VS. The accumulative methane yield was 2.35 times higher than that of the control. By contrast, there was no increase in the methane yields within the higher bioaugmentation dosage (i.e., 15%-18%). The modified Gompertz model showed that the concentrated indigenous inoculum was reduced the lag phase from 3.501 to 12.509 days, indicating the necessity of bioaugmentation with the key microbial consortia to boost the methane yields. Bioaugmentation inocula with the propionate-degrading consortia was shorten the lag phase from 0.716 to 12.509 days, whereas, there was the increase in the maximum methane production rate from 2.445 to 17.929 mL CH4/(gVS·d). Meanwhile, the psychrophilic environment was caused the acetate accumulation up to 4.43 g/L. At the same time, the propionate concentrations were kept at 3.88 g/L in the control reactor in the whole experimental process. Conversely, the bioaugmentation with psychrotrophic propionate-degrading consortia was accelerated the VFAs degradations, especially the acetate and propionate, which was 53.03%-90.71% less than that of the control reactor. Moreover, the acetate and propionate were fully degraded within the first 9 days in the bioaugmented reactors with 9%-15% dosage, indicating the important role of bioaugmented consortia in the scavenging propionate and acetate. Microbial analysis showed that the bioaugmentation increased the relative abundance of taxa (e.g., Proteocatella, Smithella, Peptococcaceae) for the hydrolysis and acetogenesis process. The dominant methanogens in the bioaugmented reactors were represented by acetoclastic methanogens (i.e., Methanothrix and Methanosarcina) and hydrogenotrophic methanogen (Methanobrevibacter), indicating the key contributions to increase the methane yield under psychrotrophic environment. Consequently, the bioaugmentation consortia can generate a domino effect, where acetate levels were reduced first and other VFAs degradation became thermodynamics feasible, leading to the balance between VFAs degradation and methane production. This finding can provide the evidence and guidance to improve the psychrophilic anaerobic digestion through bioaugmentation.
methane; maize stover; psychrophilic anaerobic digestion; bioaugmentation; microbial community
10.11975/j.issn.1002-6819.202211136
S21;TK6
A
1002-6819(2023)-06-0186-08
張新杰,孫永明,閆淼,等. 低溫產甲烷菌群對玉米秸稈低溫厭氧消化的生物強化作用[J]. 農業工程學報,2023,39(6):186-193.doi:10.11975/j.issn.1002-6819.202211136 http://www.tcsae.org
ZHANG Xinjie, SUN Yongming, YAN Miao, et al. Bioaugmentation of psychrophilic methanogenic microbial consortia on psychrophilic anaerobic digestion of maize stovers[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2023, 39(6): 186-193. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.202211136 http://www.tcsae.org
2022-11-15
2023-03-08
中國科學院戰略性先導科技專項(XDA21050400);國家自然科學基金面上項目(52170143);廣東省自然科學基金面上項目(2021A1515012082);中國科學院青年創新促進會
張新杰,研究方向為低溫厭氧發酵與生物強化技術。Email:zhangxinjie1222@163.com
李穎,博士,研究員,研究方向為有機固體廢棄物生物處理及資源化利用。Email:liying@ms.giec.ac.cn

