五虎湯通過調控miRNA-146a改善幼齡哮喘大鼠氣道重塑
鄧羿駃 王孟清 謝靜 胡燕 曾潔 羅菁 姚冰

〔摘要〕 目的 探討五虎湯通過調控miRNA-146a對幼齡哮喘大鼠氣道重塑的影響。方法 SPF級幼齡雌性SD大鼠80只,先隨機將20只作為空白組,60只作為造模組。造模組采用卵清白蛋白聯合氫氧化鋁五點注射法致敏以及卵清白蛋白霧化激發哮喘。兩組各隨機抽取10只檢測氣道反應性,評判造模是否成功。造模成功后,剩下的10只空白組大鼠作為正常組,50只造模組大鼠隨機分為5組(模型組、五虎湯低劑量組、五虎湯中劑量組、五虎湯高劑量組、地塞米松組),每組10只。五虎湯高、中、低劑量組分別灌胃五虎湯4.428、2.214、1.107 g/kg,地塞米松組灌胃地塞米松0.075 mg/kg,正常組及模型組灌胃等容積生理鹽水,1次/d,連續2周后處理大鼠。氣道反應性檢測大鼠氣道阻力;HE、PAS及Masson染色法分別觀察大鼠肺組織氣道炎癥細胞浸潤、氣道黏液儲備和氣道膠原沉積情況;Western blot法檢測基質金屬蛋白酶-9(matrix metalloprotein-9, MMP-9)、金屬蛋白酶組織抑制因子-1(tissue inhibitor of matrix metalloproteinases-1, TIMP-1)、α-平滑肌肌動蛋白(α-smooth muscle actin, α-SMA)、轉化生長因子-β1(transforming growth factor-β1, TGF-β1)蛋白表達水平;qPCR法檢測miRNA-146a及MMP-9、TIMP-1 mRNA含量,并對miRNA-146a與MMP-9、TIMP-1 mRNA進行相關性分析。結果 與空白組比較,造模組氣道阻力顯著升高(P<0.01),提示造模成功。與正常組比較,模型組大鼠肺組織周圍炎性細胞浸潤,上皮細胞化生,炎性黏液較多,氣道壁增厚,氣道膠原廣泛沉積;肺組織α-SMA、TGF-β1、MMP-9、TIMP-1、miRNA-146a、MMP-9 mRNA、TIMP-1 mRNA均顯著升高(P<0.01)。與模型組相比,五虎湯高、中、低劑量組及地塞米松組氣道阻力明顯降低(P<0.01),肺組織病理情況明顯緩解,且五虎湯高劑量組及地塞米松組改善更加明顯;α-SMA、TGF-β1、MMP-9、TIMP-1、miRNA-146a、MMP-9 mRNA、TIMP-1 mRNA均顯著下降(P<0.01)。五虎湯中、低劑量組α-SMA、TGF-β1、miRNA-146a、MMP-9 mRNA、TIMP-1 mRNA及五虎湯低劑量組TIMP-1顯著高于地塞米松組(P<0.05、P<0.01);五虎湯高、中劑量組α-SMA、TIMP-1、miRNA-146a、MMP-9 mRNA、TIMP-1 mRNA及五虎湯高劑量組TGF-β1低于五虎湯低劑量組(P<0.05、P<0.01);五虎湯高劑量組α-SMA、TGF-β1、miRNA-146a、TIMP-1 mRNA低于五虎湯中劑量組(P<0.05、P<0.01)。Pearson相關性分析顯示,大鼠肺組織miRNA-146a與MMP-9 mRNA、TIMP-1 mRNA均有極強正相關性(r分別為0.956、0.973,P<0.01)。結論 五虎湯能夠有效改善哮喘大鼠氣道重塑,這可能與五虎湯抑制miRNA-146a表達,降低MMP-9、TIMP-1及其mRNA,以及減少α-SMA、TGF-β1相關。
〔關鍵詞〕 五虎湯;幼齡哮喘大鼠;miRNA-146a;氣道重塑;基質金屬蛋白酶-9;金屬蛋白酶組織抑制因子-1;α-平滑肌肌動蛋白;轉化生長因子-β1
〔中圖分類號〕R285.5? ? ? ?〔文獻標志碼〕A? ? ? ? 〔文章編號〕doi:10.3969/j.issn.1674-070X.2023.05.007
Improvement of Wuhu Decoction on airway remodeling in young asthmatic rats by
regulating miRNA-146a
DENG Yijue WANG Mengqing XIE Jing HU Yan ZENG Jie LUO Jing YAO Bing
1. The First Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410007, China; 2. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 3. Shenzhen Nanshan District Shekou People's Hospital, Shenzhen, Guangdong 154100, China
〔Abstract〕 Objective To explore the effects of Wuhu Decoction (WHD) on airway remodeling in young asthmatic rats by regulating miRNA-146a. Methods A total of 80 young female SD rats of SPF grade were randomly divided into blank group (n=20) and modeling group (n=60). To stimulate asthma, the modeling group was sensitized by ovalbumin (OVA) combined with aluminum hydroxide five-point injection and OVA atomization. Ten rats were randomly selected from each group to detect airway responsiveness and evaluate the success of modeling. After successful modeling, the remaining 10 rats in the blank group were considered as the normal group, and 50 rats in the modeling group were randomly subdivided into 5 groups (model group, low-, medium- and high-dose WHD groups, and dexamethasone group), with 10 rats in each group. The high-, medium- and low-dose WHD groups were respectively given WHD 4.428, 2.214, 1.107 g/kg by gavage, the dexamethasone group was given dexamethasone 0.075 mg/kg by gavage, and the normal group and model group were given equal volume physiological saline by gavage, once a day, for 2 consecutive weeks. Then the rats were anaesthetized and tracheotomized. The airway resistance in rats was measured by airway responsiveness; the airway inflammatory cell infiltration, airway mucus reserve, and airway collagen deposition in lung tissue of rats were observed respectively by HE, PAS and Masson staining methods; the expression levels of the matrix metalloproteinase-9 (MMP-9), tissue inhibitor of matrix metalloproteinases-1 (TIMP-1), α-smooth muscle actin (α-SMA) and transforming growth factor-β1 (TGF-β1) protein were determined by Western blot; the content of miRNA-146a, MMP-9, TIMP-1 mRNA was examined by qPCR and the correlation between miRNA-146a and MMP-9, TIMP-1 mRNA was analyzed. Results Compared with the blank group, the airway resistance in the modeling group was significantly higher (P<0.01), which indicated the success of modeling. Compared with the normal group, the rats in the model group demonstrated as follows: inflammatory cell infiltration around the lung tissue, epithelial cell metaplasia, more inflammatory mucus, airway wall thickening and extensive deposition of airway collagen; the α-SMA, TGF-β1, MMP-9, TIMP-1, miRNA-146a, MMP-9 mRNA and TIMP-1 mRNA expressions in lung tissue of rats in the model group were significantly higher (P<0.01). Compared with the model group, the airway resistance in high-, medium- and low-dose WHD groups and the dexamethasone group was significantly lower (P<0.01), and the pathological condition of lung tissue was significantly alleviated, moreover, the improvement in the high-dose WHD group and the dexamethasone group was more significant; the α-SMA, TGF-β1, MMP-9, TIMP-1, miRNA-146a, MMP-9mRNA, TIMP-1 mRNA expressions in high-, medium- and low-dose WHD groups and the dexamethasone group were significantly lower (P<0.01). The α-SMA, TGF-β1, miRNA-146a, MMP-9 mRNA, and TIMP-1 mRNA expressions in medium- and low-dose WHD groups and the TIMP-1 of the rats in low-dose WHD group were significantly higher than those in the dexamethasone group (P<0.05, P<0.01); the α-SMA, TIMP-1, miRNA-146a, MMP-9 mRNA, and TIMP-1 mRNA expressions in high- and medium-dose WHD groups and the TGF-β1 expression in high-dose WHD group were lower than those in low-dose WHD group (P<0.05, P<0.01). The α-SMA, TIMP-1, miRNA-146a, and TIMP-1 mRNA expressions in the high-dose WHD group were lower than those in medium-dose WHD group (P<0.05, P<0.01). Pearson correlation analysis showed that there was a strong positive correlation between miRNA-146a and MMP-9 mRNA, TIMP-1 mRNA in the lung tissue of rats (r=0.956, 0.973, P<0.01). Conclusion WHD can effectively improve airway remodeling in asthmatic rats, which may be related to its inhibition of miRNA-146a expression and reduction of MMP-9, TIMP-1, mRNA, α-SMA and TGF-β1 expressions.
〔Keywords〕 Wuhu Decoction; young asthmatic rats; miRNA-146a; airway remodeling; matrix metalloproteinase-9; tissue inhibitor of matrix metalloproteinases-1; α-smooth muscle actin; transforming growth factor-β1
支氣管哮喘是一種由多種細胞和細胞因子參與的支氣管慢性炎癥性疾病,臨床上主要表現為喘息、氣促、胸悶、咳嗽等癥狀[1]。此病兒童發病率較高,嚴重影響患兒的身心健康,目前暫無根治性治療方案[2]。其發病機制復雜,與氣道炎癥、氣道高反應、氣道重塑及機體免疫反應密切相關,跟遺傳也有一定關系[3]。氣道重塑由氣道壁的多種結構變化組成,包括上皮損傷、上皮下纖維化、肌成纖維細胞增生、平滑肌纖維增加和血管增生等,造成管腔狹窄,是目前治療哮喘最棘手的問題之一[4]。中醫治療哮喘有毒副作用小、療效佳的優勢,逐漸被人們所接受,本課題組前期研究證實,古方五虎湯作為治喘名方,可有效緩解哮喘的氣道重塑[5],但具體機制未完全闡明。隨著現代研究的深入,研究者們發現哮喘的發生、發展與小分子RNA(microRNA, miRNA)表達異常相關[6],且miRNA-146a是哮喘患者肺組織中表達最明顯的一類miRNA[7]。既往研究表明miRNA-146a能促進增生細胞凋亡,在一定程度上能達到控制甚至逆轉支氣管哮喘氣道重塑的作用[8],但具體機制尚未完全闡明。中醫藥通過調控miRNA-146a防治哮喘的研究仍處于初步階段。本研究旨在探討五虎湯通過調控miRNA-146a,對幼齡哮喘大鼠肺組織氣道重塑的影響,以進一步明確五虎湯治療哮喘的可能效應機制,為臨床提供新的診療思路。
1 材料和方法
1.1 動物
SPF級雌性SD大鼠80只,3周齡,體質量(86.3±4.3) g,購自湖南斯萊克景達實驗動物有限公司,動物資格證書編號:SCXK(湘)2019-0004;室溫18~20 ℃,濕度65%~70%,光照時間12 h/d,自由進食飲水。實驗方案經湖南中醫藥大學第一附屬醫院動物實驗倫理委員會批準,倫理批準號:ZYFY20220612。
1.2? 藥物制備
麻黃2.4 g、苦杏仁6.0 g、生石膏9.0 g、生甘草2.4 g、細茶葉4.8 g(生產批號分別為2202080302、2022030505、2201101、TH22050908、SC11443082100076),購于湖南中醫藥大學第一附屬醫院中藥房。將所有藥物混合,加入5倍量蒸餾水,先浸泡30 min,然后回流提取40 min,將藥液濾凈后再加入5倍量蒸餾水,再次回流提取40 min,將前后2次煎液混勻,使用旋轉蒸發儀濃縮成2.46 kg/L。
1.3? 藥物與試劑
地塞米松(美國Sigma公司,批號:D1758);雞卵清白蛋白(北京索萊寶科技有限公司,批號:9006-59-1);氯化乙酰膽堿(美國Selleck公司,批號:2260-50-7);HE染色液(湖南艾佳生物科技股份有限公司,批號:P032IH);Masson和PAS染色液(北京索萊寶科技有限公司,批號分別為:G1285、G1243);β-actin抗體、山羊抗兔二抗(美國Proteintech公司,批號:66009-1-Ig、SA00001-4);MMP-9、TIMP-1、α-SMA、TGF-β1抗體(英國Abcam公司,批號:573145、GR3281503-1、GR3231643-1、GR3219232-1);Trizol試劑、逆轉錄試劑盒(美國Thermo公司,批號:15596026、K1622);qPCR試劑盒(上海近岸生物科技有限公司,批號:PA0025)。
1.4? 主要儀器
超聲霧化器(南京道芬電子有限公司,型號:S888E);小動物呼吸機與氣道阻力和肺順應性分析軟件(美國BUXCO公司,型號:DHX-50);顯微鏡[麥克奧迪(廈門)電氣股份有限公司,型號:BA210T];臺式冷凍離心機(中國湖南湘儀離心機儀器有限公司,型號:H1650R);電泳儀、轉膜儀(中國北京六一生物科技有限公司,型號:DYY-6C、DYCZ-40D);熒光定量PCR儀(美國Thermo公司,型號:PIKOREAL96);透明霧化吸入箱(34 cm×45 cm×50 cm,課題組自制)。
2 實驗方法
2.1? 實驗動物分組及給藥
SPF級SD大鼠80只,適應性喂養3 d后,采用隨機數字表法取20只作為空白組,60只作為造模組,參考文獻[9]復制哮喘大鼠模型。將造模組大鼠于試驗第1天及第7天予卵清白蛋白與氫氧化鋁佐劑的混合液共1 mL(含1 mg卵清白蛋白和200 mg氫氧化鋁佐劑)五點(雙側足心、雙側腹股溝皮下、腹腔)注射致敏。于實驗第15天開始,將大鼠置于密封性良好的霧化箱中,予以1%卵清白蛋白溶液霧化以激發哮喘。空白組用生理鹽水霧化,每次持續30 min,隔天1次,連續2周。第30天,于兩組中各隨機取10只測氣道反應性,氣道阻力升高提示造模成功。造模成功后,將造模組剩余的50只大鼠隨機分為5組(模型組、五虎湯低劑量組、五虎湯中劑量組、五虎湯高劑量組及地塞米松組),每組10只,剩余10只空白組大鼠作為正常組。于第31天開始,根據課題組前期實驗研究及人與大鼠體表面積比值折算,五虎湯各劑量組分別灌胃相應劑量五虎湯(高、中、低劑量分別為4.428、2.214、1.107 g/kg),地塞米松組灌胃0.075 mg/kg地塞米松,正常組及模型組采用等容積生理鹽水灌胃,每日1次,連續2周。
2.2? 氣道反應性測定
于末次霧化激發24 h后,從空白組和造模組中分別隨機抽取10只大鼠進行氣道反應性測定,驗證造模是否成功。末次給藥24 h后,對各組大鼠進行氣道反應性檢測。大鼠麻醉后切開氣管,進行氣管插管后,把大鼠放入體描箱中,連接呼吸機,調整呼吸機參數,頻率為75次/min,潮氣量為8 mL/kg,記錄初始的氣道壓力、流速以及潮氣量變化,待大鼠氣道壓力平穩后,霧化吸入0.1 mL不同濃度的乙酰膽堿(0、6.25、12.5、25、50 μg/mL),每次吸入乙酰膽堿后,收集吸入后5 s至1 min的數據,并用動物肺功能分析軟件計算出最大肺阻力。
2.3? 肺組織病理檢測
取左側肺組織放置于4%多聚甲醛溶液中固定,經石蠟包埋、切片,分別用HE、PAS、Masson 3種染色方法對標本染色,鏡下觀察并拍照,觀察肺組織的病理變化。
2.4? Western blot法檢測肺組織α-SMA、TGF-β1、MMP-9、TIMP-1蛋白表達水平
取右肺組織提取總蛋白,BCA法測定蛋白質濃度。蛋白樣本經SDS-PAGE電泳,轉至PVDF膜,5%脫脂奶粉封閉1 h,分別加入α-SMA(0.5 μg/mL)、TGF-β1(1∶1000)、MMP-9(1∶1000)、TIMP-1(1∶5000)、β-actin(1∶5000)抗體孵育過夜。TBST洗滌3次,每次10 min。加入PBST稀釋HRP標記的二抗,室溫孵育1 h,TBST 洗滌3次,每次10 min。采用凝膠成像系統成像掃描,用Quantity One 4.6.6軟件進行灰度分析。
2.5? qPCR法檢測肺組織miRNA-146a及MMP-9、TIMP-1 mRNA表達情況
取右肺組織約0.02 g,加入1 mL Trizol于勻漿器中充分研磨勻漿,混勻后室溫裂解5 min;加入200 μL三氯甲烷,劇烈振蕩15 s,室溫靜置3 min;12 000 r/min,4 ℃離心15 min,離心半徑9 cm。取上層液,轉移到新的RNase-Free離心管中;加入等體積的異丙醇,混勻,室溫靜置10 min;12 000 r/min,4 ℃離心10 min,離心半徑9 cm,去上清液,加入1 mL75%乙醇(無菌DEPC處理水配制)洗滌沉淀;12 000 r/min,4 ℃離心3 min,離心半徑9 cm,去上清液;空氣干燥5~10 min。加入20~30 μL無菌無酶水溶解沉淀;紫外分光光度計測定濃度,在260 nm與280 nm處測其吸光度值,并計算其濃度。各指標引物由北京擎科生物科技股份有限公司設計合成,序列見表1。
2.6? 統計學分析
采用SPSS 26.0統計軟件對數據進行處理,結果用“x±s”表示,多組間比較采用單因素方差分析,事后檢驗采用LSD法;相關性分析使用Pearson相關檢驗。P<0.05表示差異有統計學意義。
3 結果
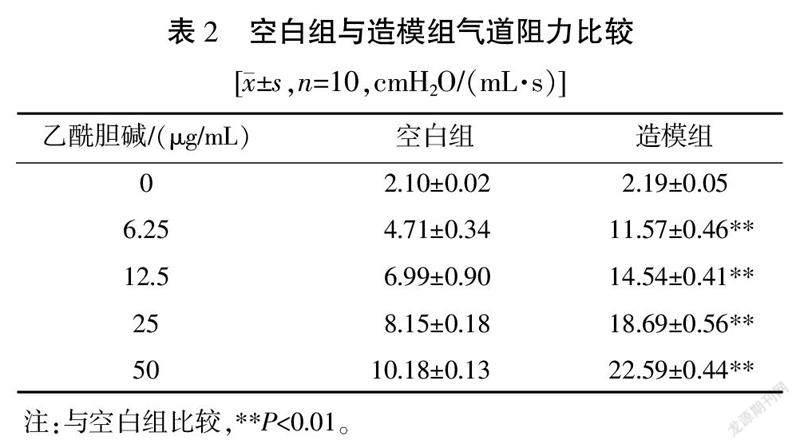
3.1? 空白組與造模組氣道阻力比較
在乙酰膽堿濃度為0時,兩組氣道阻力差異無統計學意義(P>0.05)。造模組大鼠在不同濃度乙酰膽堿(6.25、12.5、25、50 μg/mL)激發下,均比空白組大鼠的氣道阻力明顯增高(P<0.01),說明造模成功。詳見表2。
3.2? 各組大鼠氣道阻力比較
在乙酰膽堿濃度為0時,各組氣道阻力差異無統計學意義(P>0.05)。在其他濃度乙酰膽堿(6.25、12.5、25、50 μg/mL)激發下,模型組大鼠的氣道阻力均比正常組大鼠明顯增高(P<0.01);與模型組相比,五虎湯各組及地塞米松組大鼠氣道阻力均顯著降低(P<0.01);與地塞米松組相比,五虎湯中、低劑量組氣道阻力明顯升高(P<0.01);與五虎湯低劑量組相比,五虎湯高、中劑量組大鼠氣道阻力明顯降低(P<0.01);與五虎湯中劑量組相比,五虎湯高劑量組大鼠氣道阻力顯著下降(P<0.01)。詳見表3。
3.3? 各組大鼠染色情況比較
3.3.1? HE染色觀察氣道炎癥細胞浸潤情況? 正常組大鼠支氣管結構正常,支氣管黏膜平整,氣管四周無明顯炎癥細胞浸潤;而模型組可見氣管四周有明顯炎癥細胞浸潤;五虎湯低、中、高劑量組和地塞米松組大鼠炎癥細胞浸潤明顯減輕。詳見圖1。
3.3.2? PAS染色觀察氣道黏液儲備情況? 正常組大鼠支氣管管腔完整,無明顯氣道杯狀上皮細胞增生,無明顯黏液;與正常組相比,模型組大鼠支氣管氣道杯狀上皮細胞增生,黏液較多;與模型組相比,五虎湯低、中、高劑量組以及地塞米松組上述肺組織損傷情況均有所緩解。詳見圖2。
3.3.3? Masson染色觀察氣道膠原沉積情況? 正常組大鼠支氣管形態規則,管腔完整,無明顯氣道膠原沉積;與正常組相比,模型組大鼠氣道壁增厚,氣道膠原廣泛沉積;與模型組相比,五虎湯低、中、高劑量組以及地塞米松組上述肺組織損傷情況均有所緩解。詳見圖3。
3.4? 各組大鼠肺組織α-SMA、TGF-β1、MMP-9、TIMP-1蛋白表達比較
模型組α-SMA、TGF-β1、MMP-9、TIMP-1均顯著高于正常組(P<0.01);五虎湯低、中、高劑量組及地塞米松組α-SMA、TGF-β1、MMP-9、TIMP-1較模型組均顯著下降(P<0.01);五虎湯中、低劑量組α-SMA、TGF-β1及五虎湯低劑量組TIMP-1顯著高于地塞米松組(P<0.05,P<0.01);五虎湯中、高劑量組α-SMA、TIMP-1及五虎湯高劑量組TGF-β1低于五虎湯低劑量組(P<0.05、P<0.01);五虎湯高劑量組α-SMA、TGF-β1低于五虎湯中劑量組(P<0.05、P<0.01)。詳見表4、圖4。
3.5? 各組大鼠肺組織miRNA-146a及MMP-9 mRNA、TIMP-1 mRNA表達情況比較
模型組miRNA-146a、MMP-9 mRNA、TIMP-1 mRNA均顯著高于正常組(P<0.01);五虎湯低、中、高劑量組及地塞米松組miRNA-146a、MMP-9 mRNA、TIMP-1 mRNA均顯著低于模型組(P<0.01);五虎湯中、低劑量組miRNA-146a、MMP-9 mRNA、TIMP-1 mRNA均高于地塞米松組(P<0.01,P<0.05);五虎湯中、高劑量組miRNA-146a、MMP-9 mRNA、TIMP-1 mRNA均顯著低于五虎湯低劑量組(P<0.01);五虎湯高劑量組miRNA-146a、TIMP-1 mRNA低于五虎湯中劑量組(P<0.05)。詳見表5。
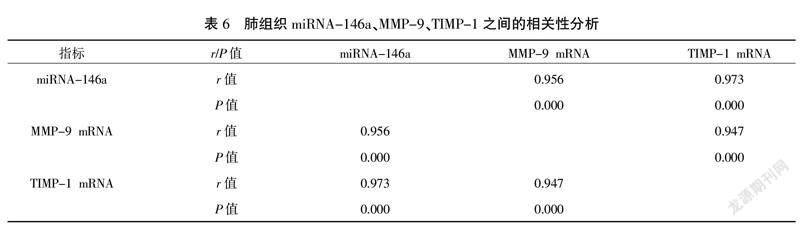
3.6? 肺組織miRNA-146a與MMP-9 mRNA、TIMP-1 mRNA相關性分析
大鼠肺組織miRNA-146a水平與MMP-9 mRNA、TIMP-1 mRNA均有極強、正相關性(r分別為0.956、0.973,P<0.01),MMP-9 mRNA與TIMP-1 mRNA呈極強、正相關性(r為0.947,P<0.01)。詳見表6。
4 討論
支氣管哮喘是兒科常見的慢性呼吸系統疾病之一,其發病機制復雜,病理改變主要表現為慢性氣道炎癥、氣道高反應性、氣道重塑等。氣道重塑主要表現為上皮下纖維化伴基底膜增厚、成纖維細胞和肌成纖維細胞聚集、纖維生長因子分泌增加、近端氣道上皮下細胞外基質沉積、氣道平滑肌增厚、杯狀細胞增生、血管再生等一系列復雜改變[10-11],是哮喘治療最為棘手的問題。古方五虎湯由麻黃、苦杏仁、生石膏、生甘草、細茶葉組成,具有清肺化痰、止咳平喘之效,本課題組前期研究已經證實,五虎湯可以有效緩解氣道重塑[5],但其具體機制尚未完全闡明。
本研究通過卵清白蛋白與氫氧化鋁佐劑的混合液五點注射致敏以及卵清白蛋白霧化以激發哮喘,成功建立幼齡大鼠哮喘模型,造模組氣道阻力升高,提示造模成功。治療后發現,五虎湯可有效降低大鼠氣道阻力。而肺組織病理學結果提示模型組氣管四周可見大量炎癥細胞浸潤,支氣管氣道杯狀上皮細胞增生,黏液較多,氣道壁增厚,氣道膠原廣泛沉積,而五虎湯各組及地塞米松組上述表現均明顯好轉,可見五虎湯可明顯改善哮喘小鼠的氣道重塑及氣道炎癥,減少黏液儲備。
既往研究表明,α-SMA是反映哮喘氣道平滑肌細胞數量的敏感指標,是哮喘早期氣道重塑的重要指標之一,能促進膠原的沉積及纖維化,還能誘導肺成纖維細胞聚集,導致細胞外基質過度沉積,加速氣道重塑的形成[12-13]。此外,TGF-β1能夠刺激支氣管哮喘患兒氣道平滑肌細胞增殖,誘導氣道細胞向纖維細胞轉化,促進細胞外基質合成及上皮膠原沉積,進一步促進哮喘氣道重塑[14-15]。本實驗研究表明,幼齡哮喘大鼠肺組織α-SMA、TGF-β1顯著上升,進一步說明了氣道重塑的形成,與上述研究結果一致,經過五虎湯干預后,α-SMA、TGF-β1值均明顯下降,進一步說明了五虎湯對氣道重塑有明顯的緩解作用。
miRNA是非蛋白質編碼的小分子RNA,長度約2125核糖核苷酸[16]。越來越多證據顯示,miRNA參與不同生物進程,包括細胞增殖、變異和凋亡[17]。哮喘作為一種多基因遺傳病,其發病機制至今仍未闡明[18]。而現有的研究顯示,miRNA對靶基因mRNA的調控作用在哮喘的發展和發病機制中起著重要作用[19]。miRNA-146a是哮喘患者肺組織中表達最明顯的一類miRNA,并在哮喘的發展過程中存在異常表達[7]。本研究結果顯示,模型組miRNA-146a表達顯著升高,這與汪成偉等[20]的研究結果一致。經過五虎湯干預后,miRNA-146a表達顯著降低,說明五虎湯治療哮喘的效應機制可能與調節miRNA-146a相關。
MMP-9是調節細胞外基質的主要限速酶,與TIMP-1共同維持著細胞外基質的正常生長和機體內環境的穩定[21]。MMP-9可以通過降解以Ⅳ型膠原為主的細胞外基質和血管中的膠原成分,誘導氣道平滑肌細胞增殖、分化、遷移至氣道壁和血管外,增加平滑肌肌層厚度和促進新生血管形成,引發氣道重塑[22]。TIMP-1通過與MMP-9發生特異性結合而抑制MMP-9的活性,阻礙細胞外基質的降解,使其在氣道內過度沉積而引起氣道壁增厚,進而導致氣道重塑[23]。因此,通過調控MMP-9和TIMP-1可以干預哮喘氣道重塑。高風麗等[24]證實,平喘顆粒可能通過抑制MMP-9和TIMP-1的表達來減輕哮喘小鼠肺組織病理學改變,改善氣道重塑。本研究結果顯示,模型組肺組織MMP-9和TIMP-1蛋白及其mRNA表達明顯上升,提示MMP-9、TIMP-1上升是氣道重塑的重要機制,經五虎湯干預后,MMP-9和TIMP-1蛋白及其mRNA表達顯著降低,提示五虎湯可通過降低MMP-9和TIMP-1有效改善氣道重塑。此外,相關性分析顯示,大鼠肺組織miRNA-146a水平與MMP-9 mRNA、TIMP-1 mRNA均有極強、正相關性,而miRNA對mRNA有靶向調控作用,因此,五虎湯可能通過miRNA-146a靶向調控MMP-9 mRNA、TIMP-1 mRNA影響氣道重塑的發生發展。
綜上所述,五虎湯能夠有效改善哮喘大鼠氣道重塑,這可能與五虎湯通過抑制miRNA-146a的表達,從而降低MMP-9、TIMP-1及其mRNA,以及減少α-SMA、TGF-β1相關。但本實驗尚有不足之處,未使用miRNA-146a抑制劑及激動劑進行干預,后續將繼續從細胞層次進一步對其進行深入研究。
參考文獻
[1] PAPI A, BRIGHTLING C, PEDERSEN S E, et al. Asthma[J]. Lancet, 2018, 391(10122): 783-800.
[2] MURRAY C S, JACKSON D J, TEAGUE W G. Prevention and outpatient treatment of asthma exacerbations in children[J]. Journal of Allergy and Clinical Immunology, 2021, 9(7): 2567-2576.
[3] CASTILLO J R, PETERS S P, BUSSE W W. Asthma exacerbations: Pathogenesis, prevention, and treatment[J]. Journal of Allergy and Clinical Immunology, 2017, 5(4): 918-927.
[4] 白詩瑤, 任? 媛, 李孟露, 等. 支氣管哮喘氣道血管再生與重塑的研究進展[J]. 國際呼吸雜志, 2020, 40(18): 1399-1404.
[5] 張? 鑫, 王孟清, 羅銀河, 等. RSV誘導哮喘小鼠樹突細胞自噬機制及五虎湯的干預作用[J]. 湖南中醫藥大學學報, 2021, 41(1): 39-45.
[6] SHARMA R, TIWARI A, MCGEACHIE M J. Recent miRNA research in asthma[J]. Current Allergy and Asthma Reports, 2022, 22(12): 231-258.
[7] STORLIE C B, BRANDA M E, GIONFRIDDO M R, et al. Prediction of individual outcomes for asthma sufferers[J]. Biostatistics, 2018, 19(4): 579-593.
[8] 何桂媛, 李文新, 王? 莉, 等. miR-146在支氣管哮喘發生發展中的研究進展[J]. 實用醫學雜志, 2018, 34(10): 1737-1739.
[9] 梁? 磊, 張宇婧, 李淑娣, 等. 搜風愈喘方抑制哮喘大鼠氣道重塑的作用機制研究[J]. 中藥新藥與臨床藥理, 2022, 33(1): 50-56.
[10] CAMORETTI-MERCADO B, LOCKEY R F. Airway smooth muscle pathophysiology in asthma[J]. Journal of Allergy and Clinical Immunology, 2021, 147(6): 1983-1995.
[11] BOULET L P. Airway remodeling in asthma: Update on mechanisms and therapeutic approaches[J]. Current Opinion in Pulmonary Medicine, 2018, 24(1): 56-62.
[12] 姚歡歡, 陳? 吉, 李? 嵐. 桔梗多糖對哮喘小鼠氣道炎癥和氣道重塑的影響[J]. 中國中醫藥科技, 2020, 27(5): 701-707.
[13] JEROME J A, WENZEL S E, TREJO BITTAR H E. Digital imaging analysis reveals reduced alveolar α-smooth muscle actin expression in severe asthma[J]. Applied Immunohistochemistry and Molecular Morphology, 2021, 29(7): 506-512.
[14] 沈王豐, 肖? 磊, 梁小紅, 等. “平喘湯”通過調控TGF-β1/Smad信號通路抑制哮喘大鼠氣道重塑機制研究[J]. 江蘇中醫藥, 2023, 55(1): 67-72.
[15] YUAN J, ZHANG W. Expression and significance of TGF-β1 in infant asthma model[J]. Cellular and Molecular Biology, 2022, 68(7): 51-55.
[16] BUSHATI N, COHEN S M. microRNA functions[J]. Annual Review of Cell and Developmental Biology, 2007, 23: 175-205.
[17] 郭慧葛, 孫四玉, 林? 飛, 等. circRNA/miRNA/mRNA的生物學功能及其對動脈粥樣硬化的影響[J]. 中國動脈硬化雜志, 2023, 31(1): 80-87.
[18] GOMEZ J L. Epigenetics in Asthma[J]. Current Allergy and Asthma Reports, 2019, 19(12): 56.
[19] LI J, PANGANIBAN R, KHO A T, et al. Circulating microRNAs and treatment response in childhood asthma[J]. American Journal of Respiratory and Critical Care Medicine, 2020, 202(1): 65-72.
[20] 汪成偉, 王? 飛, 李東濤, 等. miR-146a在哮喘患兒痰液的表達及對哮喘小鼠氣道炎癥的影響[J]. 解剖科學進展, 2017, 23(6): 583-586.
[21] 范改煥, 禹香菊, 趙憲文. 支氣管哮喘患兒血清IgE和痰液MMP-9、TNF-α表達關系及意義[J]. 實驗與檢驗醫學, 2019, 37(1): 82-84.
[22] BARBARO M P, SPANEVELLO A, PALLADINO G P, et al. Exhaled matrix metalloproteinase-9 (MMP-9) in different biological phenotypes of asthma[J]. European Journal of Internal Medicine, 2014, 25(1): 92-96.
[23] HE Q, LIU C, SHEN L, et al. Theory of the exterior-interior relationship between the lungs and the large intestine to explore the mechanism of Eriobotrya japonica leaf water extract in the treatment of cough variant asthma[J]. Journal of Ethnopharmacology, 2021, 281: 114482.
[24] 高風麗, 李竹英. 平喘顆粒對哮喘小鼠肺組織MMP-9和TIMP-1水平的影響[J]. 中國中醫急癥, 2021, 30(2): 230-232, 237.

