基于miR-378探討丹紅注射液干預壓力超負荷心力衰竭大鼠心肌纖維化機制
熊霞軍 胡思遠 鐘森杰 張倩 范星宇 胡志希


〔摘要〕 目的 探討丹紅注射液對壓力超負荷心力衰竭大鼠心肌纖維化的作用與機制。方法 取50只大鼠并對其行主動脈弓縮窄術(transverse aortic constriction, TAC),造模9周后將其隨機分為模型(TAC)組、丹紅注射液(DH)組(6.0 mL·kg-1)、卡托普利(Captopril)組(8.8 mg·kg-1),另設立10只為假手術(Sham)組。藥物干預15 d后對各組大鼠進行超聲心動圖檢測;酶聯免疫法測定血清氨基末端腦鈉肽前體(N-terminal pro brain natriuretic peptide, NT-pro BNP)含量;HE、Masson染色觀察心肌病理學及纖維化改變,Western blot檢測心肌組織中轉化生長因子β1(transforming growth factor-β1, TGF-β1)、Ⅰ型膠原蛋白(collagen-1, COL-1)、Ⅲ型膠原蛋白(collagen-3, COL-3)及α平滑肌肌動蛋白(α-smooth muscle actin, α-SMA)表達;qRT-PCR 檢測心肌組織中miR-378、TGF-β1 mRNA、Col-1 mRNA、Col-3 mRNA、ɑ-SMA mRNA表達。結果 與Sham組比較,TAC組左室射血分數(left ventricular ejection fraction, LVEF)和左室短軸縮短率(left ventricular fractional shortening, LVFS)、心肌組織miR-378下降,左室舒張末期內徑(left ventricular end diastolic dimension, LVEDD)、左室收縮末期內徑(left ventricular end systolic diameter, LVESD)、血漿NT-pro BNP、TGF-β1、COL-1、COL-3及α-SMA mRNA及蛋白表達升高,差異均有統計學意義(P<0.01);細胞排列紊亂,纖維化明顯。與TAC組比較,DH組LVEF、LVFS、心肌組織miR-378上升,LVEDD、LVESD、血漿NT-pro BNP、TGF-β1、COL-1、COL-3及α-SMA mRNA及蛋白表達下降,差異均有統計學意義(P<0.01);細胞排列趨于整齊,膠原纖維沉積減輕。結論 丹紅注射液能夠改善壓力超負荷心力衰竭大鼠心肌纖維化,其機制與調控miR-378/TGFβ-1信號通路表達有關。
〔關鍵詞〕 丹紅注射液;miR-378;心力衰竭;心肌纖維化;壓力超負荷;轉化生長因子β1
〔中圖分類號〕R256.2 ? ? ? 〔文獻標志碼〕A ? ? ? ?〔文章編號〕doi:10.3969/j.issn.1674-070X.2023.03.004
Mechanism of Danhong Injection on the myocardial fibrosis of heart failure
rats with stress overload based on miR-378
XIONG Xiajun1, HU Siyuan2, ZHONG Senjie2, ZHANG Qian2, FAN Xingyu2, HU Zhixi2*
1. Changsha Economic Development Zone Hospital, Changsha, Hunan 410019, China; 2. Hunan University of
Chinese Medicine, Changsha, Hunan 410208, China
〔Abstract〕 Objective To investigate the effect and mechanism of Danhong Injection(DHI) on myocardial fibrosis in heart failure rats with stress overload. Methods Fifty rats received transverse aortic constriction (TAC), and after 9 weeks of modeling, they were randomly divided into model (TAC) group, Danhong Injection (DHI) group (6.0 mL·kg-1), Captopril (8.8 mg·kg-1) group. And another 10 rats were set as the sham-operated group. After 15 days of intervention, echocardiogram detection was performed on rats in each group. Serum N-terminal pro brain natriuretic peptide (NT-pro BNP) content was determined by enzyme-linked immunoassay; myocardial pathology and fibrotic change was observed by HE and Masson staining; transforming growth factor-β1 (TGF-β1), collagen-1 (COL-1), collagen-3 (COL-3) and α smooth muscle act (α-SMA) expression of myocardial tissue was detected by Western blot; the expression of miR-378, TGF-β1 mRNA, Col-1 mRNA, Col-3 mRNA, and α-SMA mRNA of myocardial tissue was detected by qRT-PCR. Results Compared with the sham-operated group, the left ventricular ejection fraction (LVEF), the left ventricular fractional shortening rate (LVFS), and miR-378 of myocardial tissue in the TAC group decreased; the left ventricular end-diastolic diameter (LVEDD), the left ventricular end systolic diameter (LVESD), plasma NT-pro BNP, TGF-β1, COL-1, COL-3, α-SMA mRNA and protein expression were significantly higher (P<0.01); disordered arrangement of the cells and obvious fibrosis was shown. Compared with TAC group, the expression of LVEF, LVFS and miR-378 of myocardial tissue increased, and the LVEDD, LVESD, plasma NT-pro BNP, TGF-β1, COL-1, COL-3, α-SMA mRNA and protein expression decreased significantly in DHI group (P<0.01); cell arrangement tended to be neat, and the deposition of collagen fibers was reduced. Conclusion DHI can reduce myocardial fibrosis in heart failure rats with stress overload, and its mechanism is related to the expression regulation of miR-378/TGFβ-1 signaling pathway.
〔Keywords〕 Danhong Injection; miR-378; heart failure; myocardial fibrosis; stress overload; transforming growth factor β1
慢性心力衰竭(chronic heart failure, CHF)是指由心臟結構或功能異常,導致心室充盈或射血能力受損所致的一組復雜臨床綜合征,臨床表現為體循環淤血、肺循環淤血及各器官、組織灌注不足,是各種心血管疾病的終末階段[1]。CHF是全球性的心血管疾病,據統計,目前全世界心力衰竭患者近3770萬人,其中,我國心力衰竭患者約400萬人,預計到2030年全球心力衰竭患病率將增加25%,且相關的醫療支出預計將增加1倍以上[2-4]。目前,心力衰竭的治療取得一定進展,但發病率和死亡率(5年死亡率約50%)仍然很高,成為全球公共衛生的一大難題[5]。心臟重構是心力衰竭的主要病理特征。心肌纖維化是心臟重構重要的形態改變,兩者在心力衰竭的發生發展中起主要作用,影響疾病的向愈和向逆。因此,抑制心肌纖維化是防治CHF的關鍵環節。
MicroRNA屬于短鏈非編碼RNA,常作為細胞內介質參與轉錄后基因調控[6]。研究證實,MicroRNA在人類和鼠類的血流動力學壓力過載中異常表達,是調節心臟重構和纖維化的關鍵成分[7-9]。MicroRNA-378(miR-378)在心臟組織中高表達,具有改善心肌缺血、抑制心肌肥厚、改善心肌纖維化等作用。心肌纖維化歸屬于中醫學“心悸”“胸痹”等范疇,病機為本虛標實、久病入絡,本虛為陽氣虧虛,標實為痰濁、瘀血。其中血瘀是心肌纖維化病變過程中的重要病機和病理產物。因此,活血化瘀法日益受到重視[10]。本課題組前期基于“以方測證”法證實主動脈弓縮窄術(transverse aortic constriction, TAC)心力衰竭大鼠為心血瘀阻證,活血化瘀代表藥物丹紅注射液能夠顯著改善TAC心力衰竭大鼠心肌纖維化[11]。因此,本研究從miR-378探討壓力超負荷心力衰竭心血瘀阻證心肌纖維化機制及丹紅注射液干預作用,為臨床防治心力衰竭提供實驗指導。
1 材料
1.1 ?實驗動物
SD大鼠購自湖南斯萊克景達實驗動物有限公司,共60只,雄性,6周齡,體質量(210±10) g,合格證號:SCXK(湘)2019-0004,飼養于湖南中醫藥大學實驗動物中心SPF級實驗室。研究方案經湖南中醫藥大學實驗動物倫理委員會批準,批準號LL2021011302。
1.2 ?主要儀器及藥物
SonoScape-S2N型超聲診斷儀(深圳開立科技公司),MB-530 型酶標儀(深圳匯松科技發展公司),RWD407型呼吸機(深圳瑞沃德生命科技公司),DYY-6C型電泳儀(北京六一生物科技有限公司),DYCZ-40D型轉膜儀(北京六一生物科技有限公司)。氨基末端腦鈉肽前體(N-terminal pro brain
natriuretic peptide, NT-pro BNP)試劑盒(武漢華美生物工程有限公司,批號:G28032936)。一抗轉化生長因子β1(transforming growth factor-β1, TGF-β1)、Ⅰ型膠原蛋白(collagen-1, COL-1)、Ⅲ型膠原蛋白(collagen-3, COL-3)、α平滑肌肌動蛋白(α-smooth muscle actin, ɑ-SMA)、二抗HRP goat anti-mouse IgG均購自美國proteintech,貨號分別為21898-1-AP、67288-1-Ig、22734-1-AP、14395-1-AP、SA00001-1。丹紅注射液(山東丹紅制藥有限公司,規格20 mL/支,批號:20112012),卡托普利片(重慶科瑞制藥集團有限公司,規格25 mg/片,批號:641003),注射用青霉素鈉(山東魯抗醫藥有限公司,規格0.48 g/瓶,批號:43200909)。
2 方法
2.1 ?模型制備
SPF級實驗室適應性喂養大鼠7 d后隨機將大鼠分為假手術(Sham)組10 只和造模組50只。TAC模型的制備參照文獻[11],先稱取大鼠體質量,采用10%水合氯醛以3.5 mL·kg-1腹腔注射麻醉大鼠,仰臥位固定大鼠四肢及頭部于恒溫臺,前胸部及頸部脫毛處理后消毒備皮。沿頸部正中線切開表皮再鈍性分離頸部結締組織及氣管兩側肌肉,暴露氣管后行氣管插管并機械通氣。于左側第2、第3肋間隙作橫向切口鈍性分離開胸,分離胸腺以充分暴露主動脈胸段。采用4-0號手術線穿過左頸總動脈與無名動脈間,并提起主動脈弓,縮窄墊針緊貼主動脈弓進行結扎,經游標卡尺測量,縮窄率為60%~65%,結扎完成后抽出墊針。逐層縫合肋間隙、肌肉及表皮,并用聚維酮碘消毒,待大鼠恢復自主呼吸后予以脫機。Sham組主動脈弓只穿線不結扎,余步驟與TAC制備保持一致。兩組術后連續3 d肌內注射青霉素鈉20萬U。
2.2 ?心力衰竭模型評價方法
術后第9周,麻醉大鼠行超聲心動圖檢測大鼠心臟左室射血分數(left ventricular ejection fraction, LVEF)、左室短軸縮短率(left ventricular fractional shortening, LVFS)、左室舒張末期內徑(left ventricular end diastolic dimension, LVEDD)、左室收縮末期內徑(left ventricular end systolic diameter, LVESD),眼眶取血檢測NT-pro BNP含量。與Sham組比,TAC組LVEF、LVFS顯著降低,LVEDD、LVESD顯著上升,血清NT-pro BNP顯著增高視為心力衰竭,模型復制成功。
2.3 ?分組與給藥
成模大鼠按隨機數字表法分為模型(TAC)組、丹紅注射液(DH)組和卡托普利(Captopril)組。大鼠給藥時間均為15 d。給藥劑量[11]:(1)DH組腹腔注射,單次劑量 6.0 mL·kg-1,并按 4.0 mL·kg-1灌胃生理鹽水;(2)Captopril組:卡托普利片溶于生理鹽水中,按8.8 mg·kg-1劑量灌胃,并按 6.0 mL·kg-1腹腔注射滅菌注射用水;(3)Sham組、TAC組:按4.0 mL·kg-1灌胃生理鹽水,按6.0 mL·kg-1腹腔注射滅菌注射用水。
2.4 ?標本采集與處理
藥物連續干預15天后,對大鼠再次行治療后超聲心動圖檢測及血清、心肌組織樣本采集。大鼠經水合氯醛麻醉固定后,打開腹腔,用棉球小心分離腸道及黏膜組織,暴露腹主動脈,行腹主動脈取血,取血時針尖缺口朝下,每只取血約 5 mL,離心后(3 000 r·min-1,離心半徑 12 cm,時間15 min)每組選取6個樣本,每樣本取200 μL,后續采用ELISA法檢測NT-pro BNP含量。取血完畢開胸小心剪取完整心臟,輕輕擠掉心臟內血液再經PBS洗凈殘存血液,濾紙吸干后選取心尖部位剪取約200 mg左心室組織,裝入預先標記編號好的凍存管,并立即放于液氮低溫保存,用于后續Western blot及qRT-PCR相關檢測,上述操作均于低溫冰塊上進行;剩余組織用4%多聚甲醛溶液固定,后續用于HE染色和Masson染色,采用Image J軟件進行蛋白灰度分析。
2.5 ?qRT-PCR法檢測心肌組織中miR-378、TGF-β1等相關指標
取0.25 mg心肌組織,加入1 mL Trizol,充分研磨,混勻室裂解5 min,提取總RNA。以組織總mRNA為模板,逆轉錄cDNA(反應體系dNTP Mix 4 μL、Primer Mix 2 μL、RNA Template 7 μL、5×RT Buffer 4 μL、DTT 2 μL、HiFiScript 1 μL),42 ℃孵育15 min,85 ℃ 孵育 5 min 。其中miRNA反轉錄如下:根據所需用RNA的量,按ATP稀釋系數=5000/(RNA起始量),加1 mmoL Tris(pH 8.0)去稀釋10 mmoL ATP,加入反應體系(總共RNA 3 μL、10×Poly(A) Polymerase Buffer1×2 μL、稀釋后的ATP 0.8 μL、E.coli Poly(A) Polymerase(5U/μL)0.4 μL、RNase-Free Water 11.8 μL,總量20 μL),37 ℃的條件下孵育15 min。
修飾后的miRNA cDNA第一鏈合成的過程:加入反應體系[Poly(A)反應液4 μL、超純dNTPs(10 mmoL each) 1 μL、25 μmoL RT primer 3 μL、5×RT Buffer 4 μL、SuperRT Reverse Transcriptase 0.5 μL、RNase-Free Water 7.5 μL],在反應體系中50 ℃及85 ℃條件下分別孵育50 min和5 min。各引物序列詳見表1。
以上述表格中所列基因序列實時定量PCR,按照預先配制好的擴增液進行定量擴增。詳見表2。95 ℃中預變性10 min,95 ℃ 15 s、60 ℃ 30 s,重復擴增40個循環。收集每循環第3個步驟熒光信號量,反應結束后讀取Ct值,△Ct=目的基因Ct值-內參基因Ct值,-ΔΔCt=對照組ΔCt-各樣品ΔCt,2-ΔΔCt反映各樣品相對于對照組樣品目的基因的表達水平,重復3次取均值進行統計分析。
2.6 ?Western blot檢測蛋白表達
稱取約25 mg心肌組織置于200 bp RIPA裂解液反復研磨并置于冰上裂解10 min,4 ℃ 12 000 r·min-1離心15 min(離心半徑7 cm),吸取上清液分裝保存,參照BCA試劑盒說明書測定蛋白濃度。然后電泳、轉膜、封閉、一抗孵育,用1×TBST將一抗按照一定比例稀釋,TGF-β1(1∶1000)、COL-1(1∶5000)、COL-3(1∶500)、α-SMA(1∶1000),GAPDH(1∶3000)。將封閉后的膜與一抗放于孵育盒,置于4 ℃冰箱放置12 h,再在室溫(25 ℃)靜置1 h,孵育結束后,回收一抗,然后將孵育盒置于搖床上用1×TBST洗滌15 min,重復3次。洗滌結束后,將預先稀釋好的二抗與膜置于搖床上室溫下孵育90 min。孵育結束后將孵育盒置于搖床用1×TBST 洗滌15 min,重復3次。現配現用ECL化學發光液,將膜平鋪在顯影儀,吸取發光液均勻滴在膜上,反應約1 min,然后將膜旁邊多余的發光液用濾紙吸干,關上顯影儀在暗盒內顯色曝光約8 min。曝光完成后選取最佳圖片,數據分析采用Image J軟件。
2.7 ?統計學分析
數據分析采用 SPSS 25.0軟件處理,計量資料數據采用“x±s”表示,兩組間實驗數據比較采用獨立樣本t檢驗,多組間比較采用單因素方差分析法,事后多重比較采用LSD法;若數據不滿足正態分布或方差不齊,則采用非參數檢驗(Kruskal-Wallis H),以P<0.05為差異有統計學意義。
3 結果
3.1 ?大鼠成活情況
大鼠主動脈弓手術操作過程中共死亡12只,經解剖發現其死亡原因涉及主動脈弓結扎過緊導致的急性左心衰、抽取縮窄針致主動脈弓破裂、縱隔胸膜破裂致氣胸及肺部損傷等因素;后續成模階段共死亡老鼠9只,其死亡原因涉及呼吸障礙、心力衰竭。最終TAC組剩余29只,按照隨機數字表法分為TAC組10只,DH組10只,Captopril組9只;Sham組因開胸導致縱隔胸膜破裂死亡1只,剩余9只。
3.2 ?各組超聲心動圖結果
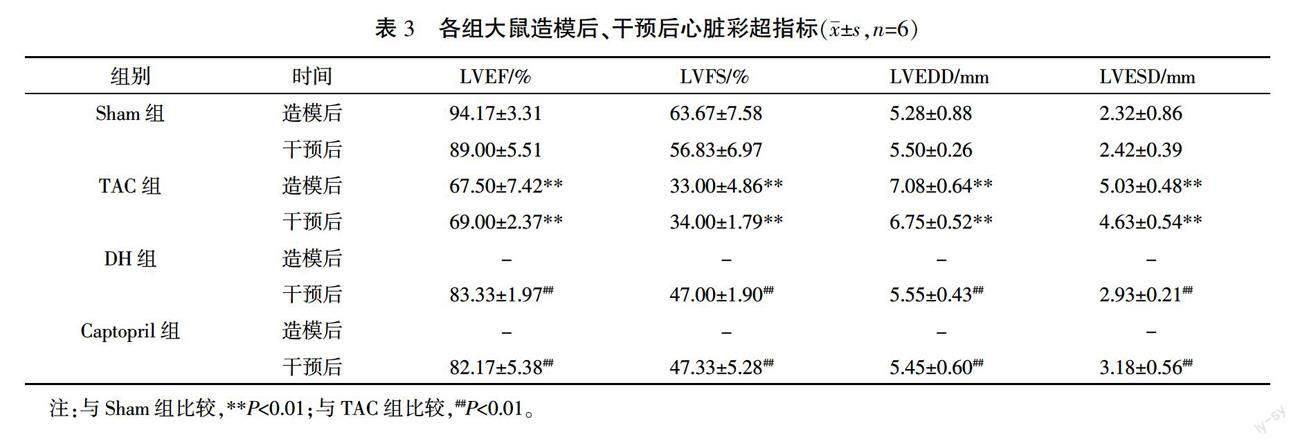
造模9周后,與Sham組比較,TAC組LVEF和LVFS顯著下降(P<0.01),LVEDD和LVESD顯著升高(P<0.01)。藥物干預15天后,與Sham組比較,TAC組LVEF和LVFS顯著下降(P<0.01),LVEDD和LVESD顯著上升(P<0.01);與TAC組比較,DH組和Captopril組LVEF和LVFS顯著上升(P<0.01),LVEDD和LVESD明顯下降(P<0.01)。詳見表 3。
3.3 ?各組血清NT-pro BNP結果
壓力超負荷造模9周后,與Sham組比較,TAC組NT-pro BNP顯著升高(P<0.01)。藥物干預15天后,與Sham組比較,TAC組NT-pro BNP顯著升高(P<0.01);與TAC組比較,DH組、Captopril組NT-pro BNP顯著下降(P<0.01)。詳見表4。
3.4 ?HE染色結果
光鏡下觀察HE染色,Sham組細胞排列整齊、輪廓清晰,閏盤、橫紋清晰可見,細胞核大小形態正常;TAC組細胞排列明顯紊亂不齊,細胞間隙明顯增寬,部分細胞出現水腫并伴細胞核消失及凝固性壞死;DH組及Captopril組心肌細胞排列趨于整齊,細胞結構較為完整,未見明顯細胞水腫及壞死。詳見圖1。
3.5 ?Masson染色結果
光鏡下觀察Masson染色,與Sham組比較,TAC組肌纖維排列紊亂,其間可見明顯膠原纖維沉積;與TAC組比較,DH組及Captopril組藍染膠原纖維明顯減少。詳見圖2。
3.6 ?各組大鼠干預后纖維化相關蛋白表達量
各組干預15天后,與Sham組比較,TAC組心肌組織中TGF-β1、α-SMA、COL-1、COL-3蛋白均顯著升高(P<0.01);與TAC組比較,DH組、Captopril組心肌組織中TGF-β1蛋白、α-SMA蛋白、COL-1蛋白、COL-3蛋白均顯著下降(P<0.01)。詳見表5,圖3。
3.7 ?各組大鼠干預后纖維化因子相對表達量
各組干預15天后,與Sham組比較,TAC組心肌組織中miR-378表達顯著下降(P<0.01),TGF-β1、α-SMA、COL-1、COL-3 mRNA表達顯著升高(P<0.01);與TAC組比較,DH組、Captopril組心肌組織中miR-378表達顯著升高(P<0.01),TGF-β1、α-SMA、COL-1、COL-3 mRNA表達顯著下降(P<0.01)。詳見表6。
4 討論
心力衰竭歸屬于中醫學“心脹”“心痹”“心水”等范疇。心力衰竭病機為本虛標實,本虛為氣虛、氣陰兩虛、陽虛,標實為痰飲、瘀血及水飲。正如《素問·水熱穴論》所言:“水病,下為胕腫大腹,上為喘呼不得臥者,標本俱病。”后世醫家認為“瘀血”為心力衰竭關鍵病機[12],如清代醫家王清任、唐容川等認為“血管無氣,必停而為瘀”,“血積既久,其水乃成”,“瘀血化水,亦發水腫”。現代醫家多認為血瘀既是病機又是病理產物,貫穿心力衰竭發展始終。如《慢性心力衰竭中醫診療專家共識》[13]及《慢性心力衰竭中西醫結合診療專家共識》[14]認為血瘀是心力衰竭關鍵病機,心血瘀阻是其中心環節。中醫古籍中并無心肌纖維化相關記載,基于絡病學說心肌纖維化可歸屬“絡病”范疇[15],正如《醫林改錯》記載:“久病入絡為瘀。”瘀血是心肌纖維化關鍵病理機制,活血化瘀是其關鍵治則,現代研究同樣證實活血化瘀法能夠顯著改善心肌纖維化及心室重構[16-17]。
TAC是在模擬主動脈瓣狹窄基礎上,造成左室后負荷增加,持續的壓力負荷造成左室失代償及心肌纖維化,最早由ROCKMAN研制用來研究心室重構[18]。本研究在造模第9周后對兩組大鼠眼眶取血,Elisa檢測大鼠血清NT-pro BNP值;并進行超聲心動圖檢查。結果表明:與Sham組比較,TAC組NT-pro BNP、LVESD、LVEDD值升高,LVEF、LVFS顯著降低。LVEF是評價心功能重要指標。心力衰竭根據LVEF分為三類[19]:射血分數降低的心力衰竭、射血分數中間值的心力衰竭、射血分數保留的心力衰竭。但臨床在診斷心力衰竭時,此項指標存在一定主觀性,故往往需借助NT-pro BNP值對心力衰竭做出準確判斷。NT-pro BNP由左心室心肌分泌,生物變異率低、代謝周期較長,在血漿中較為穩定[20],各大指南均將NT-pro BNP作為心力衰竭診斷的重要標記物[21-22]。本研究結果提示TAC組LVEF、LVFS下降,LVESD、LVEDD增大,NT-pro BNP增高,說明主動脈弓縮窄致心力衰竭模型復制成功,與相關實驗研究基本一致[23]。
纖維化可影響各器官,纖維化正成為全球醫療負擔[24]。心肌纖維化是心室重構重要因素,是心力衰竭發生發展的關鍵因素,抗纖維化治療是目前研究的熱點及難點。中醫藥治療纖維化療效顯著,在TAC大鼠心力衰竭模型中,丁超[25]、顧燕頻[26]、陳仁山[27]等證實活血法在治療心肌纖維化療效顯著。基于此,本研究采用丹紅注射液干預TAC大鼠心力衰竭模型。
miRNA在心力衰竭的發病機制中起著重要作用,能夠調節適應性和不適應性心室重構過程的基因表達水平[28]。miR-378是心肌纖維化調控因子之一,在壓力超負荷心力衰竭模型中,上調miR-378可以改善心室重構及心功能[29]。LIU等[30]在TAC大鼠模型中研究發現,miR-378通過抑制MAPK的磷酸化而減輕心肌纖維化。本研究結果發現,與Sham組相比,TAC組心肌纖維化更為明顯,心肌組織中miR-378顯著下調;與TAC組相比,DH組心肌纖維化改善明顯,心肌組織中miR-378顯著上調,miR-378可能是丹紅注射液治療心肌纖維化的可能機制及潛在靶點。
心肌纖維化根據病理特點分為修復性纖維化、間質纖維化和血管周圍纖維化[31]。在壓力負荷心力衰竭中常發生間質纖維化[32]。細胞外基質(extracellular matrix, ECM)過度積累是纖維化主要病理表現,正常心臟組織中膠原蛋白生成、降解處于動態平衡;壓力負荷等刺激可打破此平衡,造成膠原生成過度及比例失衡,最終導致間質纖維化,心功能失代償。心臟ECM主要由Ⅰ型和Ⅲ型原纖維膠原組成。Ⅰ型和Ⅲ型原纖維膠原是構成細胞外骨架的主要結構蛋白。在正常心臟中,Ⅰ型膠原約占總心肌膠原的85%,負責構建賦予其抗拉強度的厚纖維。Ⅲ型膠原蛋白占總膠原蛋白的11%,負責基質網絡的彈性[33]。α-SMA是心臟成纖維細胞活化為肌成纖維細胞標志物[34],活化的肌成纖維細胞可大量分泌膠原蛋白促進心肌纖維化。TGF-β1是心臟成纖維細胞活化的關鍵因子,故抑制TGF-β1是改善心肌纖維化的關鍵所在。本次實驗結果顯示:與Sham組相比,TAC組TGF-β1、膠原蛋白Ⅰ、膠原蛋白Ⅲ及α-SMA mRNA及蛋白均顯著增高;與TAC組相比,DH組TGF-β1、膠原蛋白Ⅰ、膠原蛋白Ⅲ及α-SMA mRNA及蛋白均顯著下調。從以上結果可知miR-378與TGF-β1呈負相關,即TAC組miR-378顯著下調,TGF-β1明顯上調,DH組miR-378顯著上調,TGF-β1卻明顯下調,故推測丹紅注射液能夠上調心肌組織中miR-378水平,抑制TGF-β1表達,從而改善心肌纖維化。
綜上所述,本研究通過主動脈弓縮窄誘導壓力超負荷心力衰竭大鼠模型,研究丹紅注射液對心力衰竭大鼠心肌纖維化的改善機制。實驗結果表明,丹紅注射液能夠下調心肌組織中膠原蛋白Ⅰ、膠原蛋白Ⅲ及α-SMA蛋白,改善心肌纖維化,其作用機制可能與提高心肌組織中miR-378表達,下調TGF-β1有關。心臟成纖維細胞活化是心肌纖維化的主要機制,相關研究表明miR-378在心肌細胞中大量表達,在心臟成纖維細胞中不表達,丹紅注射液是否與提高心肌細胞中miR-378表達,后通過某種機制再調控心臟成纖維細胞,從而改善纖維化,有待深入研究。
參考文獻
[1] METRA M, TEERLINK J R. Heart failure[J]. The Lancet, 2017, 390(10106): 1981-1995.
[2] HEIDENREICH P A, ALBERT N M, ALLEN L A, et al. Forecasting the impact of heart failure in the United States: A policy statement from the American Heart Association[J]. Circulation Heart Failure, 2013, 6(3): 606-619.
[3] WRITING GROUP MEMBERS, LLOYD-JONES D, ADAMS R J, et al. Heart disease and stroke statistics: 2010 update: A report from the American Heart Association[J]. Circulation, 2010, 121(7): e46-e215.
[4] ZIAEIAN B, FONAROW G C. Epidemiology and aetiology of heart failure[J]. Nature Reviews Cardiology, 2016, 13(6): 368-378.
[5] ZARRINKOUB R, WETTERMARK B, WANDELL P, et al. The epidemiology of heart failure, based on data for 2.1 million inhabitants in Sweden[J]. European Journal of Heart Failure, 2013, 15(9): 995-1002.
[6] WANG H J, CAI J. The role of microRNAs in heart failure[J]. Biochimica et Biophysica Acta Molecular Basis of Disease, 2017, 1863(8): 2019-2030.
[7] VERJANS R, PETERS T, BEAUMONT F J, et al. MicroRNA-221/222 family counteracts myocardial fibrosis in pressure overload-induced heart failure[J]. Hypertension (Dallas, Tex: 1979), 2018, 71(2): 280-288.
[8] ZHANG J C, LANG Y, GUO L H, et al. MicroRNA-323a-3p promotes pressure overload-induced cardiac fibrosis by targeting TIMP3[J]. Cellular Physiology and Biochemistry, 2018, 50(6): 2176-2187.
[9] GARC?魱A R, SALIDO-MEDINA A B, GIL A, et al. Sex-specific regulation of miR-29b in the myocardium under pressure overload is associated with differential molecular, structural and functional remodeling patterns in mice and patients with aortic Stenosis[J]. Cells, 2020, 9(4): 833.
[10] 吳美芳,呂仕超,張軍平.心肌纖維化中醫診療思路探析[J].時珍國醫國藥,2015,26(3):677-679.
[11] 鐘森杰,熊霞軍,張 ?倩,等.基于“方證對應”理論探討主動脈弓縮窄致心力衰竭大鼠模型的中醫證型與代謝標志物[J].中國實驗方劑學雜志,2022,28(16):130-139.
[12] 張伯禮,吳勉華,林子強.中醫內科學[M].北京:中國中醫藥出版社,2019.
[13] 冠心病中醫臨床研究聯盟,中國中西醫結合學會心血管疾病專業委員會,中華中醫藥學會心病分會,等.慢性心力衰竭中醫診療專家共識[J].中醫雜志,2014,55(14):1258-1260.
[14] 中國中西醫結合學會心血管疾病專業委員會,中國醫師協會中西醫結合醫師分會心血管病學專家委員會.慢性心力衰竭中西醫結合診療專家共識[J].中國中西醫結合雜志,2016,36(2):133-141.
[15] 鄭 ?鈺,劉 ?創,龐立健,等.基于絡病理論防治多器官纖維化異病同治芻議[J].時珍國醫國藥,2018,29(5):1175-1177.
[16] 張蓓蓓,蔡 ?輝.丹參酮ⅡA對心室重構作用的研究進展[J].安徽醫藥,2014,18(12):2230-2233.
[17] 任雪萍,許姝雯,曹程浩,等.抗纖益心方通過調控miR-125b-5p抑制擴張型心肌病心肌纖維化的研究[J].時珍國醫國藥,2021,32(9):2109-2113.
[18] ROCKMAN H A, ROSS R S, HARRIS A N, et al. Segregation of atrial-specific and inducible expression of an atrial natriuretic factor transgene in an in vivo murine model of cardiac hypertrophy[J]. Proceedings of the National Academy of Sciences of the United States of America, 1991, 88(18): 8277-8281.
[19] 中華醫學會心血管病學分會心力衰竭學組,中國醫師協會心力衰竭專業委員會,中華心血管病雜志編輯委員會.中國心力衰竭診斷和治療指南2018[J].中華心血管病雜志,2018,46(10):760-789.
[20] 吳藍津,吳萬芬,陸山河.NT-proBNP在心力衰竭中應用的研究進展[J].心血管康復醫學雜志,2018,27(1):114-117.
[21] YANCY C W, JESSUP M, BOZKURT B, et al. 2017 ACC/AHA/HFSA focused update of the 2013 ACCF/AHA guideline for the management of heart failure: A report of the American college of cardiology/American heart association task force on clinical practice guidelines and the heart failure society of America[J]. Journal of Cardiac Failure, 2017, 23(8): 628-651.
[22] PONIKOWSKI P, VOORS A A, ANKER S D, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) Developed with the special contribution of the Heart Failure Association (HFA) of the ESC[J]. European Heart Journal, 2016, 37(27): 2129-2200.
[23] 張瑋瑋.血管緊張素Ⅱ通過AT1R/StAR/AS/醛固酮信號通路參與調節心肌肥厚和心臟纖維化[D].太原:山西醫科大學,2018.
[24] HENDERSON N C, RIEDER F, WYNN T A. Fibrosis: From mechanisms to medicines[J]. Nature, 2020, 587(7835): 555-566.
[25] 丁 ?超,謝利平,李榮成.丹酚酸A對壓力超負荷大鼠心功能減退和心室重構的改善作用[J].南京醫科大學學報(自然科學版),2014,34(1):12-17.
[26] 顧燕頻,章 ?忱,郭 ?煒,等.益氣活血方對壓力超負荷致大鼠心肌肥厚的影響[J].中華中醫藥學刊,2015,33(1):64-66,5.
[27] 陳仁山.丹酚酸B對壓力過負荷致小鼠心力衰竭的保護作用及機制研究[D].廣州:廣州中醫藥大學,2016.
[28] 劉素曉,王幼平,謝世陽.MicroRNA在心血管系統發育和疾病中作用的研究進展[J].中西醫結合心腦血管病雜志,2019,17(12):1819-1822.
[29] GANESAN J, RAMANUJAM D, SASSI Y, et al. MiR-378 controls cardiac hypertrophy by combined repression of mitogen-activated protein kinase pathway factors[J]. Circulation, 2013, 127(21): 2097-2106.
[30] LIU W Y, SUN H H, SUN P F. MicroRNA-378 attenuates myocardial fibrosis by inhibiting MAPK/ERK pathway[J]. European Review for Medical and Pharmacological Sciences, 2019, 23(10): 4398-4405.
[31] 邱羽菲,史嘉翊,宋旭東,等.心肌纖維化的發生機制及治療研究進展[J].心臟雜志,2021,33(5):553-557.
[32] D?魱EZ J, GONZ?魣LEZ A, KOVACIC J C. Myocardial interstitial fibrosis in nonischemic heart disease, part 3/4: JACC focus seminar[J]. Journal of the American College of Cardiology, 2020, 75(17): 2204-2218.
[33] 孫帥鋒,劉 ?巍.心肌纖維化病理機制及診療策略進展[J].國際心血管病雜志,2020,47(5):264-267.
[34] LI L, ZHAO Q, KONG W. Extracellular matrix remodeling and cardiac fibrosis[J]. Matrix Biol, 2018, 68/69: 490-506.
〔收稿日期〕2023-03-04
〔基金項目〕國家自然科學基金項目(81774208,82274412);湖南省自然科學基金項目(2019JJ50447);廣東省重點領域研發項目(2020B1111100001);湖南省中醫藥科研計劃項目青年課題(2021180)。
〔第一作者〕熊霞軍,男,碩士研究生,主治醫師,研究方向:心血管疾病證本質與診治規律。
〔通信作者〕*胡志希,男,教授,博士研究生導師,E-mail:515800272@qq.com。

