竇性心律下右室流出道特發性室性心律失常消融靶點電位特征
陳哲慧, 梁 明, 劉 婧, 張 萍, 丁 建, 金志清, 孫鳴宇, 韓雅玲, 王祖祿
1.中國醫科大學北部戰區總醫院研究生培養基地,遼寧 沈陽 110016; 2.北部戰區總醫院 心血管內科,遼寧 沈陽 110016
右室流出道(right ventricular outflow tract,RVOT)是特發性室性心律失常(ventricular arrhythmias,VAs)常見的起源部位[1]。射頻導管消融是治療局灶性致心律失常病灶的一種有效、安全的方法。目前,激動標測、起搏標測及基質標測均為標測VAs的基本方法。但是,當術中VAs難以誘發或不穩定發作時,激動標測的效率會降低;當病灶位于心肌深處或存在優勢傳導通路時,起搏標測的準確性也會降低[2]。上述標測方法的局限性使導管消融的難度增大。RVOT-VAs可能與不同程度的心肌基質異常相關。在竇性心律期間,通過標測導管識別異常基質是尋找心律失常起源點的合理方法,且已有研究報道了特殊電位與有效靶點間的關系[3-4]。本研究旨在探討竇性心律下RVOT-VAs有效消融靶點的腔內雙極電圖特征,進而提高手術效率。現報道如下。
1 對象與方法
1.1 研究對象 回顧性分析自2021年1月至2022年8月于北部戰區總醫院行電生理檢查及射頻導管消融術的132例RVOT-VAs患者(134種VAs)的臨床資料。納入標準:頻發VAs(發生次數>10 000次/24 h或超過總心搏數20%)或持續性室性心動過速(ventricular tachycardia,VT);抗心律失常藥物治療無效或無法耐受藥物治療;術前常規12導聯心電圖提示VAs為流出道起源。排除標準:超聲心動圖等檢查顯示結構性心臟病;合并嚴重心、腦、肺、腎等重要器官功能障礙。其中,男性41例,女性91例;平均年齡(48.63±12.58)歲;平均病程23.57(1.00,36.00)個月;術前室性心律負荷(24%±9%);合并非持續性VT 7例,高血壓27例,冠心病3例,糖尿病9例;兩種流出道不同位置起源的VAs患者2例。術前停用抗心律失常藥物至少5個半衰期,簽署知情同意書后進行手術。
1.2 電生理檢查及射頻導管消融 常規穿刺右側股靜脈并留置8.5 F SWZ-SL1長鞘,經此送入冷鹽水灌注導管至RVOT。術中VAs較少時,靜脈滴注異丙腎上腺素或心室遞增起搏進行誘發。在Carto-3三維電解剖標測系統的指導下結合X線、心內電圖進行標測。
根據有效靶點位置將其分為左竇及對應區域(left cusp and corresponding area,LC-CA)組(n=81)、右竇及對應區域(right cusp and corresponding area,RC-CA)組(n=30)、前竇及對應區域(anterior cusp and corresponding area,AC-CA)組(n=23)。每組包括肺動脈竇(pulmonary sinus cusp,PSC)和各PSC所對應的瓣上(肺動脈內)及瓣下(RVOT內)區域。有效靶點定義:ABL導管雙極標測到領先于體表QRS波起始的局部近場心室電位;ABL導管單極標測到心室電位提前且呈QS型;局部起搏標測≥11個導聯與自身VAs形態相同;溫度達標放電30 s內室性早搏消失或VT終止,或放電過程中出現與自身VAs形態相同的室性自主心律并很快消失。射頻導管消融常規采用溫控非鹽水模式,預設溫度上限為55℃,功率30~40 W。若溫度達標后放電30 s后室性早搏仍未消失或VT不能終止則重新標測;若為有效靶點,則鞏固放電至90~120 s,并在鄰近區域補充消融。消融即刻成功定義:觀察20 min,靜脈滴注異丙腎上腺素或程序電刺激誘發后無室性早搏出現、無VT發作。
1.3 腔內圖分析及定義 使用電生理儀對消融導管穩定后記錄的腔內雙極電圖進行分析,主要分析VAs消失前末次放電的圖形,走速設置為100 mm/s或150 mm/s,增益設置為40倍,記錄VAs聯律間期、靶點處V波距提前QRS波起始值(V-QRS)、起搏標測比例、瓣上消融比例、消融時間、透視時間等。
竇性心律下延遲電位定義為腔內雙極電圖上延遲于V1導聯S波最低點的電位。根據有效靶點處腔內雙極電圖形態特征,將竇性心律下電位分為5種類型:(1)延遲低幅單電位,延遲的振幅<0.5 mV的單電位;(2)延遲高幅尖峰電位,延遲的高峰釘狀電位;(3)延遲碎裂電位,延遲的多峰(至少2個峰)碎裂電位;(4)延遲混合電位,延遲的電位內包含2種或3種上述電位;(5)無特征電位,無延遲電位的心室電位。見圖1~2。若患者竇性心律下存在右束支傳導阻滯,則以V6導聯QRS波后等電線與S波下降支的交點的垂線為參考線定義延遲電位。若存在延遲電位(上述電位類型的前4種類型),測量延遲電位的振幅及延遲于參考線的時間。根據電位類型將其分為延遲電位組(n=96)與無特征電位組(n=38)。比較兩組瓣上消融比例、竇性心律雙極電壓、V-QRS、消融時間、透視時間、即刻成功率、隨訪中延遲成功率、隨訪復發率、長期成功率。
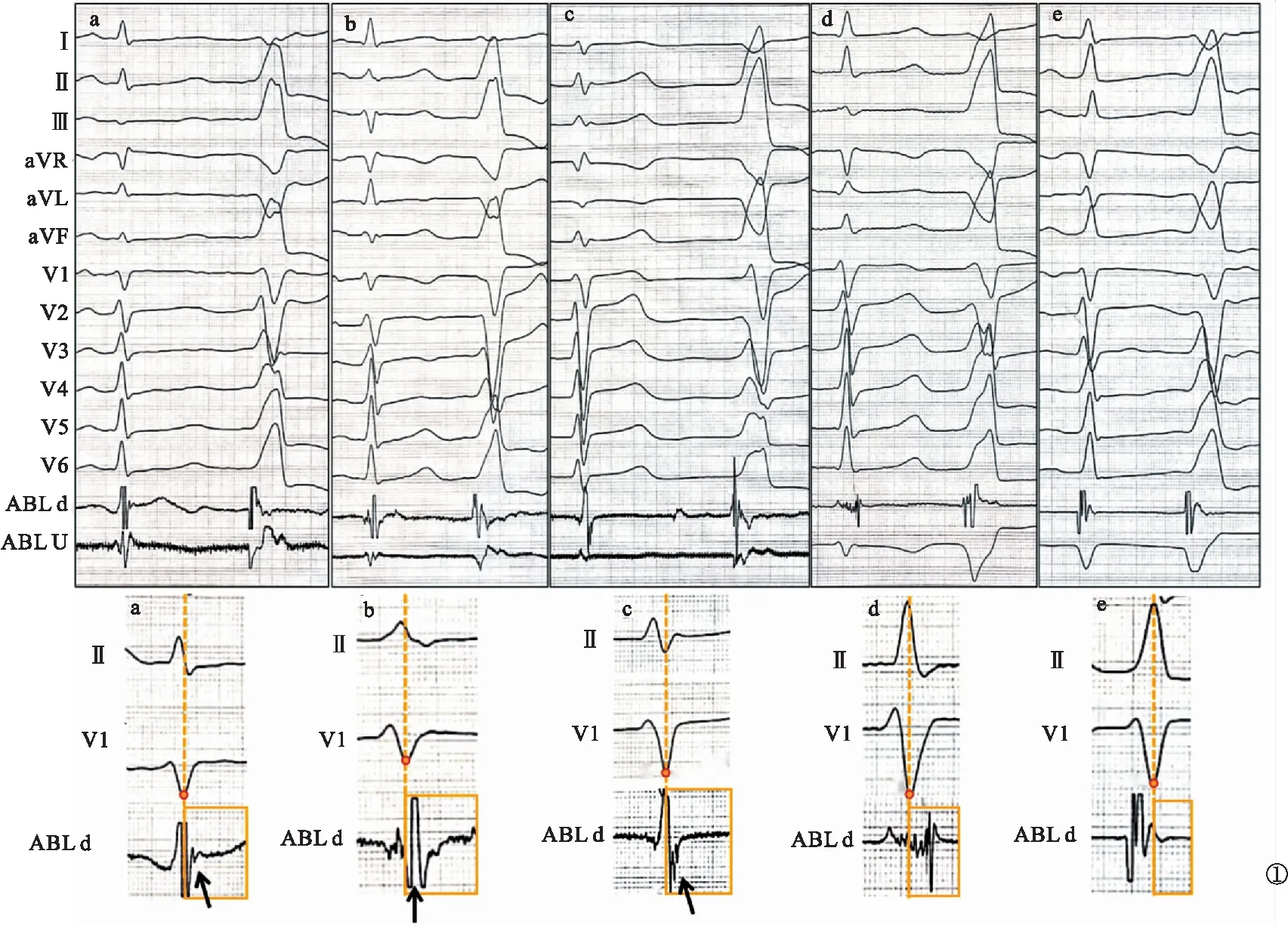
圖1 竇性心律下成功消融靶點處腔內雙極電圖電位形態分類(a.延遲低幅單電位;b.延遲高幅尖峰電位;c.延遲碎裂電位;d.延遲混合電位;e.無特征電位;ABL d.ABL導管遠端腔內雙極電圖;ABL U.ABL導管單極電圖)
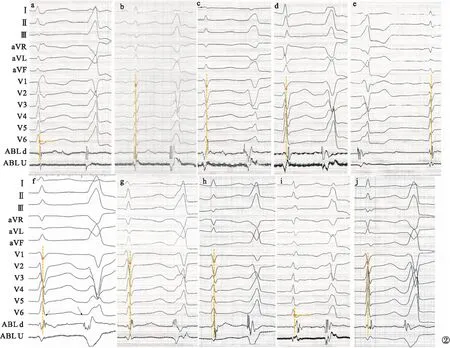
圖2 竇性心律延遲電位典型示意圖(a~b.延遲低幅單電位;c~e.延遲高幅尖峰電位;f~i.延遲碎裂電位;j.延遲混合電位)
1.4 隨訪 術后停用抗心律失常藥物,術后3個月復查24 h動態心電圖及超聲心動圖。患者出現心悸等癥狀時,就近進行心電圖檢查。
2 結果
2.1 電生理檢查及射頻消融結果 26種VAs于肺動脈瓣瓣上消融成功。靶點處V波提前體表QRS波(33.83±8.89)ms,所有靶點單極電圖均為QS形態。起搏標測顯示,于瓣下消融成功的108種VAs起搏后,心律均與自身VAs匹配良好;靶點位于瓣上時,15.38%(4/26)經起搏標測未能奪獲成功,其余22例均獲得滿意的匹配圖。手術即刻成功率98.51%(132/134);2例即刻失敗的患者均于間隔側消融一過性有效,術后次日復查心電圖顯示VAs消失,消融延遲成功。LC-CA組、RC-CA組、AC-CA組的聯律間期、V-QRS、起搏標測比例、瓣上消融比例、消融時間、透視時間比較,差異無統計學意義(P>0.05)。見表1。
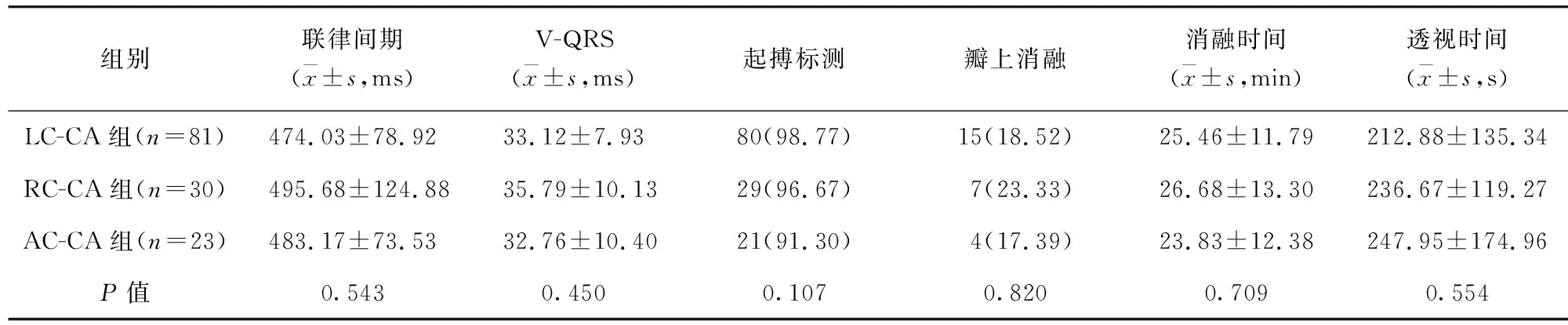
表1 射頻消融結果/例(百分率/%)
2.2 各個部位有效靶點腔內雙極電圖特征 靶點處延遲電位總體發生率為71.64%(96/134)。LC-CA組、RC-CA組、AC-CA組有效靶點竇性心律延遲電位總體發生率分別為66.67%(54/81)、83.33%(25/30)、73.91%(17/23),差異無統計學意義(P>0.05)。見表2。延遲電位于VAs時翻轉至V波之前并提前于體表QRS波的患者占51.04%(49/96)。延遲低幅單電位平均振幅為(0.30±0.11)mV,延遲于參考線(22.89±11.87)ms;延遲高幅單峰電位平均振幅為(2.91±1.6)mV,延遲于參考線(14.36±5.78)ms;延遲碎裂電位平均振幅(碎裂電位最高波峰至最低波峰)為(0.30±0.12)mV,延遲于參考線(13.29±6.32)ms。
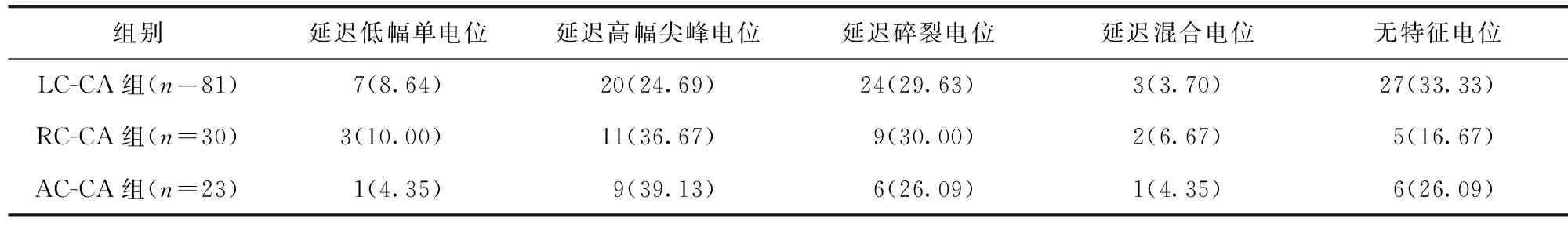
表2 各個部位有效靶點腔內雙極電圖特征/例(百分率/%)
2.3 延遲電位組與無特征電位組術中參數及術后結果比較 無特征電位組消融時間高于延遲電位組,差異有統計學意義(P<0.05)。無特征電位組與延遲電位組瓣上消融比例、竇性心律雙極電壓、V-QRS、透視時間、即刻成功率、隨訪中延遲成功率、隨訪復發率、長期成功率比較,差異無統計學意義(P>0.05)。見表3。
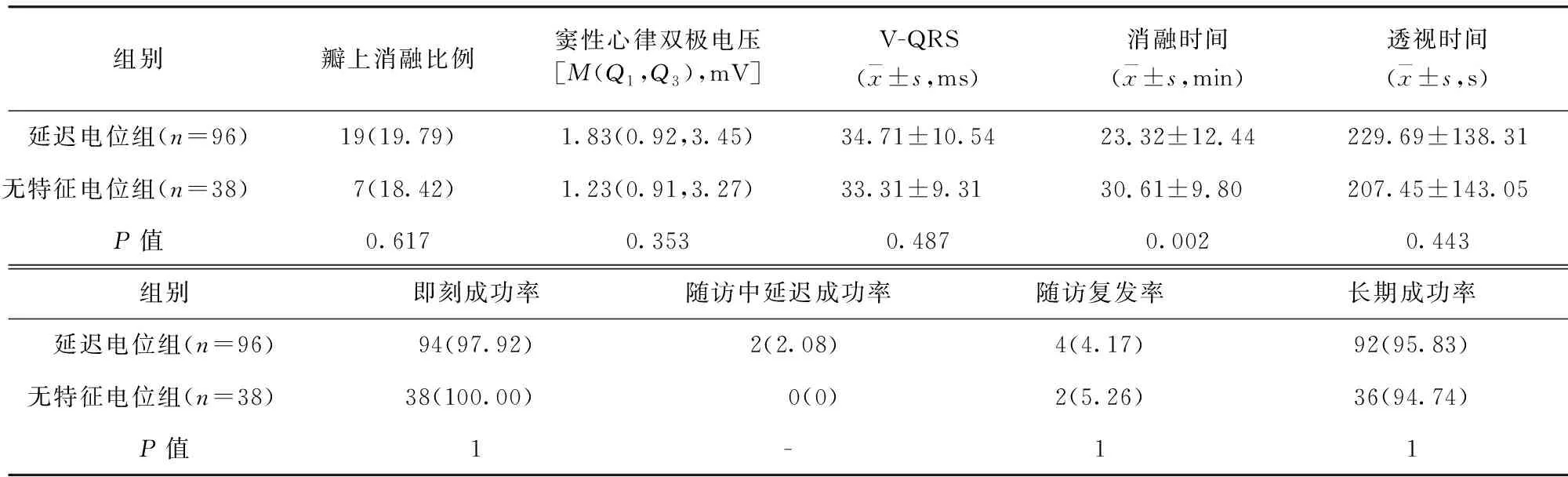
表3 延遲電位組與無特征電位組術中參數及術后結果比較/例(百分率/%)
2.4 并發癥發生情況 所有患者術中均未出現心包填塞等嚴重并發癥。平均隨訪(12.76±6.14)個月,4.48%(6/134)VAs復發(與術前VAs形態相同)。所有患者均未出現遠期并發癥。
3 討論
射頻消融術治療RVOT-VAs的成功率高達84%以上,是藥物難治性VAs的一線治療方法[5-6],其主要的標測方法有激動標測和起搏標測。激動標測需要基于心律失常的穩定發作,且面對低心律失常負荷的患者時應用受限。起搏標測空間分辨率略低;起搏后激動由表面經心肌連接傳導至心肌深部的起源點時,也會顯示高度匹配度;常規能量起搏對肺動脈瓣上VAs奪獲并不理想[7-8]。上述局限性可能會延長手術時間,增加非必要操作及風險。近年來,許多術者注意到了靶點處竇性心律下延遲電位的存在,但未系統地統計延遲電位的記錄率。本研究考慮V1導聯靠近RVOT,其S波最低點可以代表心室大部分心肌除極結束,以此為參考來定義延遲電位是一種合理的方法;結果顯示,有效靶點處延遲電位的發生率高達71.64%,提示了延遲電位與靶點間的密切關系;延遲電位組的消融時間短于無特征電位組,提示以延遲電位指導標測可提高手術效率,可以作為一種有效的標測方法。為進一步探尋延遲電位的特征,本課題組將其根據振幅和時限分為4種類型,發現延遲高幅尖峰電位和延遲碎裂電位的發生率稍高,分別為29.85%(39/134)和29.10%(40/134),但各電位類型在各個起源區域之間的分布差異無統計學意義(P>0.05)。
部分特發性VAs起源點附近存在小面積的電學瘢痕,形成緩慢傳導區,可能為部分患者的致病機制。Corrado等[9]通過電壓標測發現,26%(7/27)RVOT-VAs患者的流出道內存在低電壓區,心內膜活檢證實低電壓區內心肌有纖維脂肪樣變。Letsas等[10]研究表明,88.6%(39/44)RVOT-VAs患者流出道具有至少2個低電壓區,低電壓區可以輔助尋找靶點。另有研究報道,超過61%的消融靶點位于低電壓區和正常心肌之間的移行區內[11-13]。Lee等[14]在36%的納入患者竇性心律下觀察到延遲碎裂電位并可見VAs時電位翻轉提前,以此指導消融獲得了較高的成功率,該研究認為,延遲碎裂電位代表了局部心肌之間電活動的分離,在微層面激動產生了各向異性傳導。Liu等[3]研究觀察到17例患者竇性心律下有尖銳、高頻碎裂電位存在于心室電位之后或埋在心室電位之中,且該特殊電位與低電壓區對應。Bloch等[4]在RVOT間隔部記錄到延遲局部電位處消融成功,推測此電位并非起源灶的自律性激動,而是附近“保護區”的緩慢傳導,此區域保護起源點免受竇性激動的干擾,VAs時激動則經緩慢傳導區傳出。
血管和心臟連接處為心律失常的好發部位。胚胎時期,流出道遠端逐漸失去心肌表型,成為主動脈干和肺動脈干(pulmonary artery,PA)的近段,PA內心肌若不完全退化,成為“肌袖”連接PA及RVOT遠端,則可能造成VAs。PA內的心室肌延伸十分常見。尸檢發現,約17%無VAs的人類PA內有心室肌的延伸,平均長度為(3.25±1.30)mm[15-16]。有研究發現,在PA內成功消融的靶點均位于心肌延伸最遠端,即正常心肌電壓信號消失處,通過阻斷PA內心肌的起始端或RVOT內插入點均可成功消融VAs[17]。
綜上所述,本研究推測延遲碎裂電位可能為激動在微小瘢痕內的各向異性傳導及突破;而延遲單峰電位可能代表延伸的心肌激動,延伸心肌肌束的粗細不同造成了延遲單峰電位的振幅高低不同。延遲電位的發生率較高,以延遲電位指導標測在竇性心律下即可以進行,在心律失常不穩定發作或傳統標測方法受限制時可以作為一種輔助標測技術,縮小興趣區域,即在竇性心律下顯示延遲電位的區域等待VAs出現,再結合局部激動標測和起搏標測,有助于確定靶點,提高手術效率;術者提高對竇性心律下延遲電位的關注并有意識地進行標測,或可為術中消融困難的患者提供思路。本研究存在局限性,為一項單中心、回顧性、小樣本研究;考慮經濟條件等因素,多數患者未應用心腔內超聲,未能精準定位肺動脈瓣及消融靶點的位置。

