膜芯片法快速篩查即食果蔬中常見致病微生物方法的建立及應用
鄒雨虹 楊丹妮 張曉金

摘 要:建立膜芯片法檢測即食果蔬中的常見致病微生物,實現快速、簡便、同步篩檢6種細菌和病毒。利用反向斑點雜交技術將待測靶標基因中的特異性序列作為探針固定在尼龍膜上,利用多對帶生物素標記的引物對待測靶標基因進行擴增,并通過酶-底物顯色,產生肉眼可辨的信號。單次反應即可得出多種指標結果,同時結合多重PCR技術以雙重反應體系來確保檢測結果的準確性。結果表明,該方法具備特異性強及靈敏度高的優勢,且檢測結果準確,為食品中致病微生物的快速檢測提供了新思路。
關鍵詞:即食果蔬;致病微生物;快速檢測;膜芯片
Abstract: Establish a membrane chip method to detect common pathogenic microorganisms in ready-to-eat fruits and vegetables, achieving rapid, simple, and synchronous screening of six bacteria and viruses. Using the reverse dot blot technique, the specific sequence of the target gene was fixed on the nylon membrane as a probe. At the same time, multiple pairs of biotin-labeled primers were used to amplify the target gene. Through enzyme-substrate color development, visible signals were generated. Combined with multiple PCR technology, the dual reaction system ensures the accuracy of test results, and a single reaction can simultaneously screen multiple indicators.:The results show that this method has the advantages of strong specificity and high sensitivity, and the detection results are accurate, which provides a new idea for the rapid detection of pathogenic microorganisms in food.
Keywords: ready-to-eat fruits and vegetables; pathogenic microorganism; rapid detection; membrane chip
水果和蔬菜富含各類營養物質,有益于預防慢性疾病以及提高免疫力[1]。即食果蔬是指以新鮮水果和蔬菜為主要原料,經過加工處理后,通過冷藏或低溫運輸并進入冷柜銷售的即食或即用的果蔬制
品[2-3]。即食果蔬在流入市場前一般沒有經過高溫加工等滅菌步驟,人們可以直接鮮切、涼拌食用,容易出現交叉污染繼而引發食源性疾病[4],危害到人們的健康。其中,大腸埃希氏菌、單增李斯特菌、沙門氏菌、金黃色葡萄球菌等致病微生物均在黃瓜、萵筍、苦苣、番茄、菠菜、瓜類、蘋果和梨等即食果蔬中檢出[5-6]。
目前針對即食果蔬中致病菌檢測的方法主要有傳統分離培養及生化鑒定、酶聯免疫吸附、聚合酶鏈式反應(主要為熒光定量PCR法)、基因芯片法等[7],常規的分離培養基及生化鑒定檢測方法仍是我國食品中常見致病菌檢測的主要方式[8]。但此方法耗時長且步驟煩瑣,一般需要5~7 d得出結果。考慮到果蔬保質期極短的特殊性,檢測周期過長會嚴重影響果蔬產品的快速流通,很大程度上加重了即食果蔬生產企業在儲藏及質量管理上的負擔。
近年來出現的PCR技術逐漸被應用在食品中致病微生物的檢測中,該技術縮短了檢測時間,提高了檢測靈敏度及檢測效率[9],但無法利用一次實驗操作同時對多種致病菌進行檢測,對于目前生鮮果蔬流通不暢的問題仍無法提供解決思路。因此,利用膜芯片檢測工作平臺開發一種針對多種致病菌同步快速檢測的方法,對于即食果蔬行業的發展具有重要的現實意義。
膜芯片技術基于反向斑點雜交原理開發,利用反向斑點雜交技術(Reverse Dot Blot,RDB)將待測基因中的特異性序列作為探針固定在尼龍膜上,并采用生物素標記的引物進行基因的擴增,同時將擴增產物與固定在尼龍膜上的探針進行雜交,經化學顯色后可在雜交點上形成肉眼可見的信號,單次反應即可同時篩查多種靶標[10]。該方法的特別之處在于將多重PCR技術與反向斑點雜交(RDB)技術相結合形成檢測體系,可以同時提取細菌和病毒中的DNA和RNA,同步擴增特異性基因片段,在膜芯片上形成肉眼可見的檢測靶點,從而實現所有靶標的共同檢測。本文主要針對的即食果蔬中金黃色葡萄球菌、單核細胞增生李斯特氏菌、大腸埃希氏菌O157、沙門氏菌、諾如病毒和輪狀病毒這6種常見致病菌進行研究。
1 材料與方法
1.1 材料、試劑與儀器
1.1.1 樣品來源
本實驗所用的樣本(即食生菜、即食黃瓜、鮮切牛油果、鮮切火龍果、蘋果、胡蘿卜、金橘、苦苣、鮮切菠蘿和鮮切羊角蜜)購自各市場中。
1.1.2 標準菌株
細菌采用實驗保存的陽性菌株:沙門氏菌(CICC號21513)、大腸埃希氏菌O157:H7(CICC號21530)、金黃色葡萄球菌(CICC號10384)、單核細胞增生李斯特氏菌(CICC號21633),在實驗室進行菌株復蘇備用。病毒樣本采用購買標準質控品的形式進行。
1.1.3 儀器與試劑
MFS-24基因膜芯片檢測工作站(四川華漢三創生物科技有限公司);Fresco17高速冷凍離心機(賽默飛世爾科技有限公司);膜芯片檢測試劑盒(貨號:HT114B,四川華漢三創生物科技有限公司);細菌DNA提取試劑盒(貨號:DP302,天根生化科技有限公司);病毒DNA/RNA提取試劑盒(貨號:DP315,天根生化科技有限公司)
1.2 實驗方法
1.2.1 引物及探針設計
通過查看文獻并結合實際結果,最終選取以下基因序列。引物和探針的設計由Primer Premier 5.0軟件完成,具體對應的特異性基因詳細信息見表1。
1.2.2 樣本前處理
樣本的前處理階段選用致病菌共增菌培養基,將待測樣品與6種陽性標準菌株進行前增菌。取共增菌培養基干粉5.96 g,加入蒸餾水至完全溶解,調節pH值至7.2±0.2并定容到100 mL,將滅菌鍋條件設置為121 ℃、20 min,滅菌后冷卻備用。無菌稱取10 g待檢樣品,加入至100 mL的增菌培養基中,設置恒溫振蕩培養箱參數為35 ℃和150 r·min-1,過夜培養。最后從共增菌液中取1~5 mL,提取DNA后進行PCR反應。
1.2.3 樣品核酸制備
采用多重PCR技術擴增待檢靶標,以高純度的基因組DNA為模板,核酸樣品純度A260/A280在1.8~2.0可保證多重PCR反應的擴增效率;DNA樣品模板加入量≥200 ng以保證檢測效果。使用細菌DNA提取試劑盒或病毒基因組DNA/RNA提取試劑盒分別進行提取。
1.2.4 多重PCR擴增
(1)樣本核酸擴增PCR反應體系為2×Multiplex PCR Master Mix 10 μL,OneStep EnzymeMix 0.45 μL,Hela cell total RNA 1 μL,樣品DNA 20~400 ng,最后用無核酸酶滅菌水補足20 μL。
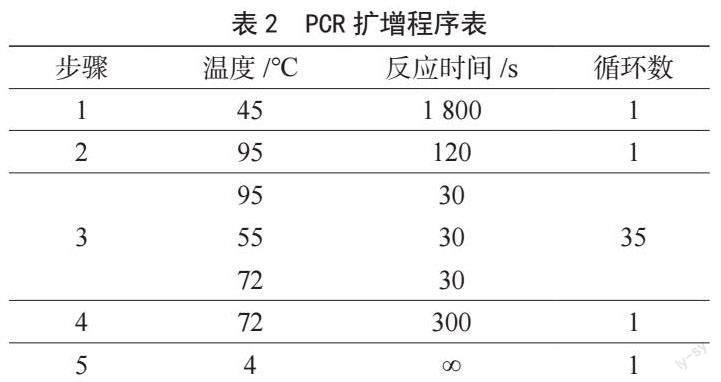
(2)PCR擴增程序、溫度及反應時間如表2所示。
1.2.5 膜芯片雜交
產物變性階段:將上述實驗產物在95 ℃變性5 min使其解鏈后立即置于冰上備用;雜交儀設置:雜交儀在開機前檢查瓶中的蒸餾水水位達到水位線,打開基因膜芯片檢測工作站的電源和開關,觀察廢液瓶是否空置,隨后打開軟件,等待工作站顯示自檢成功后,點擊確定按鈕;使用耗材和試劑的準備工作:使用前分別檢查試劑瓶BCDE中的液體,如果存在結晶,則置于36 ℃水浴鍋中溶解至結晶消失后使用;將雜交試劑進行分裝,準備相應數量的雜交管并將200 μL B液加入至每個雜交管中;芯片和樣品的加載:將準備好的C~J試劑瓶開蓋,取已加入樣品的雜交管及膜芯片放入工作站指定位置并確保一一對應,隨后關閉試劑盤和反應盤的蓋板及儀器倉門,并再次檢查芯片與雜交管是否放置正確;運行程序:加載“基因膜芯片檢測工作站標準雜交流程”,根據檢測樣品放置的位置選中相應的按鈕,點擊“運行”開始實驗。
1.2.6 結果判讀
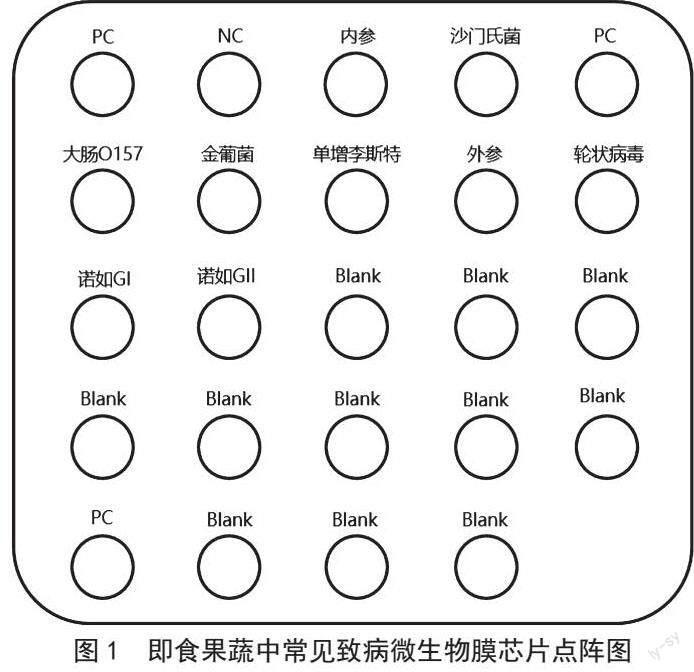
實驗結果有效的前提是膜芯片上PC點顯色,NC點不顯色。反應結果可用肉眼進行判讀,也可參照膜芯片核酸分子雜交儀成像分析系統得出的結果。膜芯片點陣圖及多重PCR陽性質控反應結果如圖1和圖2所示。
2 市售樣本檢測結果與分析
對市場中購買的10個即食果蔬樣本,提取其核酸,采用建立的膜芯片法進行檢測鑒定,結果芯片圖如圖3所示,灰色點表示該點位陽性,無圓點則表示該點位陰性,同時還應結合膜芯片點陣圖的基因序列進行肉眼判讀。
在3份樣本(即食生菜、即食黃瓜、金橘)中檢出了金黃色葡萄球菌,而單核細胞增生李斯特氏菌、大腸埃希氏菌O157、沙門氏菌及諾如病毒、輪狀病毒未檢出;另外7份樣本均未檢出此6種致病微生物。結果表明,市場中售賣的即食果蔬存在被致病微生物感染的風險,通過建立的膜芯片法能夠達到多種致病菌的同步檢測。
3 討論
本項目將多重PCR技術與反向斑點雜交(RDB)技術相結合形成檢測體系,同時提取6種致病微生物提取的DNA和RNA,并同步擴增特異性基因片段,在膜芯片上顯示直觀的檢測靶點,從而實現對多種致病菌的同步檢測。本文建立的多重反應體系中,利用特異性引物,可以在一次PCR反應體系中同時鑒別出金黃色葡萄球菌、沙門氏菌、大腸埃希氏菌O157、單核細胞增生李斯特氏菌,以及諾如病毒、輪狀病毒這6種致病菌,并且在48 h內能得出準確結果。此方法快捷便利,檢測條件限制不多,能滿足PCR實驗環境的實驗室均可進行檢測,并可實現一次操作同步檢測多種致病微生物,大大提高了檢測效率。
膜芯片法作為一種具備優勢的檢測新方法,應用于食品的致病菌快速篩查中,可以提供更為快速且準確的實驗結果,且無需耗費大量人力資源。此方法有效解決了傳統分離培養基法耗時過長的問題,有利于保障即食果蔬產品的順暢流通;有利于其他食品企業有效控制微生物污染風險,防止食源性疾病造成食品安全問題;有利于食品安全監管抽檢工作高效地進行,為食品安全監管工作提供了強有力的技術支撐。隨著基因膜芯片研究的不斷深入,相信膜芯片技術也會不斷發展,在食品致病性微生物的檢測中能得到更加廣泛的應用。
參考文獻
[1]肖興寧,王珍,蔡錚,等.浙江省即食生鮮果蔬病原微生物污染調查分析[J].浙江農業科學,2020,61(3):528-530.
[2]張慜,馬良.對我國鮮切果蔬微加工行業及安全性的思考[J].江南大學學報(人文社會科學版),2016,15(5):110-114.
[3]華雪蘭.鮮切果蔬加工工藝與保鮮技術分析[J].農業開發與裝備,2022(9):210-212.
[4]李曉鳳,秦宇龍,劉姜汝,等.即食果蔬中食源性致病菌風險評估的研究進展[J].食品與發酵工業,2022,48(18):322-328.
[5]VANDAMM J P,LI D,HARRIS L J,et al.Fate of Escherichia coli O157:H7, Listeria monocytogenes, and Salmonella on fresh-cut celery[J].Food Microbiol,2013,34(1):151-157.
[6]秦曉杰,李嘉銘,孫天妹,等.2021年上海市部分即食果蔬中食源性致病菌暴露風險監測[J/OL].上海預防醫學:1-7[2023-01-10].http://kns.cnki.net/kcms/detail/31.1635.R.20221119.1525.002.html.
[7]武俠均.食品與飼料中致病微生物檢測技術及展望[J].中國飼料,2022(21):109-117.
[8]WAN J J,LU Z X,BIE X M,et al.Improvement of a new selective enrichment broth for culturing Salmonella in ready-to-eat fruits and vegetables[J].Journal of Food Safety,2020,40(5):e12817.
[9]WAN J J,ZHENG L P,KONG L Y,et al.Development of a rapid detection method for real-time fluorescent quantitative PCR of Salmonella spp. and Salmonella Enteritidis in ready-to-eat fruits and vegetables[J].LWT,2021,149:111837.
[10]任易婕,霍勝楠,翟清燕,等.膜芯片技術對牛、羊、牦牛、驢肉源食品的摻偽鑒別[J].肉類研究,2019,33(6):33-38.

