培養基組分對大花蕙蘭類原球莖增殖培養的影響
王俊斐 崔永一

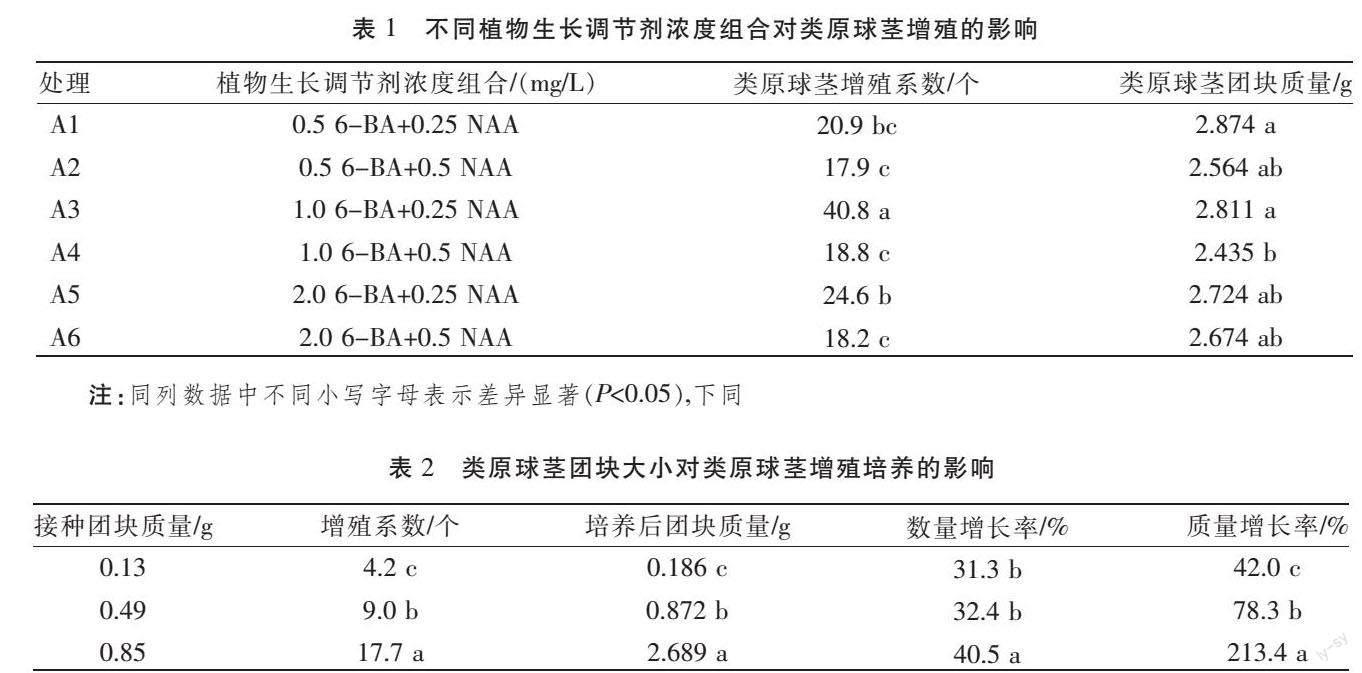
摘? ?要? ?以大花蕙蘭“華爾茲”的莖尖培養誘導出的類原球莖團用作接種材料,探究了不同植物生長調節劑濃度組合、類原球莖團塊大小以及不同蔗糖濃度處理對類原球莖增殖培養的影響。結果表明:6-BA1.0 mg/L+NAA0.25 mg/L為類原球莖增殖培養適宜的植物生長調節劑濃度組合,能夠在一定程度上抑制芽或根的分化;接種0.85 g類原球莖團更有利于類原球莖增殖培養;類原球莖增殖培養適宜的蔗糖濃度為1.5%。
關鍵詞? ?大花蕙蘭;增殖培養;類原球莖
大花蕙蘭多為雜交品種,結實率低,且種子繁殖無法保持其品種特性,后代分離現象嚴重。同時,其分株能力弱,3年左右才能分株出1棵苗,因而繁殖系數低,繁殖速度慢。植物組織培養技術應用于植物的離體快速繁殖是目前使用最廣泛和有效的一種手段。在大花蕙蘭組織培養研究中,常以莖尖、莖段、側芽、幼根、花梗等部位用作外植體,據殷麗青、胡燕梅等報道,莖尖為誘導類原球莖最適宜的外植體。本試驗以大花蕙蘭“華爾茲”的莖尖培養誘導出的類原球莖團用作接種材料,探究了不同植物生長調節劑濃度組合、類原球莖團塊大小以及不同蔗糖濃度處理對類原球莖增殖培養的影響,以期為優化大花蕙蘭優良種苗組培快繁體系及其遺傳轉化研究提供科學依據。
1? ?材料與方法
1.1? ?試驗材料? ?原始材料系浙江森禾種業有限公司提供的大花蕙蘭品種“華爾茲”,采用莖尖培養誘導出的類原球莖團作為試驗材料。
1.2? ?試驗方法
1.2.1? ?不同植物生長調節劑濃度組合對類原球莖增殖培養的影響? ?挑選顆粒飽滿、黃綠鮮亮的類原球莖團,切割成等大的小塊,接種到經高壓滅菌過的以MS為基本培養基,附加不同濃度的6-BA(0.5、1.0、2.0 mg/L)、NAA(0.25、0.5、1.0、? ? 2.0 mg/L)NAA、蔗糖濃度3%、椰子汁10%、瓊脂6.7 g/L、活性炭1 g/L、pH5.6~5.8的培養瓶內,每瓶裝培養基50 ml,接種3塊類原球莖團,每個處理接種10瓶,試驗重復3次。置于光照強度2 000 lx、光照時間12小時/天、室溫25±2℃、濕度70%~80%的培養環境,培養30天后統計每瓶內的類原球莖增殖系數及類原球莖團塊 質量。
1.2.2? ?類原球莖團塊大小對增殖培養的影響? 挑選顆粒飽滿、黃綠鮮亮的類原球莖團,切割成平均質量分別為0.13 g、0.49 g和0.85 g的3組類原球莖團塊,接種到經高壓滅菌過的以MS為基本培養基,附加6-BA 1.0 mg/L、NAA 0.25 mg/L,蔗糖濃度等同1.2.1。接種0.13 g類原球莖團的處理組平均每塊類原球莖數量為3.2個,接種0.49 g類原球莖團的處理組平均每塊類原球莖數量為6.8個,接種0.85 g類原球莖團的處理組平均每塊類原球莖數量為12.6個。每瓶接種3塊類原球莖團,每組接種10瓶,試驗重復3次。培養環境同1.2.1,培養30天后統計每瓶內的類原球莖增殖系數及類原球莖團塊質量,計算增長率。
1.2.3? 不同蔗糖濃度處理對類原球莖增殖培養的影響? ?挑選顆粒飽滿、黃綠鮮亮的類原球莖團,切割成等大的小塊,接種到經高壓滅菌過的以MS為基本培養基,附加不同濃度的蔗糖(1.5%、3%、6%)、6-BA 1.0 mg/L、NAA 0.25 mg/L,椰子汁等營養配比同1.2.1,接種3塊類原球莖團,每個處理接種10瓶,試驗重復3次。培養環境同1.2.1,培養30天后統計每瓶內的類原球莖增殖系數及類原球莖團塊質量。
1.3? ?數據分析? ?類原球莖增殖系數是指類原球莖團接種培養30天后培養瓶內形成的類原球莖總個數的平均值;類原球莖團塊質量指類原球莖團接種培養30天后培養瓶內形成的類原球莖團總質量的平均值。
數據通過Excel 2019處理,用IBM SPSS STATISTIC 23.0軟件進行單因素方差分析。
2? ?結果與分析
2.1? ?不同植物生長調節劑濃度組合對類原球莖增殖培養的影響? ?類原球莖團接種到附加不同植物生長調節劑濃度組合的培養基上,增殖系數和團塊質量均存在顯著差異(表1)。其中,A3處理組類原球莖增殖系數最大,較A1、A2、A4、A5和A6處理組差異顯著,達到40.8個。A1、A3處理組類原球莖團塊質量較大,分別為2.874 g、2.811 g。在6-BA濃度一定的情況下,NAA濃度為0.25 mg/L更有利于類原球莖增殖培養,當NAA濃度提高到0.5 mg/L,一定程度上抑制了類原球莖的增殖。當6-BA濃度為1.0 mg/L時,A3、A4處理組類原球莖團塊質量差異顯著。比較處理組A1、A3、A5可得,培養基中NAA濃度一定的情況下,6-BA濃度從0.5 mg/L上升到1.0 mg/L,類原球莖增殖系數顯著增大;當6-BA濃度提高到2.0 mg/L時,會抑制類原球莖的增殖;6-BA濃度不同,處理之間類原球莖團塊質量無顯著差異。另外,試驗還觀察到不同植物生長調節劑濃度組合處理下的類原球莖分化情況也存在一定的差異。當6-BA濃度為1.0 mg/L時,隨著NAA濃度升高,類原球莖分化出芽或根的數量增多。在NAA濃度一定的情況下,6-BA濃度從0.5 mg/L上升到? ?1.0 mg/L,類原球莖分化出芽或根的數量減少;當6-BA濃度提高到2.0 mg/L時,類原球莖分化出芽或根的數量增多。綜上,6-BA 1.0 mg/L+NAA 0.25 mg/L為類原球莖增殖培養適宜的植物生長調節劑濃度組合。
2.2? ?類原球莖團塊大小對類原球莖增殖培養的影響? ?培養30天后,接種不同大小類原球莖團的3個處理組間類原球莖增殖系數和團塊質量均存在顯著差異(表2)。其中,接種0.85 g類原球莖團的處理組類原球莖團塊數量增長率、質量增長率均顯著高于接種0.13 g和0.49 g類原球莖團的處理組,接種0.13 g類原球莖團的處理組類原球莖團塊數量增長率、質量增長率最低,接種0.49 g類原球莖團的處理組類原球莖團塊數量增長率與接種0.13 g類原球莖團的處理組無顯著差異。由此可得,接種0.85 g類原球莖團較適宜類原球莖增殖培養。
2.3? ?不同蔗糖濃度處理對類原球莖增殖培養的影響? ?培養基中添加的蔗糖濃度不同,類原球莖增殖系數和團塊質量差異顯著(表3)。其中,蔗糖濃度為1.5%的處理組類原球莖增殖系數最 大,達22.6個,與蔗糖濃度為3%、6%的處理組存在顯著差異,其類原球莖團塊質量也最大,為2.892 g,蔗糖濃度為6%的處理組類原球莖團塊質量次之,為2.73 g,蔗糖濃度為3%的處理組類原球莖團塊質量最小,其類原球莖增殖系數與蔗糖濃度為6%的處理組無顯著差異。綜上,類原球莖增殖培養適宜的蔗糖濃度為1.5%。
3? ?討論
徐宏英等的研究表明,6-BA和NAA對大花蕙蘭類原球莖的增殖起明顯的促進作用。秘彩莉等試驗篩選出6-BA1.0 mg/L+NAA0.5 mg/L的植物生長調節劑濃度組合相較6-BA1.0 mg/L+2,4-D2.0 mg/L更有利于大花蕙蘭類原球莖增殖培養。章鵬程和樊家榮等試驗結果顯示,植物生長調節劑濃度組合6-BA1.0 mg/L+NAA0.3 mg/L處理下,大花蕙蘭類原球莖增殖系數達到最大。而趙鸝、徐萌等研究認為,6-BA濃度為1.0 mg/L、NAA濃度為0.2 mg/L時,大花蕙蘭類原球莖的增殖量最高。本試驗于NAA濃度0.2 mg/L和0.3 mg/L之間設置了0.25 mg/L濃度處理,與NAA 0.5 mg/L處理形成對照,結果顯示6-BA 1.0 mg/L+NAA 0.25 mg/L為類原球莖增殖培養適宜的植物生長調節劑濃度組合,與上述試驗結果基本一致。
由不同大小的類原球莖團塊接種試驗可得,大花蕙蘭的類原球莖增殖具有一定的群體生長效應,增殖系數與接種密度成正相關,相對大塊的類原球莖團增殖系數顯著高于單個或者小塊的類原球莖團,這與劉佩佩針對大花蕙蘭“幻影”類原球莖增殖過程展開試驗的研究結果一致。
徐宏英和趙鸝等的研究表明,蔗糖濃度的高低對大花蕙蘭類原球莖增殖作用不明顯,但對分化系數大小有顯著影響,因此認為2%的蔗糖濃度處理較適宜類原球莖增殖培養。而程麥風研究顯示,蔗糖濃度對大花蕙蘭類原球莖增殖培養有明顯的影響,當蔗糖濃度為2%時,類原球莖增殖系數最大,低于1%時基本上不能獲得類原球莖團,高于5%時則會出現畸形和發紅的類原球莖團。本試驗設置了介于1%和2%之間的蔗糖濃度1.5%處理,以及高于5%的蔗糖濃度6%處理,證實培養基中蔗糖濃度不同,類原球莖增殖系數和團塊質量差異顯著,添加低濃度的蔗糖有利于類原球莖增殖 培養。
以上僅針對不同植物生長調節劑濃度組合、類原球莖團塊大小以及不同蔗糖濃度處理進行了類原球莖增殖培養的相關試驗,后續可深入探究不同基本培養基、其他植物生長調節劑種類及濃度組合、不同碳源、不同有機添加物及環境因素等條件對大花蕙蘭組織培養各階段的影響,進一步優化大花蕙蘭優良種苗快繁體系,改進栽培技術,提升大花蕙蘭產量。
參考文獻
[1] 王秋潔. 大花蕙蘭組織培養生產流程及降低成本的研究[D].北京林業大學,2007.
[2] 周永勝,胡松梅. 大花蕙蘭組織培養體系優化實驗初探[J].南方農業,2020,14(30): 152-153.
[3] 米曉潔,榮松. 大花蕙蘭組織培養繁殖技術研究[J].花卉,2018,319(04): 25-26.
[4] 吳曉霞,姜敦云,崔月花,等.大花蕙蘭的組織培養和快速繁殖[J].植物生理學通訊,2002,(02): 141.
[5] 楊洋,周文超. 大花蕙蘭組織培養技術研究[J].亞熱帶植物科學,2018,47(03): 277-280.
[6] 徐宏英,趙玉明,謝海軍,等. 大花蕙蘭組培快繁影響因素分析[J].園藝學報,2002,(02): 183-185.
[7] 秘彩莉,霍晨敏,馮全義,等. 大花蕙蘭快速繁殖技術初報[J].河北師范大學學報,2002,02): 190-192.
[8] 殷麗青,王廣東,張建軍,等. 大花蕙蘭(Cymbidium hybridium)離體快速繁殖技術[J].上海交通大學學報(農業科學版),2006(04): 365-369.
[9] 胡燕梅,夏景波,方中明,等.大花蕙蘭快速繁殖體系的初步建立[J].江漢大學學報(自然科學版),2015,43(03): 248-252.
[10] 章鵬程,陳瑜,鄧衍福,等. 6-BA與NAA不同濃度配比對大花蕙蘭原球莖誘導的影響[J].杭州師范大學學報(自然科學版),2012,11(04): 331-336.
[11] 樊家榮,孟想想,曹可.大花蕙蘭組培快繁技術研究[J].生物學雜志,2014,31(06): 99-102.
[12] 趙鸝,楊暉,梁巧玲.幾種因素對大花蕙蘭組培的影響[J].浙江農業科學,2009,299(02): 285-287.
[13] 徐萌,郭紹霞,孫麗,等.大花蕙蘭原球莖誘導、增殖與分化影響因素研究[J].北方園藝,2016,367(16): 108-110.
[14] 程麥風.大花蕙蘭的組織培養和快速繁殖技術研究[J].內蒙古農業科技,2005(S2): 190-191.

