基于葉綠素合成關鍵基因構建馬蹄蓮佛焰苞離體VIGS技術體系
劉紅艷 楊 拓 王 壹 孫 軒 王 賢 劉振林張國君 衛尊征,
(1河北科技師范學院園藝科技學院/河北省特色園藝種質挖掘與創新利用重點實驗室/河北省高校特色園藝植物生物育種應用技術研發中心,河北 秦皇島 066000;2北京市農林科學院草業花卉與景觀生態研究所,北京 100097; 3中國農業大學園藝學院,北京 100193)
馬蹄蓮(Calla lily)是天南星科馬蹄蓮屬(Zantedeschia)的球根花卉,作為主要觀賞部位的佛焰苞形似燃燒的佛焰、狀似彎曲的馬蹄,具有極高的觀賞價值[1]。然而,馬蹄蓮盛花期后,佛焰花的基部逐漸出現綠色并向上蔓延,在果實成熟后完全返青[2],這種現象導致其采后觀賞品質下降,經濟價值降低。因此,有效解決返青問題,有助于維持馬蹄蓮在運輸及銷售過程中的觀賞價值。
目前國內外對佛焰苞返青現象的研究,主要集中在生理層面,包括色素含量變化、質體發育以及激素調控等方面。前人研究表明,馬蹄蓮返青過程中,組織內葉綠素含量隨著佛焰苞外表皮綠色程度的加深而逐步增多[3],且葉綠體作為積累葉綠素的主要場所,在返青過程中再次形成[2]。植物生長發育受多種激素調控[4],乙烯作用于生長發育后期主要調控衰老,然而研究表明佛焰苞返青的過程不受乙烯調控[5];細胞分裂素和赤霉素主要作用于生長發育前期調控生長,研究表明外源施用赤霉素能有效延緩返青[6],與細胞分裂素有協同作用[7-8]。綜上可知,目前有關佛焰苞返青的調控機制尚不明晰,有待進一步探索。
深入探究佛焰苞返青,需要借助分子手段鑒定相關的基因功能,從而為后續基因編輯育種奠定理論基礎。但馬蹄蓮的再生和遺傳轉化極其困難[9],從實生苗到開花需要3~4 年的時間,對佛焰苞進行相關的表型鑒定比較困難。因此,利用轉基因技術驗證馬蹄蓮基因功能的方法仍存在瓶頸。病毒誘導的基因沉默(virus induced gene silencing,VIGS)是近年來發現的一種轉錄后基因沉默現象,可引起內源mRNA 序列特異性降解[10]。目前VIGS 已成功應用在眾多觀賞花卉的相關研究中,如蝴蝶蘭[11]、長春花[12]、矮牽牛[13]等。從技術、材料等方面考慮,利用VIGS 技術建立馬蹄蓮屬植物基因功能研究的技術體系,可能是克服馬蹄蓮遺傳轉化困難的重要手段。且鑒定葉綠素合成的關鍵基因,將有助于更好地認識馬蹄蓮佛焰苞的返青過程,為延長觀賞期提供有力的科學依據。
因此,本研究以彩色馬蹄蓮黃色品種Florex Gold為對象,依據北京市農林科學院草業花卉與景觀生態研究所馬蹄蓮課題組(本課題組)前期所構建的佛焰苞返青轉錄本數據庫,鑒定與葉綠素合成途徑的兩個關鍵基因ZhGluTR和ZhChlH轉錄本序列,之后進一步利用Primer 5.0 軟件設計上下游引物擴增非結構域的部分編碼區并基于同源重組法構建VIGS瞬時沉默載體,以期為解析馬蹄蓮佛焰苞返青現象的分子機制奠定基礎。
1 材料與方法
1.1 試驗材料
供試材料為彩色馬蹄蓮黃色栽培品種Florex Gold,栽植于北京市農林科學院延慶農場[14],試驗于2022 年3—5 月進行。依據返青過程中外表皮顏色的差異,選擇外表皮呈黃色的盛花期(S1)、外表皮呈淺綠色的返青初期(S2),以及外表皮呈深綠色的返青后期(S3)分別取樣作為試驗材料。
1.2 試驗方法
1.2.1 彩色馬蹄蓮返青典型時期的植物學性狀觀察 取佛焰苞S1、S2和S3期的新鮮樣本。利用透明膠帶將兩片重疊且濕潤的雙面刀片中部粘合,沿佛焰苞中部著色均勻部位的脈絡垂直方向快速切下,毛筆蘸取置于滴有清水的載玻片上,蓋上蓋玻片完成徒手切片制作,在顯微鏡下觀察比較呈色細胞的分布[15]。
1.2.2 色素含量測定 以S1、S2 和S3 期佛焰苞為材料,每個時期選取15朵花作為重復,取樣中部著色均勻部位液氮研磨至粉末狀。稱取0.1 g迅速轉移到10 mL離心管中,加入10 mL 提取液,提取液為80%丙酮與95%乙醇的等比混合液。反復顛倒離心管3~5次,4 ℃避光提取10 min,隨后用MG-1650 臺式高速離心機(美瑞克,深圳)7 340 r·min-1離心15 min 后取上清,用UV2500 紫外分光光度計(天美,上海)測定663、645 和440 nm 波長處的吸光值[16]。計算相應的葉綠素和類胡蘿卜素含量[17]。VIGS侵染后的孔片每個試驗組分別選取30片,重復上述操作。
1.2.3 色差值測定 以S1、S2和S3期佛焰苞為材料,使用NR60CP 手提式多功能色差儀(三恩馳,深圳)進行色差參數測定。每個時期分別選取15 朵花作為重復,避開主脈,對每朵花測定中部對稱的2個位置。將獲取的平均值作為該時期的花色參數L*、C和h值(L*值表示亮度,C值表示色飽和度,h值表示色調角)。VIGS 侵染后的孔片每個試驗組分別選取30 片,重復上述操作。
1.2.4 基因靶片段克隆與載體構建 利用EASY spin Plus 多糖多酚/復雜植物RNA 快速提取試劑盒(北京艾德萊生物科技有限公司)提取返青初期佛焰苞總RNA。使用HiScript Ⅲ 1st Strand cDNA Synthesis Kit試劑盒(南京諾唯贊生物科技有限公司)反轉RNA 為cDNA作為PCR模板。
本課題組在前期研究中,利用Hiseq2500 平臺針對黃色品種Florex Gold 的上述三個典型時期的佛焰苞進行了轉錄組測序,原始數據登錄在中國科學院北京基因組研究所(國家生物信息中心)的組學原始數據歸檔庫(Genome Sequence Archive),登錄號為CRA000209。本研究利用上述數據構建轉錄本數據庫,并從中查找在佛焰苞返青過程中表達量不斷增加的兩個葉綠素合成途徑關鍵基因ZhGluTR(OP076741)和ZhChlH(OP076742)的轉錄本序列。通過ORFfinder網站(https://www.ncbi.nlm.nih.gov/orffinder/)分析轉錄本的開放閱讀框,將完整的編碼區輸入CD-Search(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)預測蛋白保守結構域,利用Primer 5.0 軟件在非保守結構域的編碼區設計靶片段的上、下游引物擴增片段,利用限制性內切酶EcoRI 和XhoI 得到煙草脆裂病毒(tobacco rattle virus,TRV2)的線性載體,通過同源重組試劑盒ClonExpress II One Step Cloning Kit(南京諾唯贊生物科技有限公司)將片段分別與線性TRV2 連接,完成VIGS瞬時沉默載體構建。擴增引物見表1。
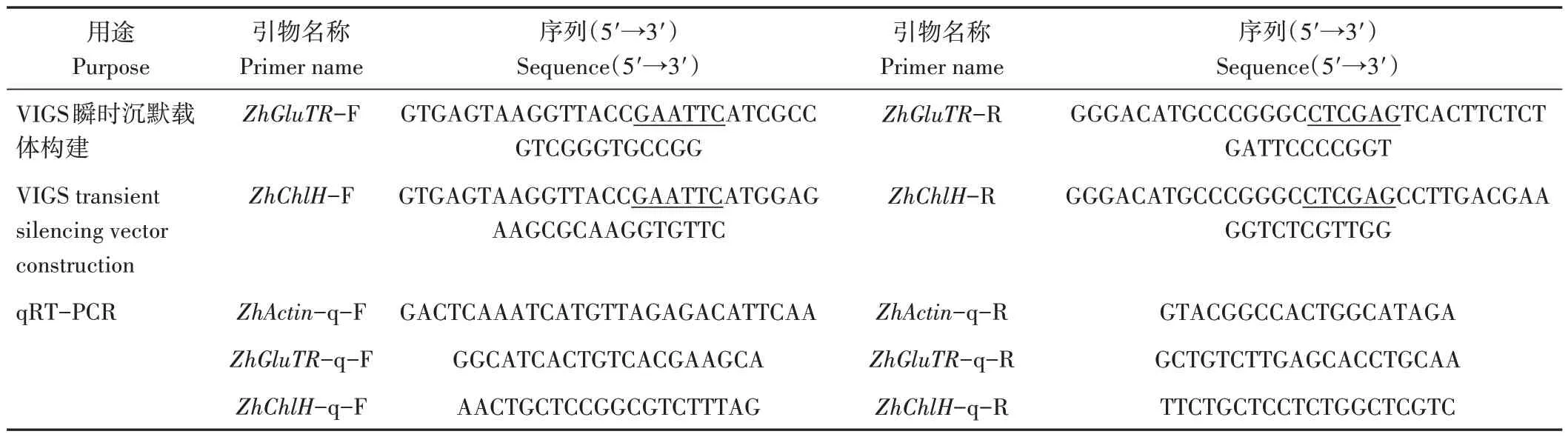
表1 本研究所用引物序列相關信息Table 1 Primer lists and related information used in this study
1.2.5 佛焰苞離體VIGS體系建立 設計完全隨機試驗,以佛焰苞中脈為軸,用14 mm打孔器取樣中部及上部孔片作為侵染材料(圖1),分別以3 和5 min 作為真空抽吸時間,共設4個試驗組(5上、5中、3上、3中)進行。將病毒載體以及VIGS 瞬時沉默載體轉化進農桿菌感受態GV3101,放置28 ℃搖床,加入終濃度50 mg·L-1卡那霉素與25 mg·L-1利福平的液體LB(Luria-Bertani)培養基,200 r·min-1中過夜震蕩培養,6 000 r·min-1離心菌液6 min 后棄上清,加入終濃度10 mmol·L-1氯化鎂(MgCl2)、10 mmol·L-12-嗎啉乙磺酸(2-morpholinoethanesulfonic acid,MES)與200 μmol·L-1乙酰丁香酮(acetosyringone,AS)的侵染緩沖液重懸菌體[18]。調整菌液在600 nm 波長處的光密度(optical density,OD)濃度為0.8[19]。將TRV1 菌液分別與TRV2、TRV2-ZhGluTR和TRV2-ZhChlH菌液等比混合后暗靜置3~4 h[20]。將中部與上部組織分別浸沒在混合菌液中,抽真空至0.08 MPa[21],負壓分別處理3 和5 min 后緩慢放氣,重復3 次。隨后用蒸餾水反復沖洗孔片,無菌濾紙吸干水分,將孔片背面向上置于0.4%瓊脂培養基內保持濕潤[22],4 ℃暗置共培養3 d 后轉移至21 ℃正常光照下培養。每個試驗組放置30個孔片,重復3次。共培養結束后記為0 dpi,對上述4個試驗組在0、3、6、9 dpi 分別取樣品放置于液氮中速凍,存于-80 ℃備用。

圖1 彩色馬蹄蓮佛焰苞取樣位置示意圖Fig.1 Sampling position diagram on sapthe of Zantedeschia hybrida Florex Gold
1.2.6 實時熒光定量PCR 驗證 完全隨機試驗中選取效果最好的試驗組進行實時熒光定量PCR(quantitative real-time PCR,qRT-PCR)驗證。上述3 種菌液侵染后的孔片各選10 片,利用EASY spin Plus 多糖多酚/復雜植物RNA 快速提取試劑盒提取該組樣品總RNA,利用HiScript Ⅲ 1st Strand cDNA Synthesis Kit反轉為RNA 為cDNA 作為qRT-PCR 的模板。以ZhActin作為內參基因[23],ZhGluTR和ZhChlH作為目的基因,通過Primer 5.0 軟件設計引物(表1),使用Taq Pro Universal SYBR qPCR Master Mix 試劑盒(南京諾唯贊生物科技有限公司)進行試驗,試驗設置3次技術重復。將得到的數據采用2-ΔΔCT法計算[24]。
1.2.7 數據分析 色差值、色素值以及qRT-PCR 測定數據采用Excel 2010、SPSS 22.0進行數據分析,采用GraphPad Prism 8.0軟件進行圖片制作。
2 結果與分析
2.1 彩色馬蹄蓮返青過程中的表型、色差以及相應的色素含量及分布情況
通過徒手切片觀察佛焰苞S1、S2和S3時期的色素分布,并測定相應時期的色差值和色素含量。
結果表明,盛花期時表型為黃色,切片觀察組織背面含有黃色的類胡蘿卜素;返青初期時表型為淺綠色,切片觀察組織背面開始出現葉綠素積累;返青后期時表型為綠色,切片觀察組織背面葉綠素積累增多(圖2)。
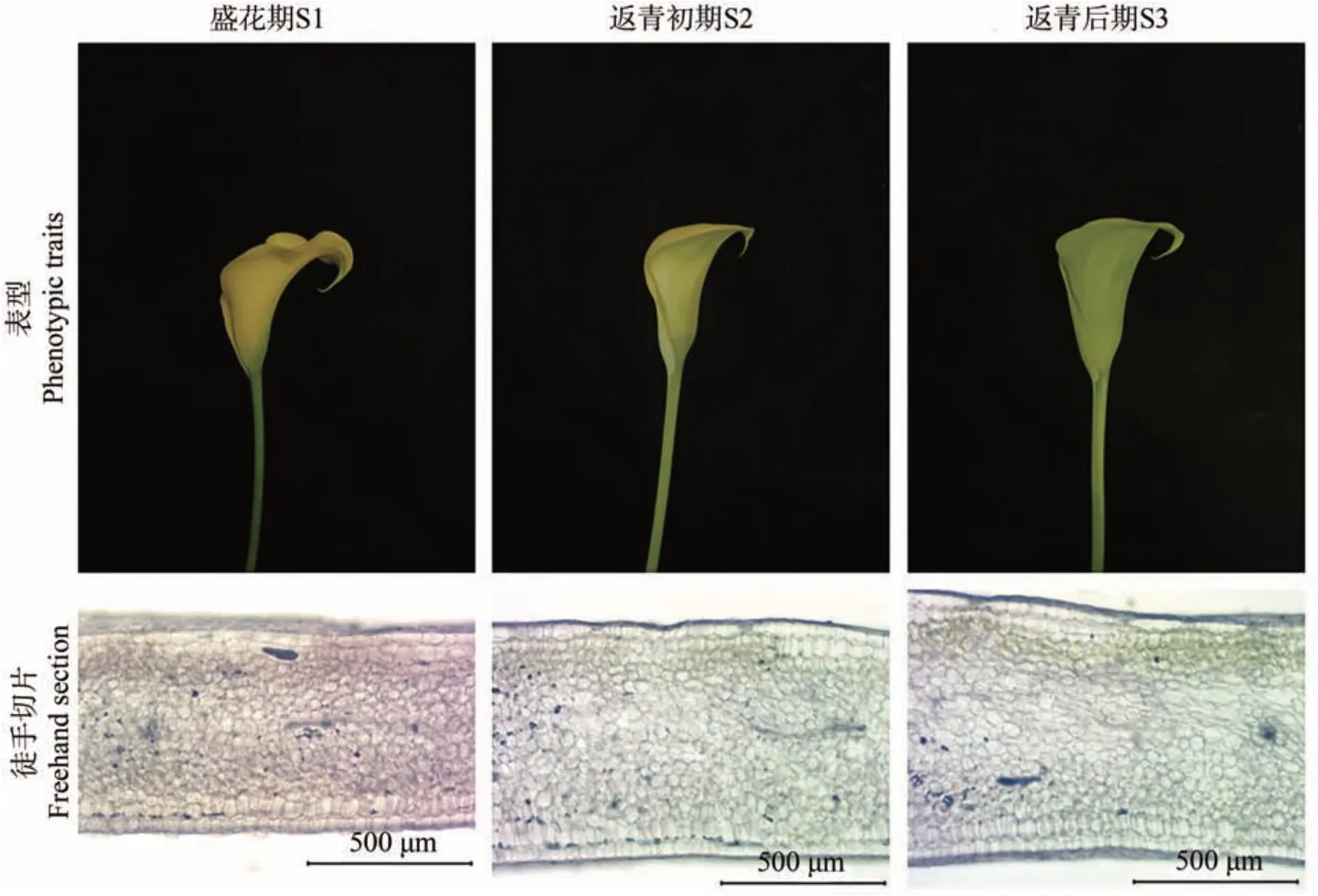
圖2 彩色馬蹄蓮Florex Gold返青過程中的表型與相應色素分布Fig.2 Changes of spathe phenotype and corresponding pigment distribution of Zantedeschia hybrida Florex Gold
在佛焰苞發育過程中,h值與總葉綠素含量持續上升,L*值與C 值持續下降,且各階段之間差異顯著(P<0.05);總類胡蘿卜素含量在S1 至S2 時顯著下降(P<0.05),S2至S3時有所下降,但差異不顯著(圖3)。
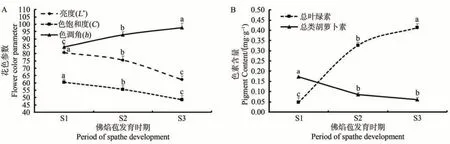
圖3 彩色馬蹄蓮Florex Gold返青過程中的花色參數(A)以及色素含量(B)變化Fig.3 Changes of spathe flower color parameter(A),and pigment content(B)in Zantedeschia hybrida Florex Gold during regreening
2.2 ZhGluTR 和ZhChlH 的結構域分析以及沉默片段的克隆和VIGS瞬時沉默載體構建
由圖4 可知,ZhGluTR 和ZhChlH 的編碼區都具有較長的保守結構域,位于編碼區非結構域部分的片段被成功克隆,長度分別為412 和400 bp。通過凝膠電泳確定沉默片段大小,并利用Sanger 測序確定序列的準確性。通過同源重組法將TRV2 載體與沉默片段分別相連,通過凝膠電泳確定重組片段大小,并利用Sanger 測序確定序列的準確性,成功構建了VIGS 瞬時沉默載體TRV2-ZhGluTR和TRV2-ZhChlH。

圖4 ZhGluTR和ZhChlH結構域分析(A)、沉默片段克隆(B)和VIGS瞬時沉默載體構建(C)Fig.4 Domain analysis of ZhGluTR and ZhChlH (A),silent fragment clones(B)and VIGS transient silencing vector construction(C)
2.3 ZhGluTR 和ZhChlH 基因沉默對彩色馬蹄蓮佛焰苞的影響
在0、3、6 和9 dpi分別取經上述3 種菌液浸染后的孔片,進行表型、色差值和色素含量測定,結果如圖5所示。與對照侵染的佛焰苞孔片相比,TRV2-ZhGluTR和TRV2-ZhChlH侵染的佛焰苞孔片返青現象出現得較晚。TRV 侵染的佛焰苞孔片在3 dpi 時由黃逐漸變綠,出現返青現象,隨后在9 dpi 完全返青。TRV2-ZhChlH侵染的佛焰苞孔片在6 dpi 后出現輕微返青,此時4種處理方法的色調角h值與對照相比均顯著降低(P<0.05);TRV2-ZhGluTR侵染的佛焰苞孔片在9 dpi后出現輕微返青,此時4種處理方法的h值與對照相比均顯著降低(P<0.05)。并且h值的變化趨勢與侵染后孔片的顏色變化相符,即孔片表現綠色程度越深,相應的h值越大。
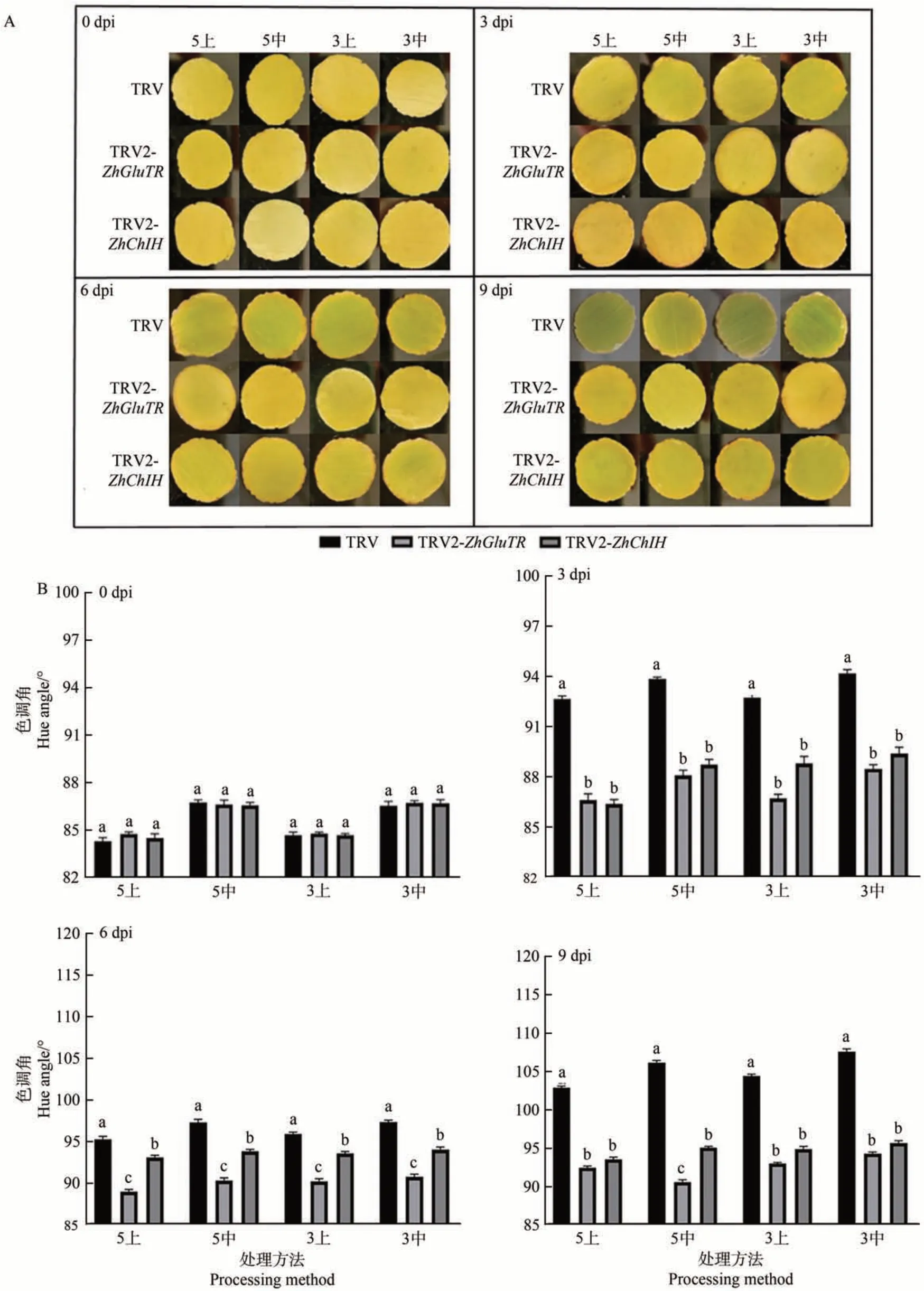
圖5 VIGS侵染后各處理組的表型(A)和色調角(B)變化Fig.5 Phenotype(A),hue angle(B)of each treatment group after VIGS infection
本試驗中被浸染的所有孔片隨時間增長而發生的共同變化為葉綠素含量增多,類胡蘿卜素含量降低。相較而言,兩個沉默組中葉綠素含量顯著增多的時間節點位于對照之后,類胡蘿卜素含量顯著減少的時間節點位于對照之前。除此以外,4 個處理組中,對中部孔片真空侵染5 min 的處理方法使得返青現象出現得最遲,葉綠素含量積累以及類胡蘿卜素減少相對緩慢(圖6)。
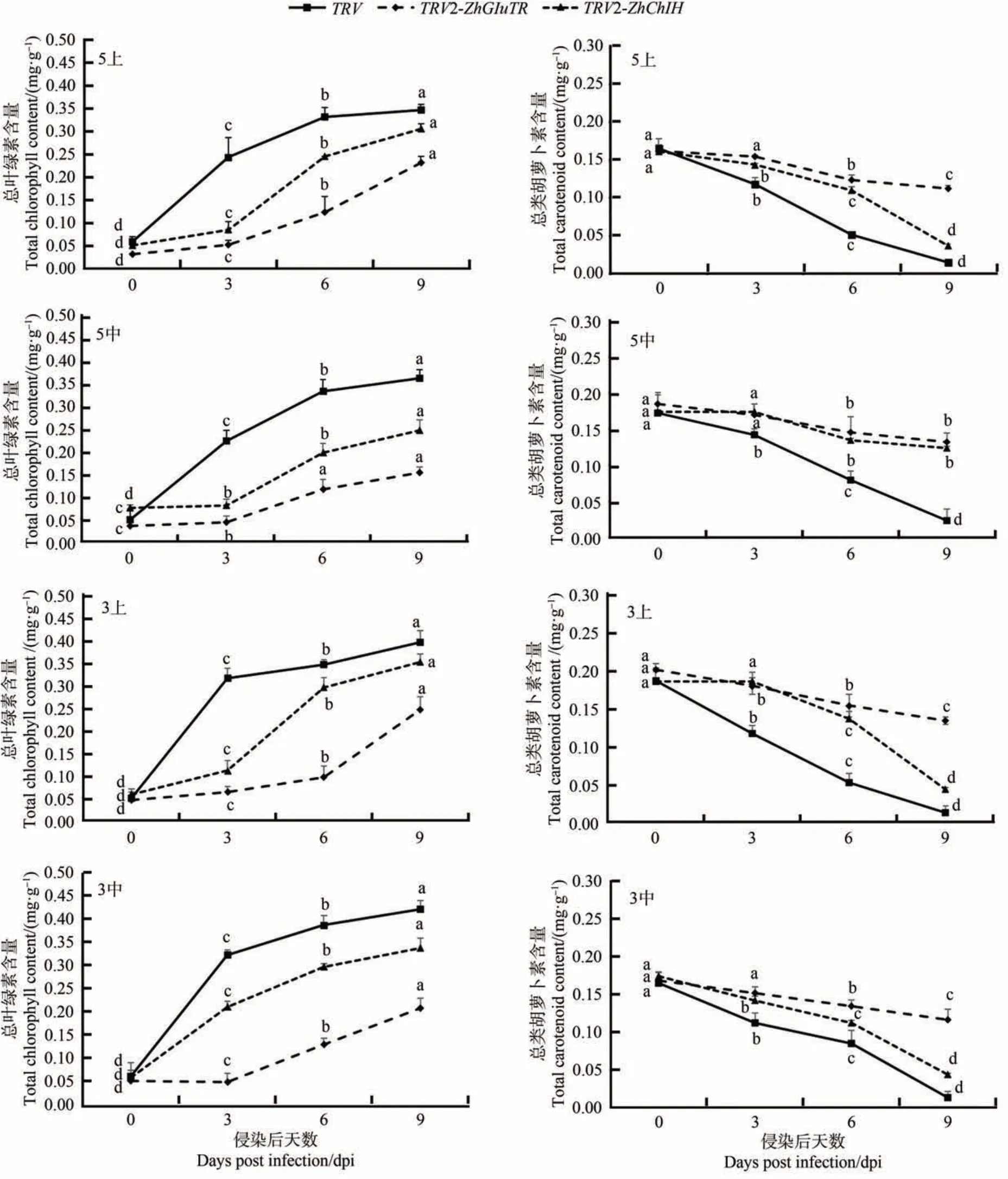
圖6 VIGS侵染后各處理組的色素含量變化Fig.6 Pigment content of each treatment group after VIGS infection
綜上所述,沉默ZhGluTR和ZhChlH會延遲返青現象,對中部孔片真空侵染5 min的處理方式延遲返青效果最好,推測ZhGluTR和ZhChlH可能正向調控馬蹄蓮中葉綠素的合成。
2.4 實時熒光定量PCR驗證
選取VIGS 體系中延緩返青效果最好的處理組(5中)進行qRT-PCR 驗證,結果如圖7 所示。與對照相比,TRV2-ZhGluTR和TRV2-ZhChlH侵染的佛焰苞孔片中,ZhGluTR和ZhChlH基因的相對表達量均顯著下降(P<0.05)。表明佛焰苞離體VIGS體系構建成功。
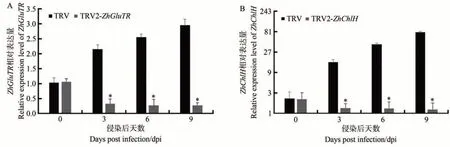
圖7 VIGS侵染后ZhGluTR(A)和ZhChlH(B)的相對表達量變化Fig.7 Changes of relative expression levels of ZhGluTR(A)and ZhChlHB(B)after VIGS infection
3 討論
在自然界中,植物返青現象并不罕見。除馬蹄蓮外,還出現于夏橙[25]、蝴蝶蘭[26]、白掌[27]等植物中。前人研究表明,彩色馬蹄蓮黃色品種Best Gold 返青過程中,佛焰苞內的質體形態逐步發生變化,即有色體逐步轉變為功能葉綠體[6];與此同時,佛焰苞外緣綠色程度加深、葉綠素含量增多以及類胡蘿卜素含量降低[3]。這與本研究黃色品種Florex Gold 返青過程中的生理變化一致。究其原因,可能是由于黃色品種Florex Gold在盛花期(S1)時,佛焰苞內的質體以有色體為主,有色體內含有大量類胡蘿卜素,使佛焰苞呈現黃色表型;返青初期(S2)時,佛焰苞內的有色體開始向葉綠體轉變,此時有色體減少,類胡蘿卜素含量降低,葉綠體增加,葉綠素含量升高,使佛焰苞由黃色逐漸轉變為綠色;返青后期(S3)時,佛焰苞內的質體以葉綠體為主,葉綠體內含有大量葉綠素,使佛焰苞呈現綠色表型。綜上,本研究結果從表型方面闡述了佛焰苞返青現象產生的原因。
前人研究表明,彩色馬蹄蓮黃色品種Best Gold 佛焰苞的返青現象開始于S1 期后的2~3 d[3],這與本研究中黃色品種Florex Gold 佛焰苞離體孔片的返青過程一致。處于S1 期的馬蹄蓮佛焰苞外表皮著色均勻,尚未出現綠色,與S2、S3期相比,葉綠素含量最少。由S1向S2轉變的時期是葉綠素生物合成的關鍵時期,以S1期的佛焰苞作為侵染材料,選用葉綠素合成關鍵基因作為構建馬蹄蓮佛焰苞VIGS體系的指示基因,最容易觀測到沉默后表型顏色的變化情況。理論上沉默后可以暫時抑制葉綠素的合成與積累,達到延緩綠色表型出現的效果[28],本研究所得結果與理論一致。
VIGS 在園藝植物中被廣泛應用,侵染材料常選擇種球和幼苗等植物組織。例如,利用種球作為侵染材料的唐菖蒲(Gladiolus hybridus)[29],以及利用7 周齡幼苗作為侵染材料的罌粟(California poppy)[30]。除上述植物組織外,還可以采用切花甚至瓣片等離體植物組織作為侵染材料。例如,瓜葉菊(Senecio cruentus)采用切花作為浸染材料,通過花葶注射和真空浸潤頭狀花序成功沉默花青素途徑基因ScANS使花色改變[28];玫瑰(Rosa hybrida)采用切花和瓣片作為浸染材料,通過真空法成功沉默與花衰老有關的基因RhWRKY33,使植株延緩衰老[31]。
采用切花或瓣片進行VIGS體系構建,相較于種球或幼苗而言,材料更易獲取,并且見效更快,能夠有效避免侵染種球或幼苗后成花過程太久導致的病毒失效問題,同時便于發現問題并及時優化體系。前人研究發現,佛焰苞的切花與瓣片在返青過程中外表皮均由黃轉綠,變化趨勢一致[7],因此本研究選取了體積更小更易操作的佛焰苞瓣片為試驗材料,利用14 mm 打孔器保證取材的均一以及規整。在同一時空內,植物葉片尖端的衰老先于基部[32],衰老部位的細胞分裂和代謝能力較差。彩色馬蹄蓮的佛焰苞本質是變態葉,本研究中對佛焰苞中部孔片的延緩返青效果高于上部孔片,推測可能是由于較上部而言,中部組織更幼嫩,細胞活力更強。在特定范圍內,真空條件下侵染植物組織時間越長,沉默效果越好。例如,小麥幼苗和玉米幼苗在無真空條件下侵染的沉默效率低于真空條件下侵染的沉默效率[33]。本研究中佛焰苞孔片在真空5 min條件下的侵染效率高于3 min,與上述結論相符。
本研究驗證了彩色馬蹄蓮葉綠素合成關鍵基因的功能,成功構建了馬蹄蓮的離體VIGS 體系,為進一步探索彩色馬蹄蓮佛焰苞返青基因的功能提供了技術支持。
4 結論
本研究針對彩色馬蹄蓮現有穩定遺傳轉化體系不成熟,無法驗證基因功能等問題,采用優化的試驗體系對葉綠素合成關鍵基因ZhGluTR和ZhChlH進行沉默,構建彩色馬蹄蓮佛焰苞離體VIGS 技術體系;測定3 種菌液侵染后各個試驗組中孔片的表型、色差值以及色素含量。綜合得出最佳處理方式為對佛焰苞中部真空處理5 min,即該方式延遲返青的效果最好。

