黃顙魚源維氏氣單胞菌的分離、鑒定及特性分析
王潤萍 許航榮 潘 杰 鐘智威 萬 根 阮記明
(江西農業大學動物科學技術學院,江西 南昌 330045)
黃顙魚(Pelteobagrus fulvidraco)又名黃辣丁、黃姑魚、黃鰭魚等,屬鲇形目(Siluriformes)黃顙魚屬(Pelteobagrus),是我國具重要經濟價值的淡水名特優水產養殖品種[1]。黃顙魚肉質鮮美、無魚鱗和肌間刺,營養價值高,高蛋白、低脂肪且富含鈣、磷、鉀等微量元素,具有降血壓、提高免疫力和預防貧血等重要的藥用價值[2]。隨著近年來黃顙魚養殖技術逐漸成熟、養殖品種不斷優化,黃顙魚集約化養殖快速發展。但由于養殖密度高、環境負荷重,直接導致細菌引起的傳染性疾病迅速增加,且頻繁暴發。目前已有報道的黃顙魚主要細菌性疾病包括紅頭病[3]、出血病[4]、腹水病[5]等。腹水病,也叫“大肚子”病,是黃顙魚養殖過程中一種急性傳染病,發病速度快、發病范圍廣、發病率和死亡率高[6-7]。然而,目前報道中引起腹水病的病原菌并不唯一,包括愛德華氏菌[8]、嗜水氣單胞菌[9]等,給預防和治療都帶來了困難,造成巨大經濟損失,并且嚴重制約了黃顙魚養殖業的發展。另外,同種的病原菌在耐藥性上存在時間和地域上差異,進一步加深了治療的難度。因此,對于黃顙魚腹水病病理特征、病原菌種類及菌株特性進行深入研究具有重要意義。
2021年3—5月,江西南昌縣多個黃顙魚養殖場爆發大規模腹水病,死亡率高,治愈困難。為查清病原,本研究對患病樣本進行采集和解剖分析,對病原菌進行分離、鑒定;同時對菌株藥敏特性、攜帶毒力基因的情況等進行初步分析,旨在為更深入地研究腹水病致病機理提供理論依據,同時為該類細菌性疾病的防治提供科學的參考依據。
1 材料與方法
1.1 試驗材料與試劑
1.1.1 試驗動物 試驗用病魚、健康魚均從南昌市南昌縣某養殖場采集,魚體平均體長15~18 cm,體重17~20 g。
1.1.2 主要試劑 蛋白胨、酵母粉、0.9%生理鹽水、細菌基因組DNA 提取試劑盒[寶生物工程(大連)有限生物公司]、2×Taq PCR Mix(北京索萊寶科技有限公司)、Goldview 染料(北京索萊寶科技有限公司)、藥敏片(杭州微生物試劑有限公司)、波恩氏固定液等。肉膏蛋白胨(Luria-Bertani, LB)培養基:胰蛋白胨10 g·L-1、酵母粉5 g·L-1、NaCl 10 g、瓊脂20 g·L-1(固體平板),pH值7.2。16S rDNA 通用引物:27F:5′-AGAGTTTGATC ATGGCTCAG-3′;1492R:5′-TACGGTTACCTTGTTAC GACTT-3′。
1.2 試驗方法
1.2.1 癥狀及組織病理觀察 將病魚和健康魚的體表沖洗干凈,無菌條件下分別剖取病魚、健康魚的鰓絲、肝、脾、腎、腸等組織塊(1 cm×1 cm×1 cm),在波恩氏液中固定24 h,送至武漢賽維爾生物科技有限公司進行蘇木精-伊紅法染色(Hematoxylin Eosin staining,HE)、切片、拍照和分析。
1.2.2 病原菌的分離和純化 將病魚于無菌操作臺中進行解剖,取肝臟、腎臟及腸道組織進行勻漿,0.9%生理鹽水進行梯度稀釋,取上清液于LB 平板涂布,28 ℃條件下培養過夜,挑選培養基上大小、形態及顏色不同的菌落,進行2~3 次分離純化,獲得純菌株,-80 ℃條件下保藏備用。
1.2.3 16S rDNA 測序分析及進化樹構建 將純化好的菌接種于LB 液體培養基,28 ℃、150 r·min-1條件下振蕩培養過夜。離心收集細菌并提取總DNA,以菌體總DNA 為模板,采用通用引物進行16S rDNA 的PCR擴增。PCR 反應體系為50 μL:DNA 模板1 μL,10 μmol·L-1引物各1 μL,2× Taq PCR Mix 25 μL,雙蒸水補至50 μL。PCR 條件:95 ℃預變性3 min,95 ℃變性30 s,57 ℃退火30 s,72 ℃延伸90 s,共32 個循環,72 ℃延伸5 min。PCR反應產物經1.2%瓊脂糖凝膠電泳檢測擴增產物,將合格產物送至生工生物工程(上海)股份有限公司進行測序。將測序列結果在NCBI 進行Blast比對,根據同源性序列比對結果確定菌株分類;其次,選取模式菌株16S rDNA 序列,采用MEGA7.0 中鄰接法(Neighbor-Joining,NJ)進行系統進化樹的構建,置信度檢驗(Bootstrap)為1 000。
1.2.4 人工回復感染 挑取分離菌株單菌落于腦心浸液培養基(brain heart infusion medium,BHI)中,28 ℃培養約20 h,取1 mL 菌液,6 000×g離心3 min,用1×磷酸鹽緩沖液(phosphate buffered saline, PBS)洗2次后,用1 mL PBS 重懸。菌液初始濃度為1×108CFU·mL-1,進行10倍梯度稀釋至1×107、1×106、1×105、1×104CFU·mL-1,進行攻毒,一組注射PBS 作為對照組;每組10 尾魚,每尾魚注射100 μL,水溫(20±1) ℃,連續觀察7 d。統計患病情況和死亡率,同時對感染患病魚進行病原菌分離鑒定。
1.2.5 菌株的藥敏試驗 采用藥敏紙片擴散法(Kirby-Bauer,K-B)[10],將分離獲得的菌液涂布在LB平板上,依次將各藥敏紙片緊貼于培養基,并做好標記。倒置放于37 ℃培養24 h,分別測量各個抗菌藥物的抑菌圈直徑,計算平均值。
1.2.6 菌株毒力基因分布 參照Wang 等[11]的方法,提取細菌基因組DNA 作為模板,分別對菌株氣溶素(aerA)、細胞毒性腸毒素(act)、鞭毛(fla)、熱穩定細胞腸毒素(ast)、甘油磷脂膽固醇酰基轉移酶(gcaT)、絲氨酸蛋白酶(ser)、Ⅲ型分泌系統基因(ascV)、脂肪酶(lip)及核酸酶(exu)共9 種毒力基因進行擴增。引物序列及擴增片段大小見表1[12],引物由生工生物工程(上海)股份有限公司合成。

表1 本研究所用引物序列Table 1 The sequences of primers used in this study
2 結果與分析
2.1 病癥及組織病理學觀察
臨床觀察發現,魚體表無明顯的傷痕,鏡檢體表、鰓及其他組織未發現寄生蟲感染。腹部膨脹明顯(圖1-a);肛門發炎,紅腫突出(圖1-a、b)。解剖后觀察未發現寄生蟲,腹腔內充滿黃色透明、果凍狀粘液;膽囊腫大發黑;腸道空腸,腸壁變薄、甚至透明;肝臟發黃;部分病魚的腸道、胃等內臟有大量出血點(圖1-c)。
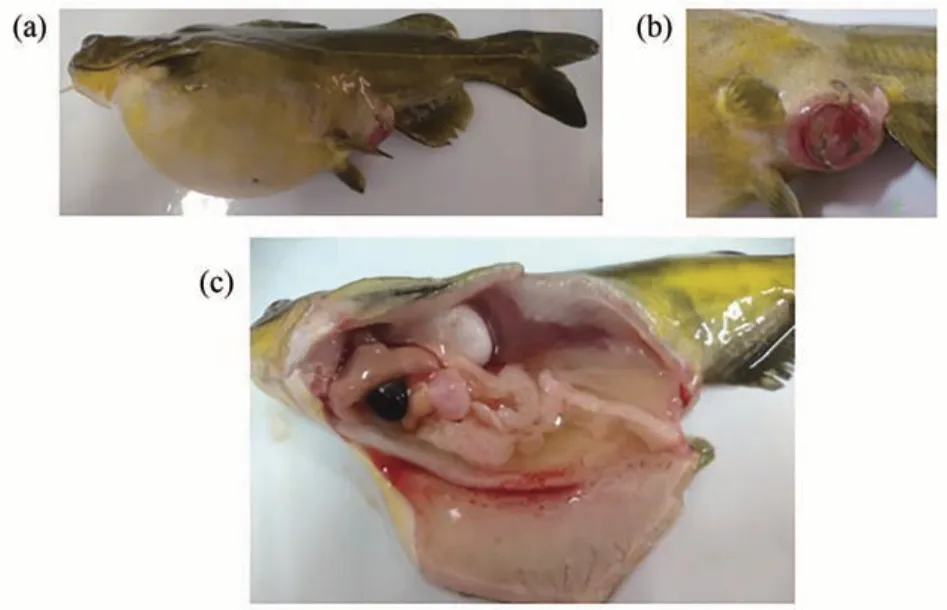
圖1 黃顙魚腹水病臨床癥狀Fig.1 Clinical symptoms of naturally infected ascites P.fulvidraco
顯微觀察可見,患病黃顙魚的鰓小片上皮細胞嚴重受損,大量壞死、脫落;柱細胞排列扭曲,部分脫落、彌散;鰓小片扭曲、斷裂;鰓絲間充滿彌散、壞死的細胞(圖2-a)。健康黃顙魚的鰓絲和鰓小片有規律地沿一個方向緊密排列,鰓組織結構完整,鰓絲間隙清晰,鰓小片上皮細胞排列緊密、規律、完整(圖2-b)。
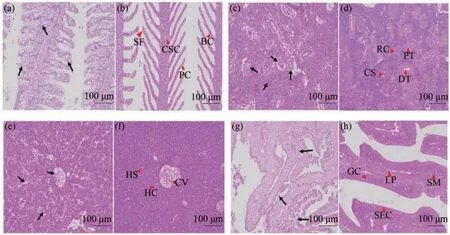
圖2 黃顙魚組織切片觀察(×200)Fig.2 Histological section observation of P.fulvidraco (×200)
腎組織中,患病黃顙魚腎小球萎縮,腎小管擴張、內刷狀緣結構消失、上皮細胞壞死、脫落;腎間質有炎性細胞浸潤(圖2-c)。健康黃顙魚腎組織結構完整,清晰;腎小球飽滿,邊界清晰;腎小管內刷狀緣結構完整(圖2-d)。
肝組織中,患病黃顙魚肝組織部分區域出現空泡,肝細胞排列紊亂、大量壞死;中央靜脈周圍細胞出現彌散,內皮脫落;肝板結構斷裂;肝血竇擴張(圖2-e)。健康黃顙魚細胞肝板由中央靜脈向四周呈輻射狀散開且結構紋路規則,血管內紅細胞充盈(圖2-f)。
腸道組織中,患病黃顙魚腸絨毛上皮細胞脫落、彌散;杯狀細胞消失,固有層、粘膜下層細胞壞死、脫落;腸絨毛脫落、彌散(圖2-g)。健康黃顙魚腸道結構完整、清晰,杯狀細胞清晰、規律排列(圖2-h)。
2.2 病原菌的分離鑒定及回感
由LB 平板分離純化獲得形態、大小相同的菌株1 株,菌命名為PL1。菌株PL1 在LB 平板,28 ℃培養24 h,菌落呈乳黃色、圓形,表明光滑、濕潤,邊緣整齊(圖3)。
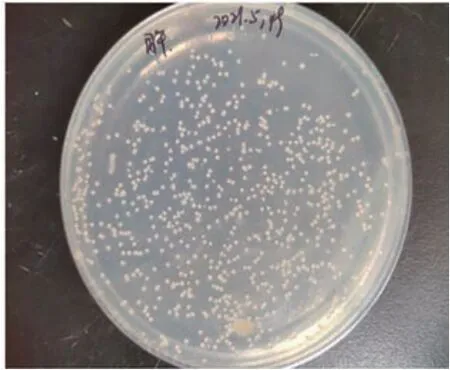
圖3 菌株PL1在LB培養基上菌落形態Fig.3 Colony morphologies of the strain PL1 on LB plate
對菌株PL1 的16s rDNA 進行擴增獲得長1 342 bp片段,經過測序及NCBI中BLAST比對表明菌株PL1與維氏氣單胞菌Aeromonas veronii同源性最高,相似度為99.85%。同時利用軟件MEGA7.0(NJ 法)構建系統進化樹,結果表明菌株PL1 與維氏氣單胞菌聚為一支(圖4)。最終確定菌株PL1為維氏氣單胞菌A.veronii。
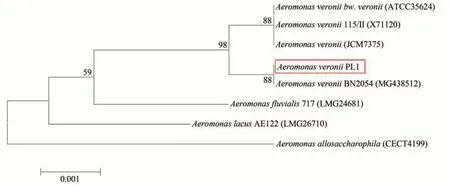
圖4 菌株PL1 16S rDNA序列進化樹Fig.4 Phylogenetic tree based on 16S rDNA sequence of the strain PL1
通過人工回歸感染試驗發現,對照組生長良好,無發病癥狀(圖5-a),注射菌株PL1試驗組黃顙魚出現明顯病癥:泄殖孔發炎突出,腹部膨大(圖5-b),解剖有大量腹水(圖5-c)。注射菌體濃度為1×106、1×107CFU·L-1組的黃顙魚,均在感染72 h 后全部死亡,并且從發病魚的肝、腎中再次分離獲得菌株PL1。表明菌株PL1 為本次黃顙魚腹水病主要病原菌。

圖5 人工感染黃顙魚癥狀Fig.5 Symptoms of artificially infected P.fulvidraco
2.3 藥敏試驗
菌株A.veroniiPL1 對30 種藥物的藥敏試驗結果顯示(表2),其對多粘菌素、復方新諾明、呋喃唑酮、氯霉素、頭孢曲松、頭孢哌酮、丁胺卡那、慶大霉素、卡那霉素、新霉素、頭孢呋辛、頭孢他啶等12 種抗生素敏感,其中對復方新諾明、氯霉素、頭孢曲松及頭孢哌酮4 種抗生素最為敏感(圖6)。對氧氟沙星、紅霉素和哌拉西林3 種抗生素中度敏感;對麥迪霉素、諾氟沙星、環丙沙星、萬古霉素、青霉素、克林霉素、四環素、多西環素、米諾環素、苯唑西林、氨芐西林、羧芐西林、頭孢氨芐、頭孢唑林及頭孢拉定等15 種抗生素具有耐受性。

圖6 K-B平板法藥敏試驗結果Fig.6 Drug sensitive test results of K-B plate method
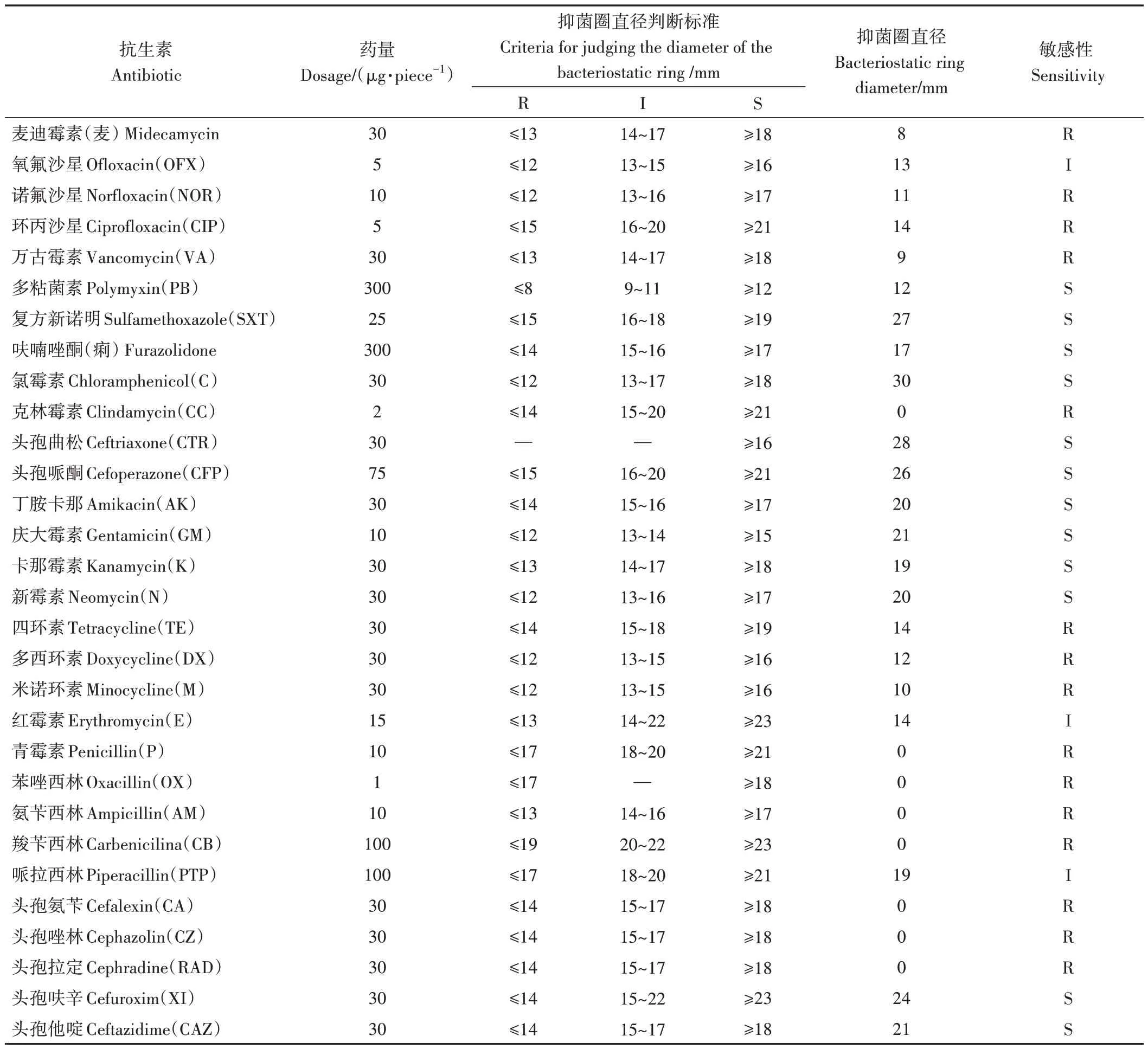
表2 維氏氣單胞菌PL1藥敏試驗結果Table 2 Drug sensitive test results of the strain A.veronii PL1
2.4 毒力基因檢測
由圖7 可知,在檢測的9 種毒力基因中,共檢測到6 種毒力因子基因:aerA、act、gcaT、Ser、fla、ascV;未檢測到ast、lip、exu3種毒力基因。
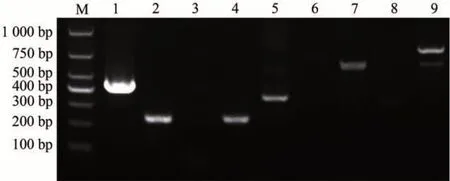
圖7 菌株A.veronii PL1毒力基因PCR擴增結果Fig.7 PCR amplification results of the strain A.veronii PL1
3 討論
腹水病已成為水產養殖中一種常見的危害性極大的傳染性疾病,目前已有大量水生生物患腹水病的報道,如異育銀鯽(Carassais auratus gibebio)[13]、大鯢(Andrias davidianus)[14]、牙鲆(Paralichthys olivaceus)[15]、日本鰻鱺(Anguilla japonicus)[16]、半滑舌鰨(Cynoglossus semilaevis)[17]等。根據目前發現病例及文獻報道,腹水病主要特征為魚體腹部膨大,腸道內無食物,腹腔內有積液。而根據有無出血及肛門紅腫、潰爛等可以將腹水病分為溶血性腹水病和非溶血性腹水病,其中溶血性腹水病主要由細菌感染引起,非溶血性腹水病由營養代謝異常引發[18]。本研究中,病魚主要癥狀表現為腹部膨大,魚體消瘦,肛門紅腫突出,腸道無食物,腹腔大量腹水,腹水離體后呈現凝膠狀。可見,本研究中黃顙魚(P.fulvidraco)腹水病為細菌溶血性腹水病。顯微觀察發現,患病黃顙魚各組織均有不同程度損傷:肝臟、腎臟及腸道組織中均存在細胞空泡、細胞壞死、脫落,紅細胞浸潤等共同特點,進一步證實了魚體腹水的形成可能與肝、腎以及腸組織的病變密切相關[19]。
本研究從腹水病黃顙魚肝臟、腎臟中分離獲得病原菌,腹水中未發現細菌存在,經鑒定表明病原菌為維氏氣單胞菌A.veronii。維氏氣單胞菌是一種重要的人、畜及水生生物共患性病原菌,能夠引起中華鱉(Trionyx sinensis)軟殼病[20]、異育銀鯽(C.gibebio)死亡[21]、草魚(Ctenopharyngodon idellus)膿毒癥[22]、尼羅羅非魚(Oreochromis niloticus)死亡[23]等危害,還可引起人類胃腸炎、軟組織感染、敗血癥和外傷感染等病癥,對水產養殖業造成巨大經濟損失的同時嚴重威脅著人類的安全與健康[24-25]。本研究中,菌株A.veroniiPL1對復方新諾明、氯霉素、頭孢曲松和頭孢哌酮這4種抗生素敏感性最強,但其中氯霉素是水產養殖的禁用藥,因此,其余3 種抗生素可在實際生產中用于該病的治療。另外,該菌株對麥迪霉素、諾氟沙星、環丙沙星等15 種抗菌藥物具有耐藥性,呈現多重耐藥現象,與以往研究相比耐藥性呈現出增強趨勢[26-27]。推測可能與養殖過程中長期使用抗生素致使耐藥性增強相關,因此,在生產實踐過程中,必須科學合理有效的使用漁藥。同時,有必要對維氏氣單胞菌的致病機理進行更深入研究,為開發預防疫苗、快速診斷試劑盒以及一些新型抗菌藥物等提供依據。
有關研究表明,A.veronii致病性與毒力基因的存在關系密切[28]。宋明芳等[29]研究表明氣單胞菌具有多中毒力基因,能夠表達分泌氣溶素、腸毒素、胞外蛋白等多種毒力因子。其中,氣溶素基因(aerA)是維氏氣單胞菌最重要、最豐富的毒力基因之一,其編碼的蛋白具有很強的細胞毒性、溶血性和腸毒性,可破壞宿主細胞膜通透性,裂解細胞[30]。前人研究表明,嗜水氣單胞菌中的氣溶素能夠干擾人類腸上皮緊密連接的完整性和細胞損傷修復過程[31]。其次,細菌腸毒素可以引起人、畜、畜禽腸道上皮細胞代謝紊亂,黏膜結構破壞,導致功能失調,引起腹瀉等病癥。腸毒素包括細胞毒性腸毒素(cytotoxic enterotoxin,Act)、熱不穩定性腸毒素(heat-labile cytotonic enterotoxin,Alt)和熱穩定性腸毒素(heat-stable cytotonic enterotoxin,Ast)。其中,腸毒素基因能夠提高巨噬細胞細胞系中腫瘤壞死因子(tumor necrosis factor,TNF)和白細胞介素 1(interleukin 1,IL-1)以及組織溶解產生的其他炎癥細胞因子的水平[32]。gcaT和ascV基因編碼的分泌蛋白,在氣單胞菌感染的致病性中起重要作用[33]。大多數氣單胞菌都能在極性鞭毛作用下運動。細菌運動能力是氣單胞菌重要的毒力因子,因此鞭毛基因fla也是病原菌重要的毒力基因之一[33]。本研究中,菌株A.veroniiPL 攜帶aerA、act、gcaT、ser、fla及ascV多種毒力基因,表明菌株PL1可通過表達毒力因子,導致魚腸道炎癥、充血、消化吸收受阻,引起黃顙魚腹水病癥。綜合上述基因分析結果表明,菌株PL 具有較強毒力,人工回歸感染也表明該菌株具有較強的致病性,能夠引發黃顙魚腹水病,造成死亡。而關于其致病途徑和機理有待進一步研究。
4 結論
本試驗從患有典型腹水病黃顙魚體內分離出1 株優勢菌PL1,對其進行了分離鑒定、回歸感染以及耐藥性、毒力基因分析。通過16S rDNA 序列比對及系統發育樹構建結果表明菌株PL1為維氏氣單胞菌。回歸感染試驗結果發現注射菌株PL1的黃顙魚表現出與自然發病相同的典型腹水病臨床癥狀:腹部膨大、腹腔內積水,表明該菌株為此次黃顙魚腹水病主要病原菌。毒力基因分析表明,菌株PL1 攜帶有aerA、act、gcaT、ser、fla、ascV等6 種毒力基因,具有較強毒力。耐藥性試驗結果表明菌株PL1對復方新諾明、氯霉素和頭孢曲松、頭孢哌酮敏感性最好,但同時對多達15 種抗生素產生耐藥性,呈現出多重耐藥性。

