經顱直流電刺激對骨關節炎慢性疼痛模型大鼠的鎮痛作用及其機制
葉銀霜 徐佳微 王琳 李鐵山
(青島大學附屬醫院康復二科,山東 青島 266003)
骨關節炎(osteoarthritis, OA)是臨床上常見的慢性關節退變疾病,也是導致慢性疼痛最常見的原因之一[1]。疼痛會嚴重影響患者的生活質量,是OA患者就診的主要原因[2]。目前,OA疼痛的治療手段包括藥物和非藥物治療,如運動療法與非甾體抗炎藥物和鎮痛藥治療等[3],但是這些治療僅可以暫時緩解或減輕患者的疼痛[4]。OA疼痛的機制十分復雜,研究發現,OA慢性疼痛不僅是由局部關節結構的病變引起,可能還與中樞神經回路的變化有關[5]。經顱直流電刺激(tDCS)是一種中樞調控技術,具有非侵入性、無痛性和相對安全的特點,在臨床應用于諸如重度抑郁癥等多種疾病的治療[6]。tDCS將微弱直流電通過兩個電極從顱骨傳遞到大腦皮質,調節大腦皮質神經元的興奮性,使神經組織極化[7],從而發揮治療慢性疼痛的作用[8]。研究顯示,tDCS治療膝部OA患者時,能有效緩解患者的慢性疼痛[9],但其機制尚不清楚。本研究通過分析tDCS對OA慢性疼痛大鼠的疼痛行為及腦源性神經營養因子(BDNF)的影響,進一步探討tDCS對OA慢性疼痛的治療效果及其作用機制。
1 材料與方法
1.1 實驗動物、儀器與試劑
健康雄性SD大鼠36只,體質量(200±20)g,購于濟南朋悅實驗動物繁育有限公司。所有大鼠適應性飼養1周以后進行實驗。熱輻射刺激儀(山東益延科技有限公司),Von Frey Hair測試儀(North Coast公司,美國),單碘乙酸鈉(MIA,Sigma公司,美國),兔抗大鼠BDNF抗體(Abcam公司,美國),GAPDH(上海泊灣生物科技有限公司),HRP標記的山羊抗兔IgG二抗(北京博奧森生物技術有限公司),凝膠成像分析系統(UVP公司,美國)。
1.2 大鼠的分組和處理
所有大鼠隨機分為假手術組、MIA組、tDCS組和假tDCS組,每組9只。假手術組大鼠于左膝膝下韌帶處向關節腔內注射60 μL的生理鹽水;MIA組、tDCS組和假tDCS組大鼠于左膝膝下韌帶處向關節腔內注射60 μL濃度80 g/L的MIA,構建OA慢性疼痛模型[10]。在標準動物房內常規飼養21 d。在MIA注射后第21天時,將tDCS儀器的陰極用膠帶固定于tDCS組大鼠雙眼外側角的中點(眶上區域),陽極固定于兩耳之間(大鼠的頂葉皮質),電流輸出設為恒定0.5 mA,進行tDCS治療[11],每天20 min,連續8 d[11];假tDCS組大鼠以同樣的方法固定陰陽電極,但無電流輸出。假手術組和MIA組大鼠不做任何處理,常規飼養。
1.3 疼痛行為學測試
從各組大鼠中隨機取出6只,分別于治療結束后第1、2、7天時進行疼痛行為學測試。①機械痛撤足閾值(PWT)測試:測試前,所有的大鼠均先放置于底部為金屬網的有機玻璃罩里適應20 min,采用Von Frey Hair測試儀通過up-down方法來進行評估[12]。記錄最終Von Frey Hair值代入專用公式評估各組大鼠的PWT值。②熱痛閾潛伏期(PWL)測試:測試前,所有大鼠均先放置在未加熱的熱輻射刺激儀中適應5 min,然后加熱熱輻射刺激儀使其表面維持在恒定溫度(55.0±0.1)℃,大鼠第一次行為反應(包括舔腳、跳躍、快速移走爪子)的時間即為PWL[13]。
1.4 免疫蛋白印跡檢測
從各組大鼠中隨機取出3只,于治療結束后第2天麻醉處死,然后迅速取出中腦導水管周圍灰質(PAG)組織,置于RIPA裂解液中冰上裂解30 min,離心取上清液,并置于100 ℃恒溫金屬浴中孵育10 min,制備為蛋白樣品。采用BCA蛋白測定試劑盒檢測蛋白濃度。等量的各組蛋白樣品進行電泳、轉膜、封閉后,加入BDNF抗體(1∶1 000)或GAPDH抗體(1∶5 000)于4 ℃下孵育過夜。第2天,洗膜后加入二抗(1∶5 000)于室溫下孵育2 h。最后,使用增強化學發光ECL試劑對條帶進行顯影,采用Image J軟件對圖像進行分析。
1.5 統計學處理
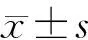
2 結 果
2.1 MIA和tDCS對各組大鼠PWL的影響
重復測量雙因素方差分析結果顯示,時間、時間與分組交互作用對大鼠PWL均無明顯影響(P>0.05),分組對大鼠PWL有明顯影響(F組別=42.72,P<0.01)。組間比較結果顯示,在治療結束后第1、2、7天時,各組大鼠的PWL差異均有顯著性(F=11.25~21.48,P<0.01);各時間點兩兩比較結果顯示,MIA組與假手術組、tDCS組與假tDCS組PWL差異均有顯著性(P<0.01),MIA組與假tDCS組差異無顯著性(P>0.05)。見表1。
2.2 MIA和tDCS對各組大鼠PWT的影響
重復測量雙因素方差分析結果顯示,時間、時間與分組交互作用對大鼠的PWT無明顯影響(P>0.05),分組對大鼠PWT則有明顯的影響(F組別=330.91,P<0.01)。組間比較顯示,治療結束后第1、2、7天時,各組大鼠PWT差異均有顯著性(F=54.42~186.40,P<0.01);各時間點的兩兩比較結果顯示,MIA組與假手術組、tDCS組與假tDCS組的PWT比較差異均有顯著性(P<0.01)。見表1。

表1 各組大鼠治療后不同時間點PWL和PWT比較
2.3 tDCS對各組大鼠PAG組織中BDNF蛋白表達水平的影響
免疫蛋白印跡檢測結果顯示,在tDCS治療結束后第2天,假手術組、MIA組、tDCS組和假tDCS組大鼠PAG組織中BDNF蛋白相對表達量分別為0.52±0.12、0.95±0.10、0.68±0.05、1.02±0.03,組間比較差異均有統計學意義(F=24.70,P<0.01)。其中,MIA組與假手術組、tDCS組與假tDCS組的PAG組織中BDNF蛋白表達量比較差異有顯著性(P<0.01)。見圖1。

A:假手術組,B:MIA組,C:tDCS組,D:假tDCS組
3 討 論
OA是臨床常見的慢性疾病,其引起的疼痛也是導致骨骼肌肉慢性疼痛的原因之一。tDCS作為一種非侵入性的、安全的中樞調控技術已應用于多種慢性疼痛的治療[8],但是其鎮痛機制目前尚未完全闡明。因此進一步探究tDCS對OA慢性疼痛的治療作用及其機制,對臨床上應用tDCS治療OA慢性疼痛具有重要意義。
目前,已有多種動物模型用于研究OA慢性疼痛。其中,關節腔內注射MIA是目前研究OA慢性疼痛最常用動物模型[14]。研究發現,關節腔內注射高劑量MIA(4.8 mg)會導致大鼠的后爪支撐力分布不對稱和持續性疼痛[10],這與晚期OA患者持續性慢性疼痛的臨床表現相似。本研究通過向大鼠膝關節腔內注射高劑量MIA建立OA慢性疼痛模型,并在MIA注射后第21天時,使用tDCS進行為期8 d的治療,在治療結束后第1、2、7天時對各組大鼠的疼痛行為學進行測試。既往研究表明,PWL測試主要評估大鼠的熱痛閾來反映脊髓的感覺整合能力[15];而PWT測試主要通過評估大鼠機械痛閾來反映脊髓反射情況,以及更復雜的脊髓上感覺整合能力[16]。本研究疼痛行為學測試結果顯示,與假手術組相比,MIA組大鼠的PWL和PWT均明顯降低;與假tDCS組相比,tDCS組大鼠的PWL以及PWT在治療結束后第1天就出現明顯升高,并且在治療結束后第7天仍明顯升高。這表明,tDCS可以有效緩解MIA大鼠誘導的OA慢性疼痛,并且其治療作用可以持續到治療結束后第7天。
BDNF是神經營養因子家族中的重要成員,是重要的疼痛調節劑,并在慢性疼痛的發生中起著至關重要的作用[17]。在坐骨神經結扎模型中,過表達的BDNF可以通過酪氨酸激酶B受體(TrkB)信號在脊髓中產生持久的神經興奮性變化,并參與痛覺過敏的產生和維持[18]。行為藥理學和電生理學研究示,PAG神經元中BDNF可以通過PAG-RVM通路在腦干的疼痛下行調節中發揮重要的作用[19]。PAG是疼痛下行調節通路的關鍵部位,在疼痛調節通路中起重要作用。本研究的免疫印跡結果顯示,與假手術組相比,MIA組大鼠PAG組織中BDNF蛋白表達水平顯著升高,提示PAG組織中BDNF過表達可能是MIA誘導的OA大鼠慢性疼痛的發生原因之一。
既往研究表明,tDCS可以通過調節自發神經元的放電,使神經元的興奮性發生改變,從而緩解疼痛[20]。而BDNF在中樞神經元超興奮性的啟動和維持方面發揮著重要作用[21-22]。在持續性炎性疼痛大鼠模型中,中縫大核中的BDNF表達上調,上調的BDNF會使該部位膜上氯化鉀共轉運蛋白的表達減少,致使細胞內Cl-含量增加,γ-氨基丁酸能神經元的抑制作用減弱,最終導致神經元過度興奮及疼痛敏化的發生[23]。有研究顯示,tDCS的作用不僅局限于電極正下方的大腦皮質區域,還可產生更廣泛的神經網絡調控作用,包括扣帶回、丘腦以及PAG等區域[16]。SOUZA等[24]研究發現,tDCS的抗痛覺過敏作用與腦干的疼痛下行抑制通路有關。
此外,SCARABELOT等[20]還發現,tDCS可以調節由口面部慢性疼痛誘導的神經可塑性改變,減少腦干中BDNF和TrkB的相互作用,以緩解疼痛。但PAG組織中BDNF在tDCS鎮痛中的作用,目前較少有研究報道。本研究結果顯示,經過連續8 d的tDCS治療,tDCS組與假tDCS組比較,大鼠PAG組織中BDNF的表達水平顯著降低。這表明tDCS可能是通過下調MIA誘導的OA慢性疼痛大鼠的PAG組織中BDNF表達水平,降低PAG組織中神經元興奮性,從而發揮鎮痛作用。
綜上所述,tDCS能夠有效緩解MIA大鼠誘導的OA慢性疼痛,并且治療作用可以持續到治療結束后第7天。此外,其鎮痛機制可能與下調大鼠的PAG組織中BDNF表達,降低PAG組織中神經元興奮性有關系。但是tDCS在下調PAG組織中BDNF表達后是如何降低PAG組織中神經元興奮性來發揮鎮痛作用的,還需要進一步的研究確定。
倫理批準和動物權利聲明:本研究涉及的所有動物實驗均已通過青島大學實驗動物福利倫理委員會的審核批準(文件號NO.20210820-SD6420211114067)。所有實驗過程均遵照《實驗動物管理條例》的規定進行。
作者聲明:葉銀霜、李鐵山參與了研究設計;葉銀霜、徐佳微、王琳參與了論文的寫作和修改。所有作者均閱讀并同意發表該論文。所有作者均聲明不存在利益沖突。

