肺腺癌胸腔積液DNA倍體異常與EGFR突變的關系及其對患者預后的影響
劉 穎,王 蕊,郭 曉,董律吏,張 艷,趙銀環,杜 蕓
(河北醫科大學第四醫院癌檢中心,河北石家莊 050011)
肺癌是導致癌癥相關死亡的主要原因[1-2],肺腺癌是肺癌中最常見的病理類型。晚期肺腺癌患者往往具有胸腔積液轉移,轉移性腫瘤細胞惡性程度越高,染色體越不穩定,DNA倍體異常細胞越多。應用計算機輔助DNA 倍體分析可以測定腫瘤細胞核的DNA 含量,計數胸腔積液中DNA倍體異常細胞。肺腺癌中最常見的驅動基因突變是表皮生長因子受體(epidermal growth factor receptor,EGFR),在亞洲人中EGFR突變率為40%~62%[2]。EGFR突變狀態與肺腺癌生物學行為及預后相關,然而研究結果并不一致。DNA倍體異常通常用于輔助細胞病理學的診斷,已有研究表明DNA 倍體異常可能影響肺腺癌患者的預后[3],DNA 倍體異常與腫瘤增殖密切相關,腫瘤細胞增殖一般伴有染色體數量和結構異常[4],但對于DNA 倍體異常與EGFR突變之間的關系卻少見報道。本研究將肺腺癌患者胸腔積液中的肺腺癌細胞用于DNA倍體分析和基因檢測,分析癌細胞的DNA 倍體異常和EGFR突變之間的關系,并探究其對患者預后的影響。
1 材料與方法
1.1 病例收集
本研究采用回顧性分析來自河北醫科大學第四醫院2012年1月—2019年12月期間439例肺腺癌患者的臨床資料。患者的入選標準包括:①經細胞病理學診斷及免疫細胞化學確診為胸腔積液肺腺癌轉移;②單發肺癌;③有明確的DNA 倍體分析及EGFR基因突變檢測結果。所有患者均隨訪至死亡或研究截止日期(2019年12月31 日),統計患者的總生存期(overall survival,OS),即確診肺腺癌至患者出現死亡或本研究截止日期。本研究經過河北醫科大學第四醫院倫理委員會批準(批準文號2019MEC102),且臨床資料收集均已獲得患者知情同意書。吸煙史定義為入院前平均每天吸煙≥1支,且持續時間超過6個月。
1.2 胸水的處理
用一次性細胞采集器富集胸腔積液中的腫瘤細胞,制作涂片,進行HE 染色。并采用免疫細胞化學法[5],選擇NapsinA、TTF1、P40、P63、Syn、CD56、CEA、WT1等抗體診斷肺腺癌胸腔積液轉移。本實驗所有抗體均為即用型抗體,均購自福州邁新公司。
1.3 計算機輔助DNA倍體分析
制作胸腔積液涂片進行Feulgen 染色,使用購自武漢蘭丁的計算機輔助DNA圖像定量分析系統(DNAICM)檢測染色細胞核的集成光密度(integrated optical density,IOD)來測定細胞核DNA 含量,用DNA 指數(DNA index,DI)來表示DNA含量[6]。DI為腫瘤細胞核DNA均值與正常細胞DNA均值的比值,它反映了腫瘤細胞總DNA含量的相對水平。DI計算公式如下:
正常細胞的DI 是2c(1c 為正常G0/G1 組DNA 含量的一半,因此G0/G1 細胞為2c 細胞,即二倍體細胞)。大于5c 細胞(5 倍體細胞)被判斷為DNA 倍體異常細胞。計算大于5c 細胞的百分比,即DNA 含量大于5c的細胞數量/DNA 含量大于2c 的細胞數量×100%;大于9c 細胞的數目,即前20 個細胞中大于9c 的細胞數;大于5c 細胞的平均DI 值,即前20 個細胞中大于5c細胞的平均DI值。
非整倍體細胞峰為在2c以后可出現大量非整倍體細胞,并形成峰,根據形成峰的多少可分為無峰、單峰、雙峰和多峰。
1.4 EGFR突變檢測
利用人類EGFR基因突變檢測試劑盒(廈門艾德公司),通過ABI 7500熒光定量PCR儀(美國Thermofisher公司),采用擴增受阻突變系統-PCR 技術(amplification refractory mutation system,ARMS)對從胸腔積液腫瘤細胞中提取的DNA 進行擴增,檢測EGFR基因突變類型。PCR 反應條件:95 ℃、5 min;95 ℃、25 s,64 ℃、20 s,72 ℃、20 s,15 個循環;93 ℃、25 s,60 ℃、35 s,72 ℃、20 s,36個循環。
1.5 統計學分析
應用SPSS 21.0 軟件進行統計分析。采用卡方檢驗比較分類變量組間分布差異,計數資料用百分比表示,采用秩和檢驗、卡方檢驗和Kendall's taub系數評價DNA 倍體異常與EGFR突變的相關性,單因素生存分析用Kaplan-Meier 法及Log-rank 檢驗,多因素生存分析采用Cox 比例風險模型。以α=0.05 為檢驗水準。用R語言的最優截斷算法來確定連續參數的截斷值,選擇在生存分析中意義最大的截斷值作為最優截斷值。
2 結 果
2.1 EGFR基因突變與臨床病理指標的相關性
439例肺腺癌患者中,共有244例(55.58%)檢測出EGFR突變。其中外顯子19缺失100例(40.98%),外顯子21突變113例(46.31%),其他突變31例(12.7%)。如表1所示,EGFR突變與患者年齡無明顯相關關系。男性、有吸煙史、大于5c 細胞的百分比<14%、大于9c細胞的數目<8、最大DI 值<6、大于5c 細胞的平均DI值<5的患者,其EGFR基因突變率降低(P<0.05)。非整倍體細胞峰的不同分組間EGFR突變率不同(P<0.01),兩兩比較發現單峰和雙峰EGFR突變率高于無峰患者,而多峰患者與其他各峰間EGFR突變率的差異無統計學意義(P>0.05)。

表1 EGFR基因突變與肺腺癌患者臨床病理指標的相關性
2.2 DNA倍體異常與EGFR基因突變的相關性
如表2 所示,Mann-WhitneyU檢驗結果顯示,EGFR突變患者大于5c細胞的百分比、大于9c細胞的數目、最大DI 值、大于5c 細胞的平均DI 值、非整倍體細胞峰數的平均秩次高于EGFR野生型患者(P<0.01)。Kruskal-WallisH檢驗結果顯示,EGFR各突變組間大于5c 細胞的百分比、最大DI 值、大于5c 細胞的平均DI值、非整倍體細胞峰數間的差異無統計學意義(P>0.05),而EGFR不同突變組大于9c細胞的數目經Bonferrni 法校正后兩兩分析比較發現,21號外顯子突變的大于9c 細胞的數目的平均秩次高于其他突變組(P=0.049)。采用Kendall's tau-b相關系數評價DNA 倍體異常和EGFR突變的關系,大于5c 細胞的百分比、大于9c 細胞的數目、最大DI 值、大于5c 細胞的平均DI 值、非整倍體細胞峰數均和EGFR突變均存在較弱的正相關關系(P<0.05),Kendall's tau-b分別為0.186、0.153、0.110、0.156、0.148,說明EGFR突變率隨DNA倍體異常比例增加而升高。
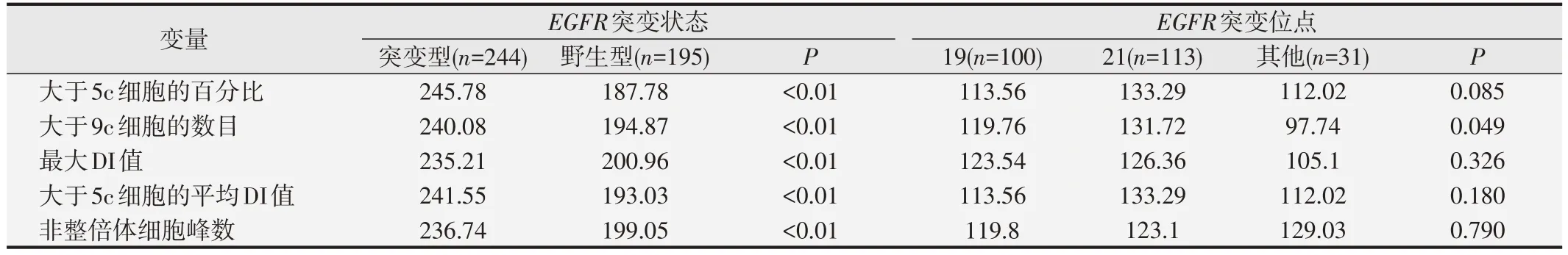
表2 DNA倍體異常與EGFR基因突變的相關性(平均秩次)
2.3 DNA 倍體異常與EGFR 突變對肺腺癌患者預后的影響
本實驗采用OS 作為主要結局指標。如表3 所示,單因素生存分析結果顯示,≤62 歲、女性、不吸煙的患者預后好于大于62歲、男性、吸煙的患者;大于5c細胞的百分比≥14%、大于9c細胞的數目≥8的患者預后好于大于5c 細胞的百分比<14%、大于9c 細胞的數目<8的患者;EGFR突變型患者的預后較EGFR野生型患者更好。而多因素生存分析結果顯示,大于5c細胞的百分比(P=0.171)、大于9c細胞的數目(P=0.176)及性別(P=0.799)與晚期肺腺癌患者預后無明顯相關關系;EGFR突變是患者的正向獨立預后影響因素,年齡、吸煙是患者的負向獨立預后影響因素,如表4所示。
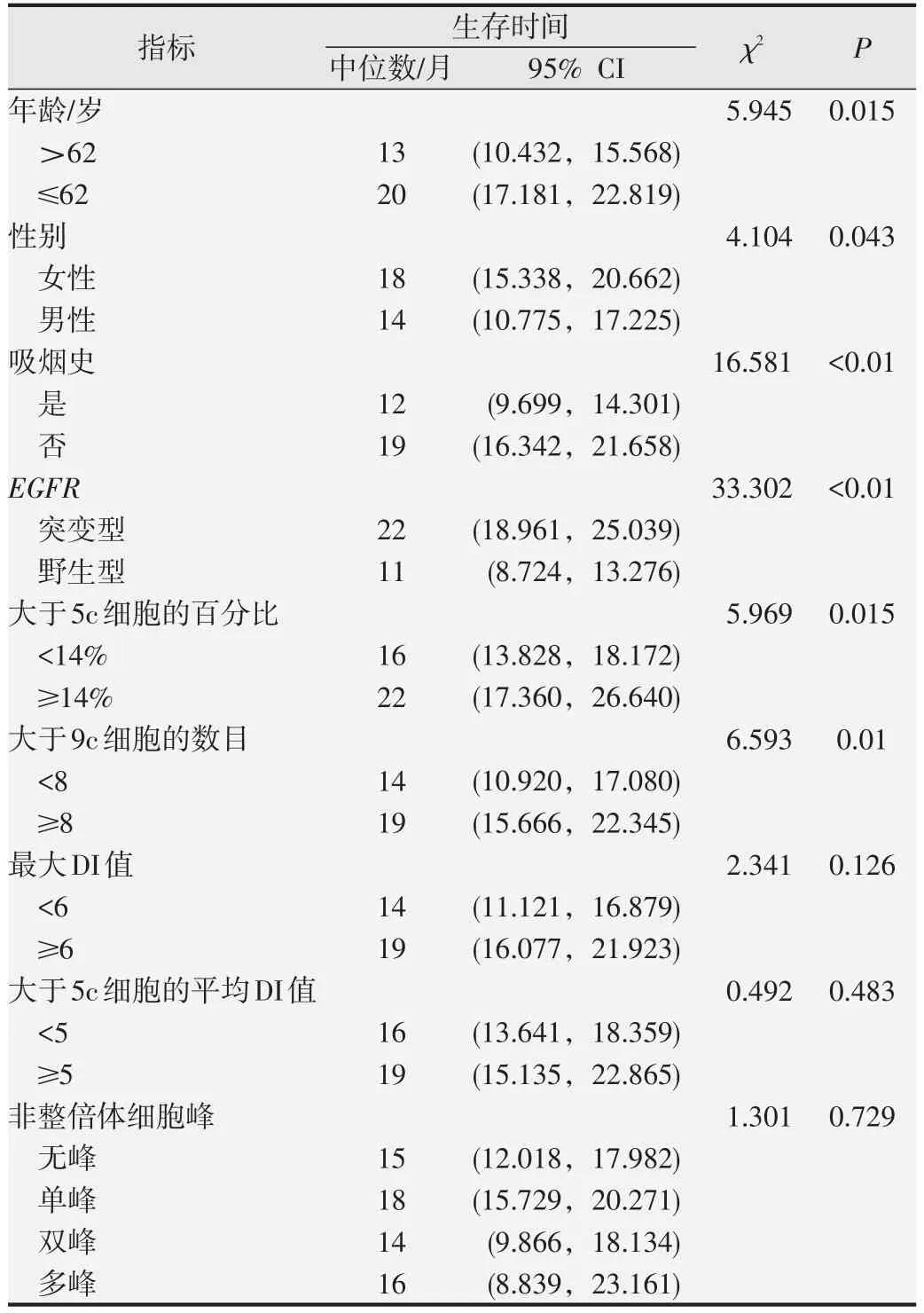
表3 439例肺腺癌患者臨床及病理指標的單因素生存分析
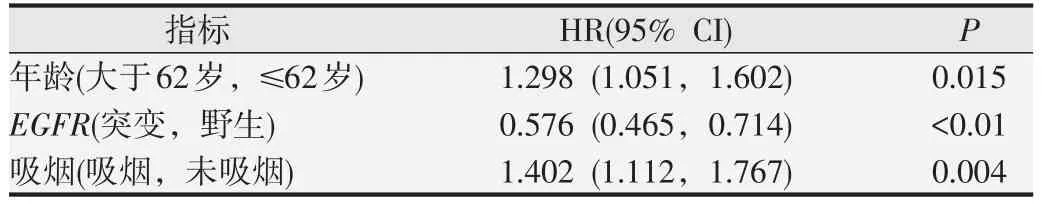
表4 439例肺腺癌患者臨床及病理指標的多因素生存分析
3 討論
計算機輔助DNA倍體分析在細胞病理學診斷中發揮重要作用[7-10],DNA 倍體異常代表腫瘤細胞染色體不穩定,與腫瘤發生發展相關[4]。EGFR是一種酪氨酸激酶受體,屬于ErBb 家族,EGFR基因突變與肺腺癌的發生發展及預后有著密切關聯。研究肺腺癌腫瘤細胞DNA 倍體異常與EGFR突變及預后的關系可以為肺腺癌患者個體化治療提供重要預測信息。
隨著人工智能的發展,越來越多的研究者發現基于病理圖像可以預測腫瘤相關指標,包括基因突變、分子亞型、治療效果等[11-13]。王荃等[14]的研究結果顯示非小細胞肺癌的病理圖像可以預測EGFR基因突變。DNA倍體分析作為一種低級別人工智能,本研究探索了基于DNA 倍體異常預測EGFR基因突變的可能性。有研究表明DNA 異倍體與EGFR基因突變狀態有關,EGFR突變患者DNA 異倍體比例較野生型患者更高[15]。在本研究中,在大于5c細胞的百分比、大于9c細胞的數目、最大DI 值、大于5c 細胞的平均DI 值不同組別中,高值組的患者EGFR突變率高于低值組的患者,與文獻[15]報道結果一致。與EGFR野生型患者相比,EGFR突變型的大于5c 細胞的百分比、大于9c細胞的數目、最大DI 值、大于5c 細胞的平均DI 值和非整倍體細胞峰數的平均秩次更高。在EGFR不同突變組間,21號外顯子突變的大于9c細胞的數目平均秩次高于其他突變組,而在其他DNA 倍體異常指標中EGFR不同突變組間無明顯差異。EGFR突變與各DNA倍體異常指標均存在較弱的正相關關聯。這表明DNA倍體異常與EGFR基因突變有著一定的相關性,在一定程度上可以用來預測EGFR基因突變。
在一項有關96例I~IIIA期手術切除NSCLC患者的研究中[16],在單因素分析中大于5c 細胞的百分比<5%患者較大于5c 細胞的百分比≥5%患者有更高的OS,而在多因素分析后結果表明大于5c細胞的百分比并不能作為一個獨立預后因素。單因素分析結果與本研究中的結果相反,可能與患者的臨床分期和大于5c細胞的百分比分界值不同有關,而多因素分析結果與本研究結果一致。在本研究中,單因素生存分析結果顯示,大于5c細胞的百分比≥14%、大于9c細胞的數目≥8的患者預后好于大于5c細胞的百分比<14%、大于9c 細胞的數目<8 的患者,EGFR突變型患者預后好于EGFR野生型患者。但多因素生存分析結果顯示,DNA倍體異常與晚期肺腺癌患者OS無關,EGFR基因突變組OS 的HR=0.576(95% CI 為0.465~0.714,P<0.05),這表明EGFR基因突變是肺腺癌患者的獨立預后因素,而DNA倍體異常并不是肺腺癌患者的獨立預后因素。DNA倍體異常與預后的關系在單因素和多因素分析中結果不同,這可能是因為DNA 倍體異常與EGFR基因突變關聯密切有關,DNA 倍體異常作為一個混雜因素在多因素生存分析中被剔除。
一項薈萃分析[17]表明,在肺癌手術患者中,與EGFR野生型患者相比,EGFR突變患者OS 更長。此外,一項關于5780例早期非鱗狀NSCLC 患者的回顧性研究[18]發現EGFR突變患者的無復發生存期和OS 比野生型患者均顯著延長。這與本研究結論相符,在本研究中,晚期肺腺癌患者EGFR突變組的OS優于非突變組。而許麗莉等[19]的研究結果顯示在早期肺腺癌患者中,EGFR突變狀態與患者術后無病生存期及OS無顯著相關性,不是影響患者預后的獨立因素,但相比EGFR外顯子21 L858R 突變患者,EGFR外顯子19 缺失患者的術后復發風險更高。Ito等[20]的一項多中心回顧性分析發現在病理分期IA~IB 期的高度惡性亞型和病理分期ⅡA~ⅢA期病例中,單因素和多變量分析顯示EGFR突變患者的5年無復發生存率低于EGFR野生型患者。EGFR突變狀態在肺癌患者中的預后影響存在明顯爭議,可能是由于肺癌患者的分期及組織學亞型不同,或者患者攜帶有其他驅動基因突變,這些因素均會影響研究結果。
本研究中年齡和吸煙史與晚期肺腺癌患者預后有關,年齡<62 歲患者預后好于年齡≥62 歲的患者;無吸煙患者預后好于吸煙患者,與文獻[21]報道相符。但本文僅隨訪了患者OS,并未統計患者的無進展生存時間,可能會使結果存在一定的局限性,后續研究中我們將進一步擴大樣本量,延長隨訪時間,增加患者無進展生存時間指標,進一步分析DNA 倍體異常與EGFR基因突變對患者預后的影響。
晚期肺腺癌患者常常較難獲得組織學標本,本研究采用胸水細胞學標本進行DNA 倍體異常與EGFR突變檢測,將DNA 倍體異常與EGFR突變進行相關性分析,并用COX單因素和多因素生存模型分析兩者與預后的關系,為晚期肺腺癌患者的預后及精準治療提供了依據。
總而言之,晚期肺腺癌患者中EGFR基因突變與DNA 倍體異常存在關聯,DNA 倍體異常是預測EGFR基因突變的潛在指標。DNA倍體異常不是晚期肺腺癌患者的獨立預后影響因素,而EGFR基因突變患者預后好于野生型患者,可作為晚期肺腺癌患者預后的預測因子。

