注射用乳糖酸紅霉素質量評價
黃曉春?劉琦?李珉?車寶泉?劉照振?劉祝月?劉海濤?寇晉萍?侯金鳳

摘要:目的 評價國產注射用乳糖酸紅霉素的質量現狀。方法 采用法定標準對80批抽驗樣品進行檢驗;結合注射劑一致性評價要求,利用參比制劑開展比較研究,通過對復溶時間、顆粒形貌、有關物質及成鹽率等關鍵質量屬性的考察,分析評價不同企業制劑的質量差異及現行標準的合理性。結果 法定檢驗結果顯示80批注射用乳糖酸紅霉素合格率為100%。現行法定標準無游離乳糖酸檢查項,有關物質和含量測定方法及限度與參比制劑標準存在差異。國內制劑的復溶時間約為參比制劑的2倍,粒徑分布及顆粒形貌與參比制劑存在差異。國內制劑的成鹽率為0.93~1.08,批次間波動較大;參比制劑鈉離子含量(4.3 ppm)顯著低于國內制劑(11.9~288.2 ppm)。新建有關物質檢測HPLC方法在檢出雜質種類及雜質總量方面均優于現行法定標準,國內制劑與參比制劑雜質譜相似,雜質檢出差異可接受。探討利用HPLC方法測定的紅霉素組分含量估測其效價值,對各企業制劑的效價估測值與微生物檢定法的效價測定結果無顯著差異。結論 注射用乳糖酸紅霉素總體質量較好,與參比制劑在一些質量屬性方面存在差異,建議國內企業優化生產工藝尤其是冷凍干燥工藝流程以提升產品質量;現行標準可進行提高。
關鍵詞:注射用乳糖酸紅霉素;評價性抽驗;質量評價;一致性評價;含量測定
中圖分類號:R978.1文獻標志碼:A
Abstract Objective To evaluate the current quality of domestic erythromycin lactobionate for injection. Methods? ? The statutory standard methods combined with exploratory researches focused on quality consistency evaluation for injections were used to evaluate the quality of the 80 samples. Through the investigation of critical quality attributes such as redissolution, particle morphology, related substances, and the salt-forming rate, the quality differences of products from different manufactures and the rationality of the current statutory standard were analyzed and evaluated. Results? ? The qualified rate for the 80 samples was 100% showed by the statutory tests. Compared to the reference preparation standards, the statutory standard did not include the free lactobionic acid test and there were differences between the related substances, assay methods, and limits. The redissolution time of domestic preparations was about twice as long as that of the reference preparation. The particle size distribution and morphology of domestic preparations were different from those of the reference preparation. The salt-forming rate of domestic preparations was 0.93~1.08, with large fluctuations between batches. The sodium ion content of the reference preparation (4.3 ppm) was significantly lower than that of the domestic preparations (11.9~288.2 ppm). The HPLC method for the detection of related substances was superior to the current statutory standard in terms of the types and total amount of impurities detected. The impurity spectra of domestic preparations were similar to those of the reference preparation, and the impurity contents were acceptable. The potency of erythromycin lactobionate for injection was calculated based on the contents of erythromycin components determined by the established HPLC method. There was no significant difference between the calculated potency and the tested potency determined by the microbial assay for the preparations of different manufactures. Conclusion? ? The overall quality of erythromycin lactobionate for injection was good, but some differences of quality attributes were found between the reference preparation and domestic preparations. In order to improve product quality, it is recommended that the production processes, especially the freeze-drying process should be optimized by domestic manufacturers; the current statutory standards should be further improved.
Key words? ? Erythromycin lactobionate for injection; Evaluative testing; Quality evaluation; Consistency evaluation; Content determination
乳糖酸紅霉素(erythromycin lactobionate)是紅霉素和乳糖酸(1:1)的成鹽產物,屬第一代大環內酯類抗生素[1],主要通過抑制敏感微生物的蛋白質合成產生抑菌作用。注射用乳糖酸紅霉素由Hospira公司于1964年上市,臨床用于青霉素過敏患者敏感菌感染的替代用藥以及敏感軍團菌、衣原體屬、支原體屬微生物的感染治療等[1]。目前在多國藥典中均已收載該品種[2-3]。注射用乳糖酸紅霉素不良反應有皮疹、嘔吐、瘙癢癥和肝功能異常等。
注射用乳糖酸紅霉素為國家基本藥物目錄品種,國內現有19家生產企業生產,存在30個批準文號。注射用乳糖酸紅霉素為2021年國家評價性抽驗品種,抽驗涉及國內23個省、自治區和直轄市的藥品生產、經營和使用單位,共獲得80批次樣品。本文采用現行法定標準對全部抽檢樣品進行檢驗,依據發現的問題開展探索性研究;對當前注射用乳糖酸紅霉素的質量狀況進行客觀評價和分析。
1 儀器及試藥
1.1 儀器
Waters e2695高效液相色譜儀;Thermo UltiMate 3000型超高效液相色譜儀;Thermo LTQ Orbitrap Velos Pro 質譜儀;梅特勒托利多G20S電位滴定儀;PALL CASCADA I純水機;梅特勒托利多XS205電子天平;Thermo Nicolet 5700傅里葉紅外光譜儀;Malvern Mastersizer 2000激光粒度儀;MERLIN compact掃描電鏡儀; Ultima IV X射線衍射儀;ZY-300Ⅳ型抑菌圈測量儀;SPX-250B-Z型生化培養箱等。
1.2 試藥
80批次注射用乳糖酸紅霉素均為2021年度國家藥品評價性抽驗樣品,涉及4個生產企業(A、B、C和D企業),兩種規格0.25g(25萬單位)和0.3g(30萬單位);參比制劑為Hospira公司產品(批號:091053A)。
紅霉素標準品(批號:510140-201701) 來源于中國食品藥品檢定研究院;乳糖酸紅霉素對照品(貨號:001xV7,batch 1.0)、紅霉素A對照品(貨號:00516P,batch 3.2)、紅霉素B對照品(貨號:00TjNt,batch 5.0)、紅霉素C對照品( 貨號:003azi,batch 5.0)、N-去甲基紅霉素A (雜質B,貨號:005kq0,batch 3.2)及紅霉素系統適用性對照品(貨號:00p9A0,batch 2.0)來源于歐洲藥品質量管理局(EMQD);紅霉素E(雜質C)、脫水紅霉素A(雜質D)、紅霉素A烯醇醚(雜質E)、表紅霉素A烯醇醚(雜質F)及紅霉素A氮氧化物(雜質H)由范德生物科技天津公司合成。
短小芽胞桿菌[CMCC(B)63202],抗生素檢定用培養基Ⅰ號(北京路橋,批號:200511)。乙腈和氨水為色譜純,其他試劑為分析純,實驗用水均為超純水。
2 試驗方法
2.1 法定檢驗
按照《中國藥典》2020年版標準對80批注射用乳糖酸紅霉素進行檢驗。主要檢驗項目包括鑒別、有關物質、紅霉素A、紅霉素B、紅霉素C組分及含量測定等。
2.2 探索性研究
2.2.1 復溶行為及復溶時間測定
不同企業注射用乳糖酸紅霉素各3支,(25℃±2℃)條件下按標示量加入適量滅菌注射用水(按說明書配置,標示量每0.25 g加水5 mL,用一次性注射器抽取加入),每隔5 min振搖30 s;觀察30 min內樣品的溶解情況,并記錄樣品完全溶解的時間點,完全溶解需時的均值為各樣品的復溶時間。
2.2.2 粉末差異評價
利用粉末粒徑分布測定(干法空壓機噴射樣品直接進樣測定)、偏光顯微鏡和掃描電鏡粉末成像分析(采用掃描電鏡儀,電壓設定為20 kV,樣品用雙面膠帶固定在銅板上,并用金噴射)、粉末吸濕性檢測、粉末X射線衍射分析、紅外光譜等多種方法檢測國產制劑與參比制劑的粉末特性,利用測定結果評估各制劑粉末的差異。
2.2.3 成鹽率[2]測定
利用電位滴定法,基于0.1 mol/L的氫氧化鈉滴定液和高氯酸滴定液分別滴定各兩份約0.5 g的注射用乳糖酸紅霉素粉末,依據平均消耗的滴定液體積折算1 g樣品消耗濃度為0.1 mol/L的高氯酸滴定液及氫氧化鈉滴定液體積(VHCLO及VNaOH),VNaOH與VHCLO的比值為樣品中乳糖酸與紅霉素摩爾數比值(即為乳糖酸紅霉素的成鹽率)。乳糖酸與紅霉素完全成鹽的摩爾數比值應為1.0。
2.2.4 鈉離子含量測定
基于《中國藥典》2020版通則中原子吸收分光光度法第一法(標準曲線法)測定注射用乳糖酸紅霉素樣品中鈉離子含量。
2.2.5 HPLC法測定有關物質及含量
在現行各國藥典標準和文獻報道的有關物質檢測方法[2-4]基礎上,以有效分離注射用乳糖酸紅霉素的主要已知雜質為目標,建立HPLC有關物質及含量檢測方法。
色譜條件:Waters Xbridge C18色譜柱(4.6 mm×
100 mm,3.5 μm),以0.4%氨水溶液為流動相A,乙腈為流動B,按表1方式進行線性梯度洗脫。流速為1.0 mL/min;柱溫為40℃;檢測波長215 nm;進樣體積35 μL。樣品臨用新制,樣品室溫度4℃。
2.2.6 HPLC方法替代抗生素微生物檢定方法可行性考察
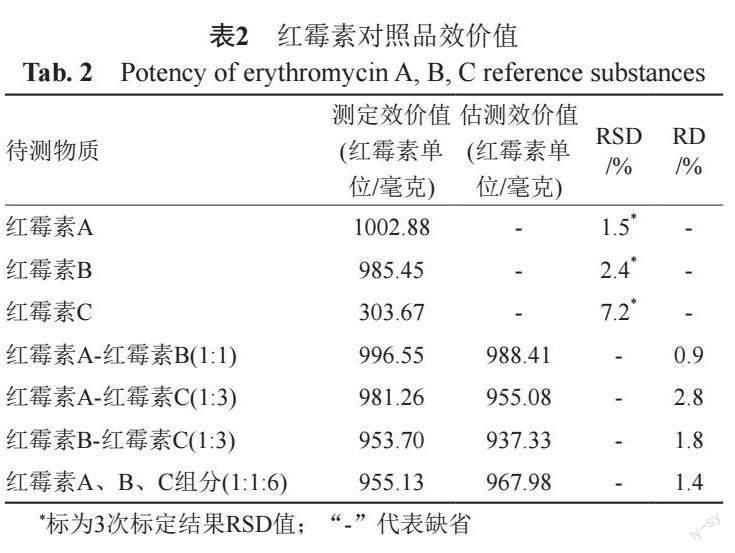
基于中檢院紅霉素標準品,采用《中國藥典》2020年版抗生素微生物檢定法進行紅霉素A、B、C 3組分的各自效價值標定。同法進行不同配比的紅霉素A-紅霉素B(1:1)、紅霉素A-紅霉素C(1:3)、紅霉素B-紅霉素C(1:3)及紅霉素A、B、C組分(1:1:6)對照品混合物的效價測定,基于3組分對照品含量及各自標定效價值計算混合對照品的估測效價值;比較效價測定值與估測值評估3組分間的相互作用。HPLC法測定21批不同來源的注射用乳糖酸紅霉素樣品中紅霉素A、B、C組分含量,通過量效轉換計算出效價估測值,并與抗生素微生物檢定法測定效價值進行數據等效性驗證。
3 結果與討論
3.1 法定標準檢驗
按現行法定標準檢驗,80批注射用乳糖酸紅霉素全部合格,合格率為100%。
3.2 法定檢驗中發現的問題
本次抽驗法定檢驗的過程中發現以下問題:①B、C、D企業制劑與原研參比制劑采用冷凍干燥工藝,A企業制劑采用噴霧干燥工藝;不同企業制劑的性狀及復溶行為有差異;②現行有關物質檢查方法檢出已知雜質種類少,已知雜質檢出量在雜質總量中占比低;③本品的各國藥典標準有差異,與歐洲藥典(EP)10.0標準[2]相比,我國現行法定標準的有關物質檢查方法有待改進、無乳糖酸含量的檢查項目,含量測定方法采用抗生素微生物檢定法耗時且效率低;④國內制劑膠塞外表面均有不同數量的制劑粉末殘留,提示制劑生產工藝尤其灌裝工藝方面的不足。
3.3 探索性研究
3.3.1 復溶行為及復溶時間
注射用粉末類注射劑的復溶時間常與臨床療效密切相關,是注射用粉針劑的關鍵質量屬性[5-6]。注射用乳糖酸紅霉素國內制劑的復溶時間(11.0~12.5 min)是參比制劑復溶時間(5.5 min)的一倍余。國內制劑溶解過程中少量團塊和/或絮狀的未溶物,漂浮和/或貼于安瓿瓶底導致粉末全部溶解需時長于參比制劑。采用冷凍干燥工藝(參比及B、C、D企業的制劑)與采用噴霧干燥工藝(A企業制劑)的產品間復溶行為差異明顯,A企業制劑形成粉液混合物,貼安瓿瓶壁部分粉末易為液膜包被。冷凍干燥工藝生產的制劑,粉末團塊加入注射用水后即消融;參比制劑全溶前僅安瓿瓶底可見濕潤冰渣樣未溶物不同與企業B、C、D的制劑。參比制劑的標示量與安瓿品體積折算后與國內制劑相仿。粉末復溶行為及復溶時間的差異提示各制劑粉末物化參數的差異[7],尤其是制劑粉末晶型、粒徑分布及顆粒形貌[8]等的差異。
3.3.2 粉末差異評價
含參比制劑在內的5種注射用乳糖酸紅霉素的粒徑分布測定結果見圖1。國內制劑粒徑分布d(0.1)、d(0.5)和d(0.9)值均略大于參比制劑的1.65、8.38及25.1 μm;除C企業制劑外,A、B及D企業制劑粉末均含有大于100 μm的顆粒。采用噴霧干燥工藝的A企業制劑與采用冷凍干燥工藝的制劑(參比制劑和B、C、D企業制劑)粒徑分布差異明顯。
含參比制劑在內的5種注射用乳糖酸紅霉素粉末的顆粒形貌比較見圖2。冷凍干燥工藝的參比制劑和B、C、D企業制劑以含微孔結構的團塊狀微粒為主,而采用噴霧干燥工藝的A企業制劑為無微孔的、表面光滑的多棱面微粒。與參比制劑相比,B、C企業制劑的孔隙小而密,而D企業制劑的孔隙相對較少。
各企業制劑與參比制劑的粉末X衍射圖譜顯示所有制劑粉末均為無定型粉末,X衍射圖譜基本一致。各企業制劑粉末吸濕性檢測、紅外光譜及熱重法測試的結果亦無明顯差異。
制劑粉末粒徑分布與顆粒形貌的差異與制劑生產工藝相關[7-8],是導致國內制劑復溶行為、復溶時間與參比制劑差異的因素。
3.3.3 成鹽率考察
成鹽率是影響注射用乳糖酸紅霉素制劑澄清度、酸堿度和復溶時間等關鍵質量屬性的關鍵因素之一[6]。抽檢的80批樣品中乳糖酸紅霉素的成鹽率在0.93~1.08之間,均值為1.00(標準差為0.03,n=80)。國內A、C、D 3家企業制劑多批次成鹽率分布的箱體圖見圖3。A企業為0.95~1.08之間,均值1.03(標準差為0.03,n=30);C企業為0.93~1.05之間,均值0.98(標準差為0.03,n=31);D企業為0.99~1.07之間,均值1.03(標準差為0.03,n=18)。參比制劑和B企業各1批次的成鹽率分別為1.01和1.00。國內3家企業多批次制劑的成鹽率波動明顯,其中D企業制劑乳糖酸紅霉素的成鹽率整體優于A企業和C企業。乳糖酸紅霉素的成鹽率與調研資料中各企業提供的制備乳糖酸紅霉素反應終止時藥液的pH值參數范圍相關。紅霉素A是pKa為8.6的弱堿,其在溶液中的成鹽或游離與溶液pH值直接相關[9]。成鹽率的測定能反應各企業生產工藝控制水平,乳糖酸紅霉素制備反應終止的pH值是關鍵工藝參數。
3.3.4 鈉離子含量測定
注射用乳糖酸紅霉素制劑中鈉離子含量與生產工藝、玻璃包材相關,參比制劑說明書及文獻[10]均提示鈉離子的存在影響制劑的復溶過程。參比制劑的鈉離子含量僅為4.3 ppm,國內制劑的鈉含量依次為A企業(11.9 ppm)、B企業(83.5 ppm)、D企業(245.6 ppm)及C企業(288.2 ppm)。結合國內制劑生產工藝,分析鈉離子可能源于乳糖酸鈉經離子交換制備乳糖酸工藝及冷凍干燥過程可能的鈉鈣玻璃包材的轉移。參比制劑包材采用中硼硅玻璃,企業A和C采用鈉鈣玻璃,企業B和D采用低硼硅玻璃。按注射劑一致性評價技術要求及玻璃包材對極冷耐受性考量[11],建議采用冷凍干燥生產工藝的B、C、D 3家企業檢查制備的乳糖酸藥液中鈉離子含量,酌情采用中硼硅玻璃包材。
3.3.5 HPLC法測定有關物質
目前注射用乳糖酸紅霉素的有關物質譜主要涉及13種已知雜質[2,12]。基于文獻和現有的標準方法,優化建立了新的有關物質測定方法(見“2.2.5”),典型的系統適用性圖譜見圖4。包括參比制劑在內的5種制劑的有關物質檢測結果見圖5。各制劑雜質總量檢出范圍為2.24%~3.29%,由低到高依次為C企業、D企業、參比制劑、A企業、B企業。國內制劑的雜質譜主要涉及雜質A、B、C、D、E及F,主要雜質為前三者。雜質E的檢出量A企業制劑最高(0.85%),顯著高于參比制劑(0.05%)、C企業(0.06%)、D企業(0.10%)及B企業(0.21%)。與參比制劑比較,國內制劑有關物質總量、已知雜質含量、未知雜質含量都符合現行EP10.0標準[2]的限度要求。新建HPLC方法對已知雜質檢出由2種增加至6種,已知、未知及雜質總量檢出值均高于現行法定標準。
基于乳糖酸紅霉素對照品的酸、堿、氧化、高溫、光照等因素強制降解實驗結果顯示,乳糖酸紅霉素主要對酸、堿、高溫不穩定。酸性破壞條件雜質E、雜質D增大最明顯,雜質F、雜質D在堿性破壞條件下增大最明顯,高溫破壞導致雜質E增加。文獻報道雜質A、B、C主要為紅霉素原料來源,降解雜質D、E和F可作為注射用乳糖酸紅霉素生產工藝優化的質控指標[12-13]。
結合各企業制劑有關物質的檢出結果及可獲得的工藝參數,采用噴霧干燥工藝生產的A企業制劑中雜質E含量顯著高于采用冷凍干燥工藝企業的制劑,分析與噴霧干燥工藝溫度≥65℃的高溫因素相關,雜質E含量的測定可用于A企業生產工藝的改進。
3.3.6 HPLC法測定含量
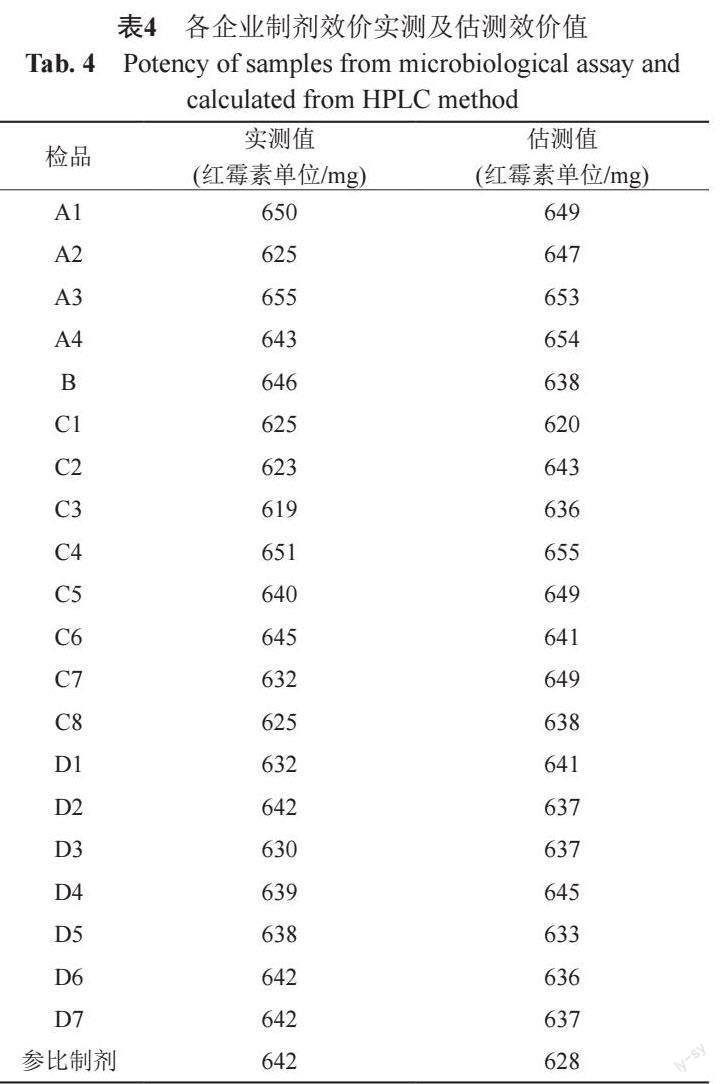
紅霉素A、紅霉素B、紅霉素C對照品效價標定結果和混合對照品效價測定及估測結果見表2。紅霉素A、紅霉素B組分效價值約為紅霉素C組分的3倍。假設紅霉素A、紅霉素B及紅霉素C 3組分對短小芽胞桿菌的抗菌活性無交互作用,3組分混合對照品的效價測定值與按組分間無相互作用的理論計算值比較,可基本確認3組分的抗菌活性無交互作用。因而,基于紅霉素A、紅霉素B、紅霉素C的理論效價(純品效價)1002.9、985.5和303.7紅霉素單位/毫克,可利用3組分含量測值進行樣品效價值的估測。
基于新建HPLC方法,采用對照品溶液利用外標法按峰面積計算供試品溶液中紅霉素A、B及C 3組分含量(mg/mL)。包括參比制劑在內的共21批次樣品中紅霉素A、B及C組分含量(%)利用公式1計算的結果見表3。
供試品紅霉素組分含量(%)=紅霉素組分含量(mg/mL)×供試品稀釋倍數×折算系數×[1-供試品水分(%)]×100/供試品稱樣量(mg)(1)
其中,紅霉素A、B及C 3組分對應的折算系數為1.4877、1.4986及1.4972[2]。
依據各組分標定效價值及HPLC方法測定含量值計算注射用乳糖酸紅霉素樣品的估測效價值,計算公式為:
估測效價(紅霉素單位/毫克)=紅霉素A理論效價×紅霉素A含量(%)+紅霉素B理論效價×紅霉素B含量(%)+紅霉素C理論效價×紅霉素C含量(%)? ? ? ? ? ? ? ?(2)
樣品的估測效價值與依據抗生素微生物檢定法測定的效價值結果比較見表4。樣品效價實測值為(641±9)紅霉素單位/毫克(n=21),估測效價值(637±10)紅霉素單位/毫克(n=21)。統計學配對t檢驗結果t值為1.30,雙側P值為0.20,單側為0.10,均大于0.05;提示樣品效價實測值與基于含量測定結果的估測值無顯著差異,新建HPLC方法進行含量測定可行[14-15]。
4 結論
本次國家評價性抽驗采用前期調研、文獻檢索、法定標準檢驗結合探索性研究的方式對注射用乳糖酸紅霉素的質量現狀進行評價和分析。按照法定標準檢驗,80批次樣品均合格,合格率為100%,國產注射用乳糖酸紅霉素總體質量較好。
在探索性研究中,發現國內仿制制劑與原研參比制劑在復溶時間、粒徑分布、顆粒形貌、成鹽率及有關物質等關鍵質量屬性方面存在差異。原研參比制劑的復溶時間低于國內仿制制劑,國內仿制制劑多批次產品間成鹽率值波動大。此外鈉離子含量參比制劑顯著低于國內制劑。采用噴霧干燥工藝的A企業制劑雜質E顯著高于采用冷凍干燥工藝的制劑。上述質量屬性差異提示,國內企業需進一步優化生產工藝以提升產品質量。
現行注射用乳糖酸紅霉素《中國藥典》標準中有關物質檢測方法需要提升,含量測定方法可以用HPLC方法測定紅霉素A、紅霉素B及紅霉素C組分替代抗生素微生物檢定法。
參 考 文 獻
李大魁, 金有豫, 湯光, 等譯. Sweetman S C 主編. 馬丁代爾藥物大典(原著第37版)[S]. 北京: 化學工業出版社, 2014, 256-260.
The European Pharmacopoeia Commission. European Pharmacopoeia10.0[S]. 2020: 2533-2536.
The United States Pharmacopeial Convention. United States Pharmacopeia[S]. 42th Edition. 2019: 1668.
Bosschea L V, Lodib A, Schaarc J, et al. An interlaboratory study on the suitability of a gradient LC-UV method as a compendial method for the determination of erythromycin and its related substances[J]. J Pharmaceut Biomed, 2010, 53: 109-112.
國家藥品監督管理總局. 化學藥品注射劑仿制藥質量和療效一致性評價技術要求[S]. 2019.
胡昌勤. 對抗生素注射劑一致性評價/再評價的思考[J]. 中國抗生素雜志, 2019, 44(3): 281-288.
Hiwale P, Amin A, Kumar L, et al. Variables affecting reconstitution time of dry powder for injection[J]. Pharm Tech, 2008, 32(7): 62-68.
蓋榮銀, 趙同新, 姚勁挺, 等. 注射用粉末劑型仿制藥一致性評價關鍵技術要點解析[J]. 中國醫藥工業雜志, 2019, 50(2): 226-228.
劉昌勝, 鄔行彥. 紅霉素在幾種緩沖液中的溶解度[J]. 中國抗生素雜志, 1995, 20(1): 17-19.
王新宇, 蔣睿, 張艷仙. 乳糖酸紅霉素溶媒選擇分析[J]. 中國處方藥, 2021, 19(1): 42-43.
陳婧, 希迪·莫蘇拉, 楊宗蕊. 中性硼硅玻璃與藥物相容性研究進展[J]. 包裝工程, 2021, 42(10): 37-43.
劉聰. 紅霉素類抗生素相關物的制備及有關反應方法學的研究[D]. 北京理工大學, 2014: 5-7.
武建卓, 李雪, 張蔚, 等. 國產紅霉素腸溶片的質量分析[J]. 中國抗生素雜志, 2019, 44(3): 308-312.
趙述強, 趙衛, 史孫亮, 等. 改進高效液相色譜法測定硫酸奈替米星注射液含量[J]. 中國抗生素雜志, 2018, 43(10): 1217-1221.
黃敏文, 侯玉榮, 張倩, 等. 高效液相色譜-脈沖安培電化學檢測器法替代微生物檢定法測定硫酸新霉素效價的研究[J]. 中國藥學雜志, 2020, 55(2): 133-140.

