頭孢地尼口服固體制劑的質量分析與評價
張琳?楊倩?劉海玲?杜旭?郭艷娟?顧云?魯瑞娟
摘要:目的 評價頭孢地尼口服固體制劑(頭孢地尼膠囊、頭孢地尼分散片、頭孢地尼片)的質量現狀。方法 采用法定檢驗方法結合探索性研究,對2021年國家藥品抽檢工作中獲得的樣品的質量狀況及質量標準的合理性進行了分析。結果 按法定標準檢驗160批次樣品,合格率為100%。但現行質量標準存在檢驗方法不一致、個別項目限度不合理等問題。探索性研究建立了可同時測定有關物質和聚合物類雜質的RP-HPLC法,對產品中雜質譜的差異進行了比較;通過溶出度試驗考察頭孢地尼口服制劑在不同介質中的溶出行為,并同日本橙皮書中參比制劑的溶出行為進行了比較,發現國內制劑的溶出速率更快。結論 目前國內市場流通的頭孢地尼膠囊(片劑、分散片)質量總體較好,現行標準基本可行,部分檢驗項目需進一步完善統一。
關鍵詞:頭孢地尼口服固體制劑;質量評價;溶出行為
中圖分類號:R978.1文獻標志碼:A
Abstract Objective To evaluate the quality status of domestic cefdinir capsules, cefdinir dispersible tablets, and cefdinir tablets. Method According to the general requirements of national assessment programs, the statutory specification methods combined with exploratory researches were used to evaluate the quality of cefdinir oral solid preparations. Results 160 batches of cefdinir oral solid preparations were determined according to the legal specification. The qualified rate was 100%. However, some methods and limits in different specifications have some differences. The further approach showed that the specifications used had some problems, such as unreasonable limit. Based on the comparisons of some related substance methods with the method in ChP, an optimal RP-HPLC method for the determination of impurities including the polymers was established. The method was used to compare the differences of impurity profiles of different products. Additionally, the dissolution profiles of cefdinir oral solid preparation in different dissolution media were investigated and compared with the reference preparation recorded in the Japanese Orange Book. Conclusion The quality of cefdinir oral solid preparations was generally good, and the current statutory specifications should be unified and further improved.
Key words Cefdinir oral solid preparations; Quality evaluation; Dissolution behavior
頭孢地尼為半合成的廣譜第三代頭孢菌素,通過抑制細菌細胞壁的合成產生抗菌作用,對革蘭陽性菌和陰性菌均有效,并對大部分β-內酰胺酶穩定,許多耐青霉素和頭孢菌素的致病菌對本品敏感。在臨床上廣泛應用于內科、外科、皮膚科、婦產科、泌尿科等敏感菌導致的感染。不良反應輕微,多呈自限性,常見的不良反應主要為腹瀉、腹痛、胃部不適、燒心、惡心等消化道反應和皮疹、瘙癢等過敏反應[1]。
頭孢地尼由日本藤澤藥品工業公司研發,于1991年首次在日本上市,1997年獲得FDA批準在美國上市,2001年國產仿制品獲準在國內上市[2]。頭孢地尼雖未列入國家基本藥物,但為國家醫保目錄(2019年版)品種。據國家藥品監督管理局網絡數據庫檢索結果,目前國內有11家原料藥生產企業和13家制劑生產企業。頭孢地尼原料和膠囊劑在ChP2020、USP2021和JP第十七改正版中均有收載,但各國藥典中均未收載頭孢地尼分散片和頭孢地尼片。頭孢地尼膠囊(片、分散片)列為2021年國家藥品抽檢品種。國家藥品抽檢的目的在于客觀地評價國內藥品的質量現狀,分析產品的主要質量問題,進而明確產品質量提高的方向[3]。本文通過分析頭孢地尼口服制劑標準檢驗與探索性研究結果,對其質量狀況進行全面評價。
1 儀器與試藥
1.1 儀器
Shimadzu LC-20AD高效液相色譜儀、Agilent1260高效液相色譜儀;LC-MS系統:液相色譜系統為Waters ACQUITY 2D UPLC,質譜系統為 Waters Xevo G2-XS QTof 質譜儀;天大天發RC806D溶出儀,FODT-601光纖藥物溶出度實時測定儀;Mettler Toledo XS205電子天平。
1.2 色譜柱
常規有關物質分析:Welch Ultimate Plus C18色譜柱(4.6 mm×250 mm,5 μm),大曹三耀CAPCELL PAK C18MGⅡ色譜柱(250 mm×4.6 mm,5 ?m),YMC-Pack ODS-AM色譜柱(150 mm×4.6 mm,5 μm,12 nm),TIANHE Kromasil C18色譜柱(4.6 mm×250 mm,5 ?m 100?),Ultimate ODS-3色譜柱(4.6 mm×150 mm,3 ?m),GL Sciences Wondasil C18-WR色譜柱(4.6 mm×250 mm,5 ?m);LC-MS分析:Waters HSS T3 C18(100 mm×2.1 mm,1.8 μm)色譜柱;凝膠色譜分析:TSKgel G2000SWxl色譜柱(7.8 mm×300 mm),Agilent Adv.Bio SEC色譜柱(130?,7.8 mm×300 mm, 2.7 μm)。
1.3 對照品
頭孢地尼對照品(含量98.1%,批號:130502-201904)購自中國食品藥品檢定研究院,頭孢地尼有關物質A(批號:R066G0)、頭孢地尼有關物質B(批號:R079W0)為美國藥典對照品。
1.4 試劑和試藥
乙腈、甲醇為色譜純,Merck公司;四甲基氫氧化銨溶液(25%)為分析純,國藥集團化學試劑有限公司;其他試劑均為分析純。
本文涉及的頭孢地尼制劑均為2021年國家藥品抽檢樣品,共160批次。其中頭孢地尼膠囊75批,頭孢地尼分散片79批,頭孢地尼片6批。涉及13家生產企業(A-M),其中企業C、D、E的頭孢地尼膠囊(規格:100 mg)和企業I的頭孢地尼分散片(規格:100 mg)均已通過一致性評價或視同通過一致性評價。
2 方法
2.1 法定檢驗
按藥品批準文號規定的質量標準進行法定檢驗。頭孢地尼膠囊檢驗項目包括性狀、鑒別、有關物質(或有關物質Ⅰ)、有關物質Ⅱ、干燥失重、溶出度、微生物限度、裝量差異和含量測定;頭孢地尼分散片檢驗項目包括性狀、鑒別、有關物質、頭孢地尼聚合物、干燥失重(或水分)、溶出度、微生物限度、重量差異、分散均勻性和含量測定;頭孢地尼片檢驗項目為性狀、鑒別、有關物質、干燥失重、溶出度、重量差異和含量測定。
2.2 探索性研究
根據法定檢驗結果,結合專題調研、文獻檢索等情況,圍繞著藥品的安全性、有效性開展了有關物質、頭孢地尼聚合物和體外溶出行為等研究。
2.2.1 有關物質
參考《中國藥典》2020年版(ChP2020)頭孢地尼和頭孢地尼膠囊[4]項下有關物質測定方法,分別對8批次頭孢地尼原料和160批次頭孢地尼制劑進行考察研究,并對結果進行分析。
2.2.2 聚合物類雜質分析
在ChP2020收載的頭孢地尼有關物質檢查法基礎上,參照文獻[5]建立了新的梯度洗脫方法,以利于強保留雜質的洗脫;并采用堿降解的方式,獲得了含有頭孢地尼二聚體指征性雜質的系統適用性試驗溶液;采用飛行時間質譜(LC-QTOF/MS)對堿降解樣品和實際樣品中的強保留雜質進行了定性研究;對8批次頭孢地尼原料和51批次不同企業生產的頭孢地尼制劑中的聚合物類雜質進行了測定。
2.2.3 體外溶出行為比較
參照日本橙皮書對體外藥物溶出度研究的要求,分別以水、pH1.2鹽酸溶液、pH4.0醋酸鹽緩沖液和pH6.8磷酸鹽緩沖液4種溶出介質,對不同企業的頭孢地尼膠囊、片劑和分散片分別進行了溶出曲線分析,并以日本橙皮書中收載的頭孢地尼膠囊溶出曲線為參比,采用f2因子比較法對溶出曲線進行比較,評估各生產企業的頭孢地尼制劑(膠囊劑、分散片、片劑)的溶出行為,以ChP2020頭孢地尼膠囊的溶出介質考察各企業產品溶出曲線的變異系數。
3 結果與討論
3.1 法定檢驗
本次國家藥品抽檢的160批次樣品按各自的標準檢驗,全部符合規定,合格率為100%。但13家生產企業的產品涉及16個質量標準,各標準在檢驗項目、檢驗方法和限度的設置上差異明顯,較難通過法定檢驗結果對不同企業之間的產品質量進行評價。
對現行質量標準進行比較,主要差異如下:①有關物質(有關物質Ⅰ)色譜方法不統一;對特定雜質的控制如雜質計算方式、限度存在明顯差異;部分已知雜質由于保留時間較接近,利用相對保留時間進行定位時,不易判斷雜質峰歸屬。②有關物質Ⅱ(頭孢地尼聚合物)各國藥典均未對頭孢地尼聚合物進行專門控制,僅3個通過國家一致性評價的產品在其質量標準中控制了聚合物類雜質,但方法和限度各不相同。③各質量標準雖然均設有溶出度檢查項,但在溶出方式、轉速、溶出介質、溶出時間、檢查方法和限度等方面存在一定差異。
3.2 探索性研究
3.2.1 有關物質
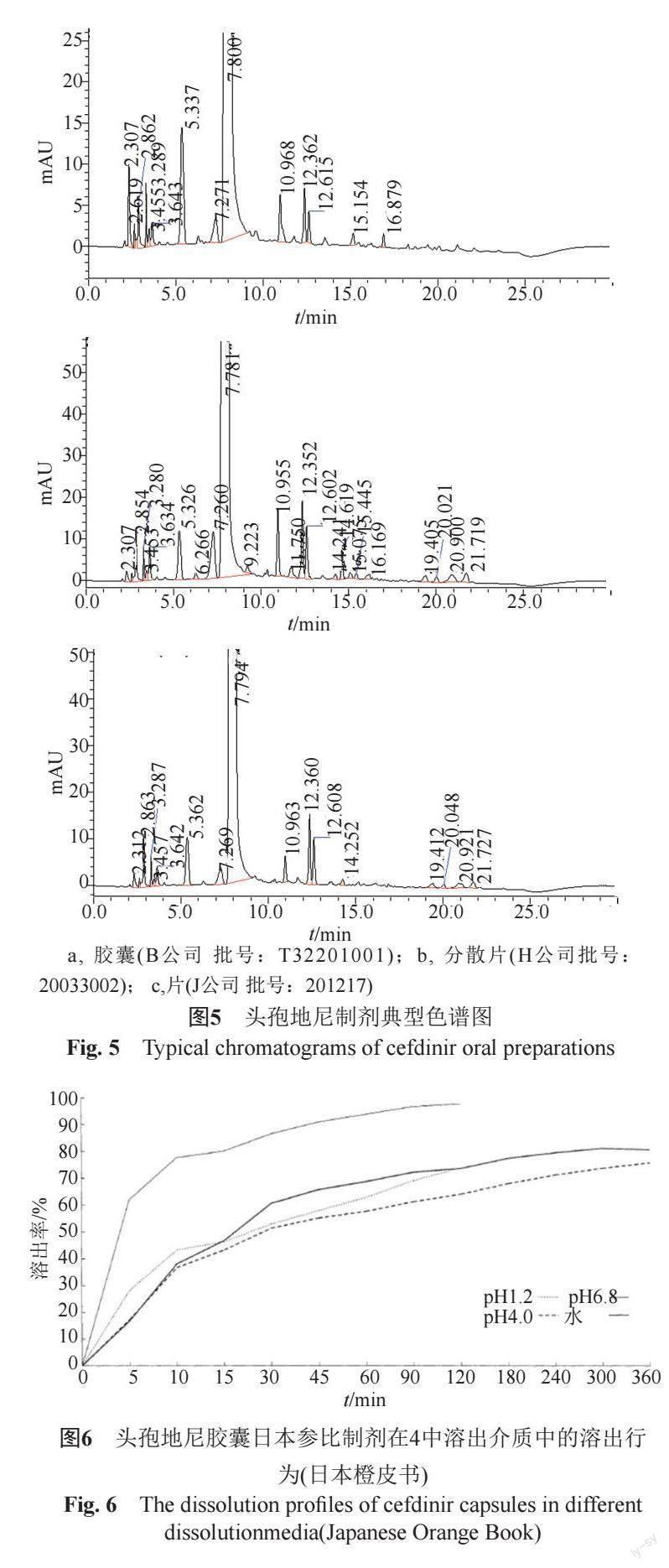
采用ChP2020收載的頭孢地尼有關物質檢查方法,對3家原料生產企業8批次頭孢地尼原料進行分析,系統適用性溶液典型色譜圖見圖1,結果見表1。
由表1可見,目前國內制劑企業使用率較高的頭孢地尼原料質量水平良好,總雜質均不大于1.0%(ChP限度為3.0%)。其雜質主要為雜質A、雜質F、雜質G、H、雜質I、雜質J、雜質K、雜質L雜質M、N和雜質R。1#~6#原料為同一企業產品,但雜質譜呈一定的差異,提示原料的生產存在一定的不穩定性,其質量可直接影響制劑的質量。
采用相同方法,對不同企業制劑的雜質譜進行分析,并與其原料結果進行比較。F企業(進口原研)產品檢出雜質個數最少;其他國內企業的頭孢地尼仿制產品雜質主要集中在雜質A、雜質F、雜質G、H、雜質I、J、K、L、雜質M、N和雜質R,與頭孢地尼原料雜質譜基本一致。據以往研究資料表明,頭孢地尼雜質譜中常見雜質多為降解雜質(已知雜質中雜質C、雜質F、雜質G、雜質O和雜質S為原料合成時引入,其他雜質均為降解產生)。此次對頭孢地尼原料和制劑有關物質分析結果表明,制劑雜質含量與原料呈現一定的相關性,雜質個數和雜質含量在制劑過程中略有增加但不明顯(提供原料的企業中,其產品總雜質最高為1.12%)。以C企業為例,其提供的3#、4#原料雜質A含量分別為0.05%和0.17%,C企業28批次制劑中,3批樣品雜質A低于忽略限,1批次為0.09%,其余24批次均分布在0.16%~0.20%之間,與其提供的2批原料情況基本一致。說明該品種在制劑過程中雜質控制情況較好。
對ChP頭孢地尼有關物質分析方法進行評價。采用頭孢地尼已知雜質混合溶液,在3臺高效液相色譜儀上采用3根不同品牌的色譜柱,考察對已知雜質的準確定位情況,典型色譜圖見圖2。
結果表明,雜質譜中的主要雜質如雜質F、雜質G、雜質I、J、K、L、雜質N的相對保留時間與ChP參考值基本一致,而雜質A、雜質R及保留較強的雜質S、雜質T和雜質U的相對保留時間與ChP參考值差異較大,且不同系統之間亦存在一定的差異;其中,雜質S、雜質T和雜質U在系統適用性溶液色譜圖中易與未知雜質混淆導致結果誤判;雜質M的相對保留時間與ChP給出的參考值有一定的差異(雜質M和雜質N為同分異構體,雜質M的穩定性較差,實驗中幾乎全部轉化為雜質N,測定中雜質M和雜質N的含量合并計算,對測定結果影響不大)。提示對特定雜質的準確定位方法仍有待改善。
此外,結果顯示,H企業和G企業的產品采用《中國藥典》方法檢驗結果均較其各自執行的現行法定標準方法略偏高,以總雜質為例,兩企業樣品總雜質分別偏高0.08%~0.22%(平均值0.15%)和0.20%~0.50%(平均值0.27%),提示不同分析方法的專屬性仍存在一定的差異,企業現行法定標準使用的雜質相對響應因子及限度的合理性有待研究,質量標準仍有提高空間。
3.2.2 聚合物類雜質
參考文獻[5]制備堿聚合溶液,其特征圖譜見圖3。對圖中的雜質1~9進行定性研究(見表2),可見,其中含有多個頭孢地尼二聚體和三聚體同分異構體,并存在優勢聚合;雜質2(相對保留時間為2.12)的二聚體雜質為主要聚合物雜質,其特征質譜圖見圖4。頭孢地尼的3位的丙烯基結構異構化理論上可形成8種異構體(具有3個手性位點),頭孢地尼二聚體也可能在聚合中形成多種具有相同分子量的二聚體γ內酯[6]。本文中發現了多個分子離子峰(m/z)為791.1的二聚體同分異構體,進一步證明了二聚體γ內酯的存在。
在該色譜條件下,保留時間最大的已知雜質U的相對保留時間為2.0,頭孢地尼聚合物類雜質的相對保留時間均大于2.0,故將相對保留時間大于2.0的雜質總量作為有關物質Ⅱ(除聚合物雜質外,還存在少量的小分子雜質),控制聚合物類雜質的總量。
實驗選擇6個廠家的22批次頭孢地尼膠囊,7個廠家的26批次頭孢地尼分散片,1個廠家3批次頭孢地尼片及7批頭孢地尼原料按照所建立的反相高效液相色譜法測定有關物質Ⅱ,供試品特征色譜圖見圖5。樣品考察結果表明,僅H公司生產的1批頭孢地尼分散片(批號:20033002)有關物質Ⅱ的含量超過0.1%,說明頭孢地尼原料和制劑在生產和貯藏過程中不易聚合生成聚合物類雜質。
3.2.3 體外溶出行為
按照美國FDA推薦的生物藥劑學分類系統,頭孢地尼原料藥屬于BSC Ⅳ類[7],即低溶解性、低滲透性藥物。難溶性藥物溶出度是影響其生物利用度的重要因素,也是考察制劑質量的重要指標。經查詢,日本橙皮書中收錄有頭孢地尼膠囊溶出曲線(圖6)。
(1)頭孢地尼膠囊
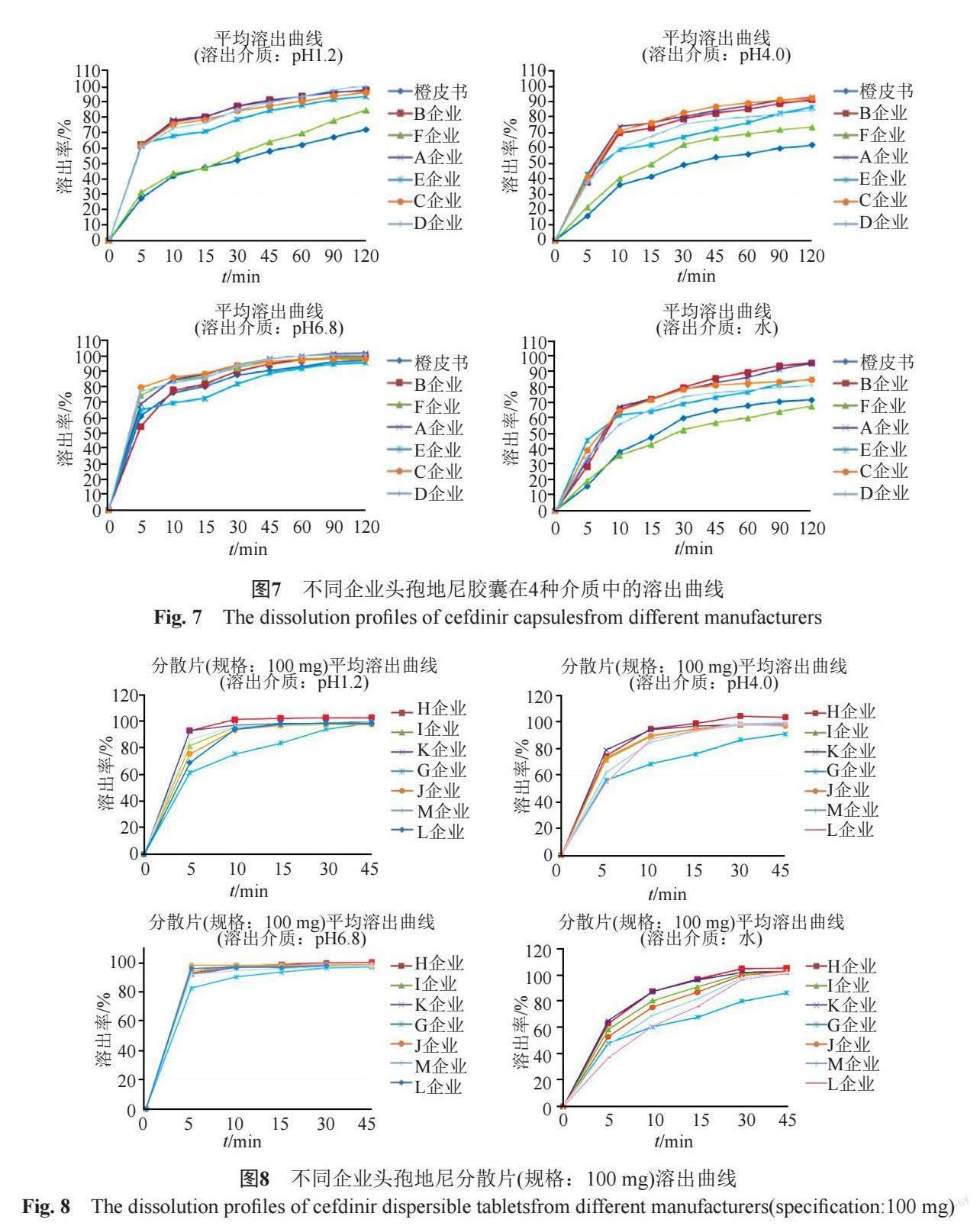
各企業的頭孢地尼膠囊在四種溶出介質中的溶出曲線見圖7,其中參比制劑(企業F(Choseido Pharmaceutical Co., Ltd. Kawauchi factory)生產的頭孢地尼膠囊[8])的溶出行為與橙皮書最為接近,5家國內生產企業樣品的溶出行為各不相同,且與橙皮書差異較大。
采用ChP頭孢地尼膠囊溶出度方法,對6家企業的頭孢地尼膠囊進行溶出曲線比較。15 min時,除F企業(參比制劑)外,其余5家企業膠囊劑的溶出度均達到85%以上。5家國產制劑的平均溶出曲線與參比制劑的相似因子(f2)均低于50(分布于30.9~40.2)。上述溶出曲線結果表明,5家國內企業頭孢地尼膠囊的處方及生產工藝與參比制劑之間均存在一定的差異,亦與橙皮書收載的原研制劑存在顯著差異。
分別對6家生產企業頭孢地尼膠囊溶出曲線差異性進行分析,批內差異和批間差異分析結果表明,D企業樣品的批間差異較大,3批樣品中有2批15 min時溶出度超過85%,另1批未達到80%;以前者為參比制劑,后者為受試制劑進行計算,相似因子(f2)為41.6,提示D企業的生產工藝穩定性有待提高。
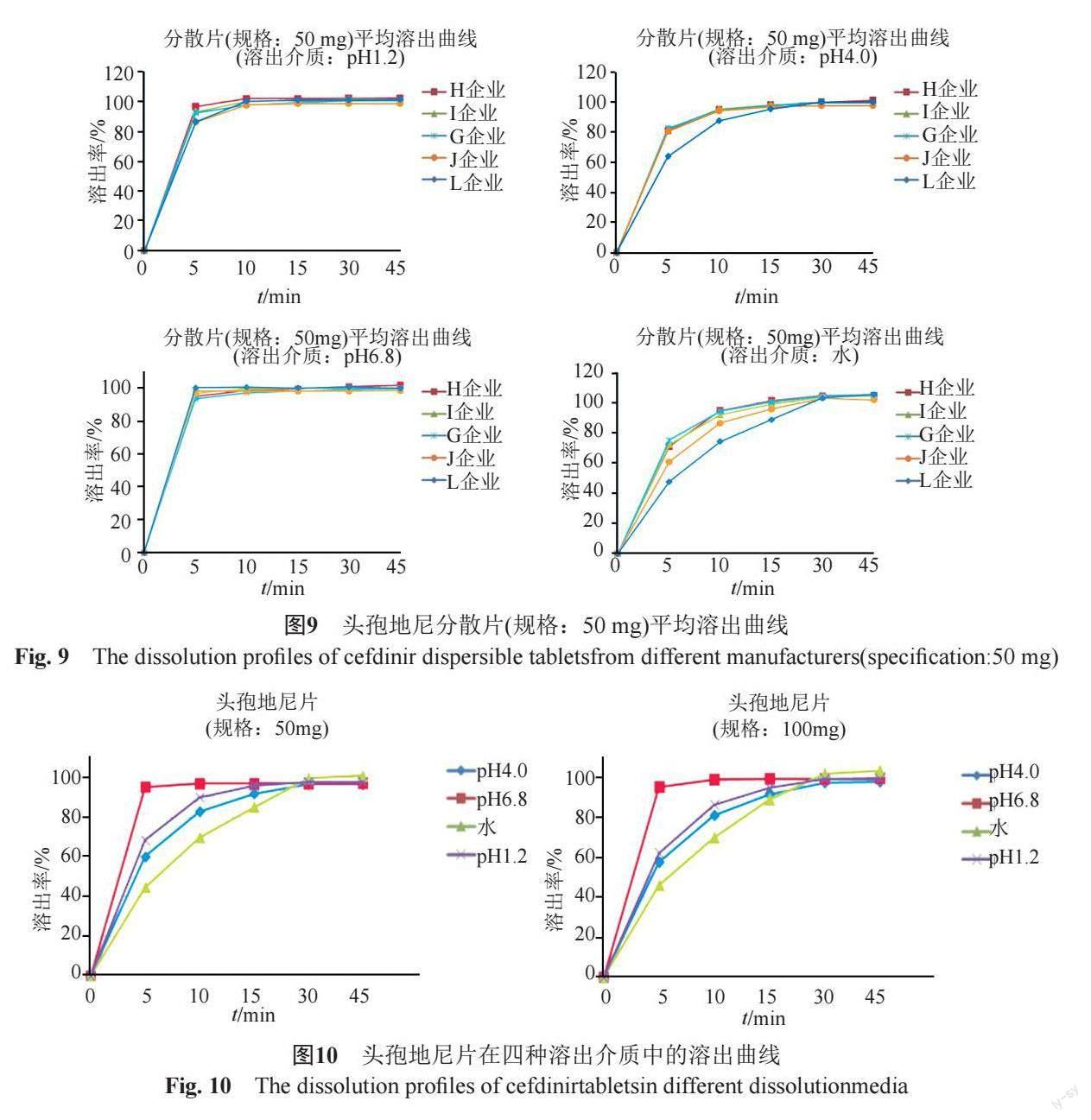
(2)頭孢地尼分散片
分別對7家企業2個規格頭孢地尼分散片的溶出曲線進行考察(圖8~9),結果表明,樣品在pH6.8磷酸鹽緩沖液中的溶出速度最快,在水中的溶出速率最慢;規格100 mg樣品45 min時的溶出度方達到85%,而50 mg樣品15 min時的溶出度已達到85%,可能與本品的低溶解特性相關。
進一步分析不同企業產品溶出特性的差異。L企業50 mg樣品在水和pH4.0醋酸鹽緩沖液中的溶出速度較其他企業同規格的樣品偏慢;G企業100 mg樣品在四種介質中的溶出速率均明顯低于其他企業同規格的產品,且樣品的批間差異較大,即G企業產品的工藝穩定性較差。企業應高度關注對工藝過程的控制,以保證產品的一致性。
(3)頭孢地尼片
頭孢地尼片僅涉及1家企業的兩個規格產品,樣品在四種溶出介質中的溶出行為基本一致(圖10)。結果表明,兩個規格的樣品批內的溶出曲線的重合性均較好,6 min時批內溶出曲線的變異系數已降至10%以下。
CFDA于2016年3月5日發布了《國務院辦公廳關于開展仿制藥質量和療效一致性評價的意見》,本次抽檢樣品中4家企業的產品已通過一致性評價,另有2家企業的產品于抽檢工作結束后亦通過了一致性評價。在一致性評價中,仿制制劑是否必須與參比制劑的溶出曲線相同一直是爭論的焦點。對本品的溶出特性研究表明,雖然本品的溶出曲線與橙皮書相比有一定的差異,但生物等效比體外溶出行為應更重要。在不同溶出介質中,國產頭孢地尼制劑溶出情況明顯快于參比制劑和橙皮書中的參比制劑。曾有文獻采用軟件模擬技術評價頭孢地尼膠囊制劑的有效性,認為現代制劑工藝使得頭孢地尼膠囊劑的溶出速率快于日本橙皮書中的參比膠囊劑,其生物利用度也得到了提高;從治療的角度來看都是有效制劑[9]。本研究的結果進一步說明,通過溶出行為評價/控制頭孢地尼等難溶性制劑的工藝穩定性較評價其生物等效性更有意義。
參 考 文 獻
國家藥典委員會. 中華人民共和國國家藥典臨床用藥須知化學藥和生物制品卷2015年版, 中國醫藥科技出版社: 678-679.
文斌, 王維. 抗生素歷史觀念的轉折點——世扶尼(頭孢地尼膠囊)[J]. 天津藥學, 2002, 14(1): 77.
胡昌勤. 對抗生素藥品評價性抽驗基本思路與方法的思考[J]. 中國抗生素雜志, 2013, 38(1): 1-11.
國家藥典委員會. 中華人民共和國藥典[S]. 北京: 中國醫藥科技出版社, 2020(二部): 297-301.
李進, 姚尚辰, 尹利輝. 頭孢地尼原料及制劑的聚合物雜質分析[J]. 中國抗生素雜志, 2020, 45(10): 1005-1016.
胡昌勤, 李進, 張夏. 7-氨噻肟頭孢菌素的聚合物分析[J]. 中國抗生素雜志, 2022, 47(3): 209-220.
Lindenberg M, Kopp S, Dressman J B.? Classification of orallyadministered drugs on the World Health Organization modellist of essential medicines according to the biopharmaceutics classification system[J]. Eur J Pharm Biopharm, 2004, 58(2): 265-278.
國家食品藥品監督管理總局. 總局關于發布普通口服固體制劑參比制劑選擇和確定等3個技術指導原則的通告(2016年第61號): 普通口服固體制劑溶出曲線測定與比較指導原則[EB/OL]. (2016-03-18)[2017-09-13]. http://www.sda.gov.cn/WS01/CL0087/147583.html.
潘瑞雪, 余方鍵, 鄒文博, 等. 用GastroPlus軟件模擬技術評價頭孢地尼膠囊制劑的有效性[J]. 中國新藥雜志, 2014, 23(13): 1506-1513.

