推拿?法對兔骨骼肌急性鈍挫傷組織TNF-α及SphK1、S1PR3表達的影響
王蘭蘭,薛惠天,孫夢龍,阮磊,黃博,彭亮
湖南中醫藥大學,湖南 長沙 410208
骨骼肌損傷是運動醫學中的常見損傷,90%以上骨骼肌損傷由挫傷或肌肉過度拉傷造成[1]。骨骼肌損傷的快速恢復需要一系列細胞和調控因子參與,其中肌纖維的持續變性、炎癥和纖維化都是影響肌肉再生的重要因素[2-3]。病理性纖維化是細胞外基質過度沉積引起正常組織被膠原瘢痕取代所致,導致組織功能障礙[3]。推拿對骨骼肌損傷纖維化相關疾病療效顯著[4-5]。腫瘤壞死因子-α(TNF-α)是介導炎癥反應的促炎因子,肌肉損傷后炎癥因子侵入損傷部位,炎癥反應的性質、持續時間和程度可對肌肉修復或纖維化產生重大影響[3,6-8]。鞘氨醇激酶-1(SphK1)屬于SphKs中的一員,主要位于細胞質,在鞘脂代謝過程中發揮細胞內信號轉導酶和關鍵限速酶的作用。SphK1能夠將鞘氨醇轉化為1-磷酸鞘氨醇(S1P)[9]。S1P是一種多生物活性鞘脂,是真核細胞信號轉導的重要介質。S1P與細胞膜上S1P受體(S1PR)結合后發揮作用,以調節對生物過程至關重要的信號通路,包括細胞生長、免疫細胞運輸和炎癥[10]。S1PR 是G-蛋白偶聯受體(GPCR)家族成員,包括5個亞型。研究發現,在轉化生長因子(TGF)-β1誘導的成肌細胞分化為肌成纖維細胞過程中,SphK1/S1PR3信號通路發揮關鍵作用[11]。此外,該信號通路軸也是結締組織生長因子發揮促纖維化作用的途徑[12]。本研究通過推拿手法中的?法對股四頭肌急性鈍挫傷兔進行干預,觀察其對股四頭肌組織形態和TNF-α含量及SphK1、S1PR3蛋白表達的影響,探討?法促進骨骼肌損傷修復的可能機制,并為?法的臨床應用提供實驗依據。
1 材料與方法
1.1 動物
新西蘭兔15 只(雌性7 只、雄性8 只),體質量2.5~3 kg,湖南中醫藥大學動物實驗中心提供,動物生產許可證號SCXK(湘)2020-0005。飼養于湖南中醫藥大學動物實驗中心普通級動物房,飼養環境由實驗室按最適溫度和濕度統一控制。適應性飼養7 d開始實驗。本實驗經湖南中醫藥大學動物倫理委員會審批(LLBH-202206270004)。
1.2 主要試劑與儀器
兔TNF-α ELISA 試劑盒(湖南艾方生物,貨號AF-00660R1),DAPI(武漢Servicebio,貨號G1012),HE染液(武漢Servicebio,貨號G1005),Masson染液(武漢Servicebio,貨號G1006),中性樹膠(國藥集團,貨號10004160),SphK1一抗(武漢三鷹,貨號10670-1-AP),S1PR3 一抗(英國Abcam 公司,貨號ab126622),β-actin 一抗(武漢Servicebio,貨號GB15001),戊巴比妥鈉(德國Merck 公司,貨號P3761)。病理切片機(上海徠卡儀器有限公司,型號RM2016),組織攤片機(金華市科迪儀器,型號KD-P),包埋機(武漢俊杰,型號JB-P5),掌上離心機(武漢Servicebio,型號D1008E),脫色搖床(武漢Servicebio,型號TSY-B),勻漿儀(武漢康濤科技有限公司,型號KZ-Ⅱ),電泳儀(北京六一儀器廠,型號DYY-6C),酶標儀(美國Bio-Tek,型號Epoch),顯微鏡(日本尼康,型號Eclipse E100),自制實驗動物?法器(授權公告號CN216365872U)。
1.3 分組及造模
將15只新西蘭兔按隨機數字表法分為空白組、模型組和?法組,每組5只。參考文獻[13-14]方法并改進,采用自制重力錘打擊裝置制備骨骼肌急性鈍挫傷模型。將兔仰臥位固定于兔架上,右后肢內側剃毛,將厚約1 cm的脫脂棉墊于右后肢股四頭肌遠心端下方,使其近心端和遠心端在同一水平。選取右后肢股四頭肌肌腹(約髕底上3.5 cm)中段,以2 cm為直徑畫圓圈作為打擊部位,在打擊部位覆蓋一層紗布防止皮膚受損。打擊時實驗人員雙手固定兔股四頭肌上下端,由專人控制重力錘,使重力錘沿導向管自由下落,同一部位連續打擊6次,高度40 cm,打擊面積約1.77 cm2,動能3.33 J,沖量2.38 Ns。以打擊部位皮膚出現明顯腫脹及瘀血,無皮膚受損及骨折,觸碰打擊部位時有躲避反射為造模成功標準。測量并記錄造模后損傷部位距髕底距離。
1.4 干預及取材
造模后第7日,使用本團隊前期設計的模擬?法實驗動物?法器(詳細介紹見本文OSID碼)對?法組兔股四頭肌損傷處進行干預,最大壓力3 N,滾動頻率140次/min,3 min/次,上下午各1次,連續3 d。空白組和模型組固定相同時間。末次干預24 h后取材,3%戊巴比妥鈉過量麻醉處死兔,選取股四頭肌損傷最嚴重處病灶組織取材,若損傷不明顯,則選取造模標記部位組織取材,將組織置于冰上快速分離肌肉和筋膜,并將肌肉組織分成3份,1份置于4%多聚甲醛,另外2份置于-80 °C冰箱保存備用。
1.5 指標檢測
1.5.1 HE染色
取出用4%多聚甲醛固定的股四頭肌組織,手術刀修剪,放入脫水盒,脫水機內梯度乙醇進行脫水,浸蠟,包埋機包埋,石蠟切片機切片(厚4 μm),將股四頭肌石蠟切片依次進行脫蠟,蘇木素、伊紅染色,梯度乙醇脫水,二甲苯透明,中性樹膠封片,顯微鏡下觀察并采集圖像。
1.5.2 Masson染色
股四頭肌石蠟切片依次進行脫蠟(二甲苯2次,每次20 min;梯度乙醇2次,每次5 min;水洗),重鉻酸鉀染色,鐵蘇木素染色,麗春紅酸性品紅染色,磷鉬酸染色,苯胺藍染色,1%冰醋酸分化,無水乙醇脫水,二甲苯透明5 min,中性樹膠封片,顯微鏡下觀察,采集圖像進行分析。
1.5.3 ELISA檢測
剪取適量股四頭肌組織,加入一定量PBS,勻漿器充分勻漿,3 000 r/min離心20 min,收集上清液。按照試劑盒說明書操作:加樣,加酶,溫育,配液,洗滌,顯色,終止反應,以空白孔調零,波長450 nm測量各孔吸光度(OD值),計算組織中TNF-α含量。
1.5.4 Western blot檢測
PBS洗滌股四頭肌組織,剪碎后置于勻漿管中,加入勻漿珠、蛋白酶抑制劑、裂解液制成勻漿,冰上裂解30 min,振蕩使組織完全裂解,4 ℃、12 000 r/min離心10 min,收集上清液,經過制膠、蛋白上樣、電泳、轉膜、封閉、抗體孵育(β-actin 一抗1∶2 000、SphK1一抗1∶3 000、S1PR3一抗1∶3 000,β-actin、SphK1、S1PR3二抗1∶5 000)、顯影曝光,以β-actin為內參,AlphaEaseFC處理系統分析目的蛋白相對表達量。
1.6 統計學方法
2 結果
2.1 ?法干預對模型兔股四頭肌病理變化的影響
HE染色顯示,空白組兔肌纖維、肌束形態完整,肌細胞排列整齊,細胞核分布于肌膜下方,無炎性細胞浸潤;模型組可見肌纖維變形、斷裂,肌細胞壞死嚴重,炎性細胞浸潤較明顯,由大量結締組織填充,肌膜模糊、不完整,且肌纖維溶解形成空泡結構,可見少量細胞核居中的新生肌纖維;?法組炎性細胞浸潤較模型組明顯減輕,可見大量細胞核居中且大小不等的新生肌纖維和多核肌管,結締組織明顯減少,肌膜較完整。見圖1。
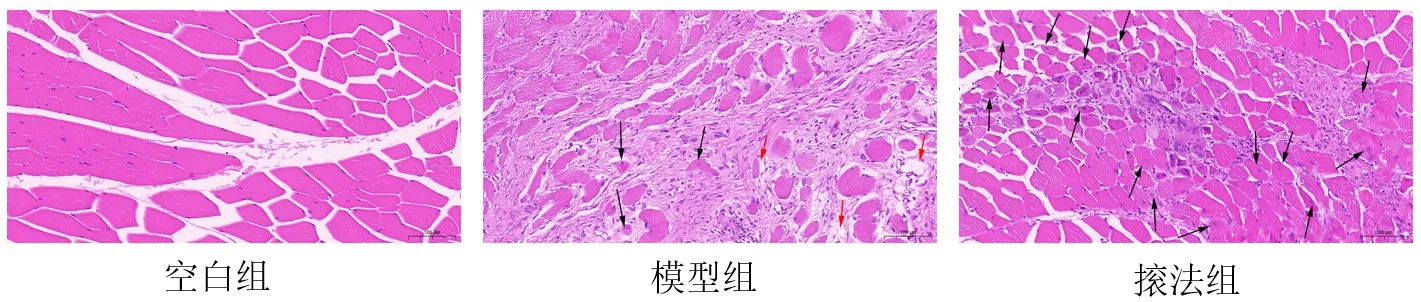
圖1 各組兔股四頭肌形態(HE染色,×200)
Masson染色中紅色表示肌纖維,藍色表示膠原纖維。空白組兔股四頭肌肌纖維排列整齊,可見少量膠原纖維;模型組肌纖維間隙明顯增大、排列分散,膠原纖維沉積明顯增多,纖維粗大,包繞于肌細胞、肌膜周圍,表明纖維化已形成;?法組兔肌纖維間隙較模型組減小,肌細胞排列整齊,膠原纖維生成減少。見圖2。
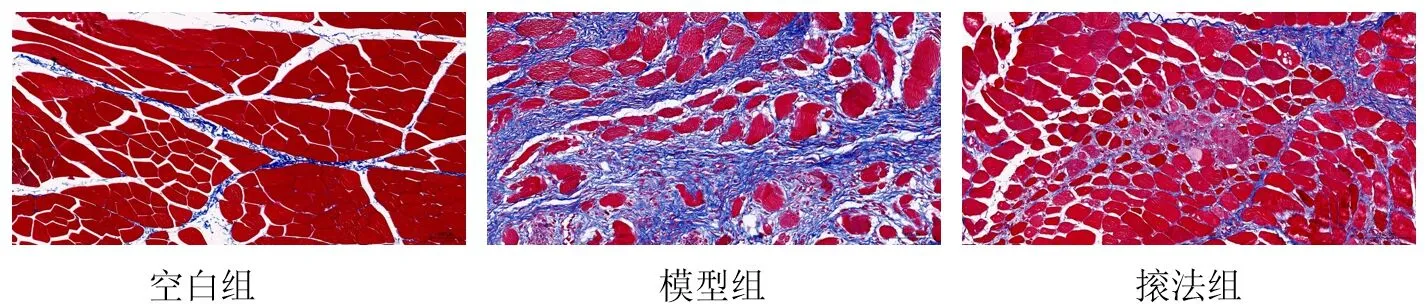
圖2 各組兔股四頭肌形態(Masson染色,×200)
2.2 ?法干預對模型兔股四頭肌組織腫瘤壞死因子-α含量的影響
與空白組比較,模型組兔股四頭肌組織TNF-α含量明顯增加(P<0.01);與模型組比較,?法組兔股四頭肌組織TNF-α含量明顯減少(P<0.05)。見表1。
表1 各組兔股四頭肌組織TNF-α含量比較(±s,pg/g)

表1 各組兔股四頭肌組織TNF-α含量比較(±s,pg/g)
注:與空白組比較,**P<0.01;與模型組比較,#P<0.05
TNF-α 2 125.95± 47.47 3 122.25±298.07**2 615.26±365.82#組別空白組模型組?法組只數555
2.3 ?法干預對模型兔股四頭肌組織鞘氨醇激酶-1和1-磷酸鞘氨醇受體3蛋白表達的影響
與空白組比較,模型組兔股四頭肌組織SphK1、S1PR3蛋白表達明顯升高(P<0.01);與模型比較,?法組兔股四頭肌組織SphK1、S1PR3蛋白表達明顯降低(P<0.05)。見圖3、表2。
表2 各組兔股四頭肌組織SphK1、S1PR3蛋白表達比較(±s)
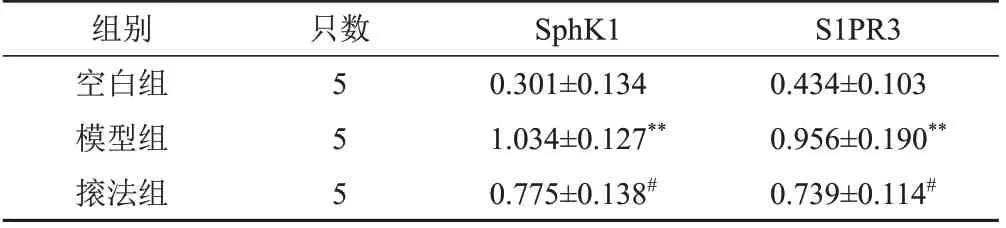
表2 各組兔股四頭肌組織SphK1、S1PR3蛋白表達比較(±s)
注:與空白組比較,**P<0.01;與模型組比較,#P<0.05
S1PR3 0.434±0.103 0.956±0.190**0.739±0.114#組別空白組模型組?法組只數555 SphK1 0.301±0.134 1.034±0.127**0.775±0.138#
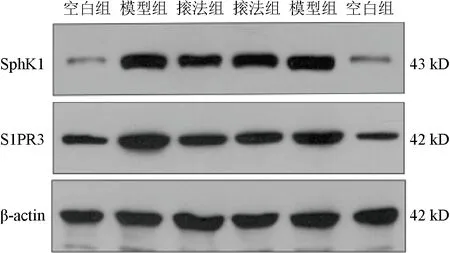
圖3 各組兔股四頭肌組織SphK1、S1PR3蛋白免疫印跡
3 討論
骨骼肌急性鈍挫傷是由鈍器造成的機械損傷,常引起肌細胞受損、毛細血管破裂及浸潤性出血、水腫、炎癥等。此外,由于血管和周圍組織廣泛受損,氧氣和營養物質無法到達神經和肌肉細胞,組織損傷將進一步加重[15]。骨骼肌損傷包括炎癥、再生和纖維化3個階段[16],損傷后的炎癥反應和纖維化是骨骼肌修復的必經過程。促炎因子過表達會加劇肌肉損傷,通過正反饋通路增強炎癥反應[17]。過度纖維化也是影響肌肉愈合的主要障礙,骨骼肌纖維化由細胞外基質過度沉積引起,導致骨骼肌功能和活動受限,影響肌肉損傷后再生;此外,纖維化還增加了肌肉損傷的易感性,易發生再次損傷[18-20]。因此,降低骨骼肌炎癥反應及纖維化,促進骨骼肌細胞再生是促進骨骼肌損傷后修復的重要研究方向。
TNF-α是參與炎癥反應的促炎因子之一,在組織損傷初期,TNF-α水平升高,并且由于其對細胞壞死的作用而持續升高[17]。研究表明,高水平TNF-α可能導致成肌細胞和肌細胞凋亡,從而導致肌肉萎縮[21]。SphK1/S1P/S1PR信號通路被認為是治療癌癥和炎癥性疾病的關鍵通路[22]。TNF-α 能激活位于細胞質的SphK1,活化的SphK1易位到質膜上,催化鞘氨醇磷酸化生成S1P[23]。在L929成纖維細胞和A549肺癌細胞中,TNF-α誘導的環氧合酶-2表達上調及促炎介質前列腺素E2的產生依賴SphK1的激活和S1P的合成[24]。此外,TNF-α誘導特定細胞因子、趨化因子和黏附分子(如IL-6、RANTES、MCP-1和VCAM-1)的轉錄也需要SphK1 的激活[25]。TNF-α 受體相關因子2(TRAF2)是TNF-α信號傳導的重要中間體,SphK1含有TRAF2 結合位點[26],其直接與TRAF2 結合產生S1P,S1P在N端指環結構域與TRAF2結合,促進賴氨酸-63連接的受體相互作用蛋白多泛素化、IκB激酶和IκBα磷酸化及IκBα降解,從而導致核因子-κB激活[27]。因此,抑制TNF-α/SphK1/S1P信號傳導對減輕炎癥具有重要意義。此外,SphK1與組織纖維化也密切相關,SphK1能夠促進基質金屬蛋白酶抑制劑-1表達,從而抑制細胞外基質降解[28];抑制SphK1表達導致TGF-β刺激膠原蛋白生成受阻,還可能誘導成纖維化細胞凋亡,從而減少纖維化[29-30]。S1P異常激活會促進炎癥、纖維化等發生[30],活化的S1P主要與S1PR發生一系列反應[31],敲除S1PR2、S1PR3或SphK1均可抑制TGF-β1誘導的體外肌成纖維細胞分化[32];S1P在臀肌攣縮患者肌肉中表達升高,外源性S1P刺激可以促進成纖維細胞增殖,增加膠原和其他纖維化因子的合成[33]。S1PR3參與不同組織如骨骼肌、肺臟和肝臟的纖維化發展[11,34-35],S1PR3及其下游信號通路被認為是成肌細胞分化為肌成纖維細胞的候選靶點[36],而肌成纖維細胞在纖維化發生中起主要作用[37]。因此,纖維化的發生也與SphK1/S1P/S1PR3信號通路密切相關。
本研究結果顯示,骨骼肌損傷后,模型組兔股四頭肌組織TNF-α含量及SphK1、S1PR3表達明顯高于空白組,HE染色顯示炎性細胞浸潤較明顯,肌纖維變形斷裂,肌細胞壞死嚴重,肌膜模糊不完整,且有肌纖維溶解后形成的空泡結構,可見少量新生肌纖維,Masson染色顯示大量膠原纖維,說明造模成功。?法組兔股四頭肌組織TNF-α含量及SphK1、S1PR3表達明顯低于模型組,HE染色可見炎性細胞浸潤較模型組明顯減輕,有大量新生肌纖維和多核肌管,Masson染色顯示膠原纖維較模型組明顯減少,提示?法可能通過降低TNF-α含量,減少SphK1激活和下游因子S1P產生,進而抑制細胞內S1P介導的核因子-κB激活,并阻斷S1P與S1PR3的信號傳導,從而發揮減緩炎癥和纖維化的作用。
綜上所述,?法干預能抑制骨骼肌急性鈍挫傷兔受損組織TNF-α含量SphK1、S1PR3表達,減輕炎癥反應,減緩組織纖維化,促進肌細胞新生,從而促進骨骼肌損傷后修復。本研究可為?法治療骨骼肌損傷提供實驗依據,?法對TNF-α/SphK1/S1PR3信號通路的上下游調節機制仍待進一步探索。

