預后營養指數、白球比在晚期非小細胞肺癌免疫治療療效評估中的價值
韓宇 徐興祥
根據國際癌癥研究機構(International agency for research on cancer,IARC)最新制定的GLOBOCAN 2020[1]標準,肺癌仍然是癌癥死亡的主要原因(占癌癥死亡總數的18.0%),估計5 年總生存期(Overall survival,OS)仍然只有16%。其中非小細胞肺癌(Non-small cell lung cancer,NSCLC)約占所有肺癌的80%~85%,并且大多數患者表現為晚期轉移性疾病,盡管在過去的幾十年里,包括手術、化療、放療特別是分子靶向治療的出現已取得了很大進展[2],但患者的中位生存期仍低于12 個月。免疫檢查點阻斷療法對NSCLC 的治療,是癌癥免疫療法的一個里程碑式的進步,不僅提高了患者的生存率,而且改變了NSCLC 的治療模式。然而非選擇人群免疫檢查點抑制劑(Immune checkpoint inhibitors,ICIs)應答率不到20%[3],大部分患者可能承擔了昂貴的治療費用卻未產生明顯應答,并且可能要承受免疫治療帶來的多種不良反應,因此識別免疫檢查點阻斷(Immune checkpoint blocking,ICB)反應生物標記物和耐藥調節劑是該領域的關鍵。PD-L1 表達是目前研究相對成熟的預后生物標志物,但PD-L1 表達具有隨時間動態變化、腫瘤內異質性等局限[4~6],且在動態檢測中,腫瘤標本的獲取也比較困難,所以通過免疫組織化學檢測腫瘤組織中PD-L1 的表達不能確定所有可能受益于這種治療的個體。作為生物標志物來源,外周血較腫瘤組織更易于獲取。因此本研究主要探究預后營養指數(Prognostic nutritional index,PNI)、白 球比(Albumin to globulin ratio,AGR)對免疫治療療效及預后的預測價值。
1 材料與方法
1.1 一般資料回顧性收集2018 年1 月~2022 年1月在蘇北人民醫院呼吸內科經支氣管鏡活檢或CT引導下肺穿刺活檢病理證實為NSCLC,并接受免疫抑制劑治療的69 例患者為研究對象,所有患者均具有完整的臨床資料、外周血指標和胸部CT 影像學結果。納入標準:①年齡≥18 歲,患者的體力狀況評分(Performance status,PS)為0~1 分;②PDL1 表達>1%;③經組織病理學初次確診為Ⅳ期NSCLC;④所有患者均簽署知情同意書;⑤免疫治療方案均為程序性死亡受體1(PD-1)抑制劑聯合鉑類及紫杉醇/培美曲塞化療(一線治療),至少接受4 個周期治療;⑥具有首次接受免疫治療當日或前7 天內完整的外周血液學相關資料,包括外周淋巴細胞計數、血清白蛋白濃度、總蛋白濃度、球蛋白濃度;⑦所有患者均可獲得與免疫治療相關的精確日期,治療前后有影像學資料可供評估。排除標準:①非原發性肺癌患者;②合并其他惡性腫瘤者;③血液系統疾病,長期或正在使用激素及免疫抑制劑治療的自身免疫性疾病者;④臨床資料不完整者。
1.2 觀察指標通過電子病歷收集69 例患者的一般資料,包括性別、年齡、吸煙狀態、免疫治療前PS評分、組織病理類型、腫瘤分期、免疫治療方案及治療線數、遠處轉移部位數。所有晚期NSCLC 患者在首次接受免疫治療之日或前7 天內完整的外周血液學相關指標資料,并計算PNI、AGR。PNI=血清白蛋白(g/L)+5× 淋巴細胞計數(109/L)。AGR=白蛋白/(總蛋白-白蛋白)。免疫抑制劑為納武利尤單抗和帕博利珠單抗。以免疫治療前PNI、AGR 作為檢驗變量,隨訪截止時的疾病控制情況作為狀態變量,繪制相關受試者工作特征曲線(Receiver operating characteristic curve,ROC),評 估其診斷價值,通過ROC 曲線計算約登指數,約登指數=敏感度+特異性-1,約登指數最大時敏感度、特異性最好。約登指數最大時對應的截斷值為最佳截斷值,以最佳截斷值為截點將PNI 與AGR 各分為高低兩組,即高PNI 組(H-PNI 組)、低PNI 組(L-PNI 組);高AGR 組(H-AGR 組)、低AGR 組(L-AGR 組)。
1.3 療效評估腫瘤分期按照第8 版肺癌TNM[7]分期。患者每3~6 周進行一系列臨床評估和放射成像,或在懷疑疾病發生進展時通過影像學檢查進行短期療效評估。病情評估參照實體腫瘤療效評價標準(RECIST)1.1[8],分為完全緩解(CR,所有目標病灶消失),部分緩解(PR,基線病灶長徑總和縮小≥30%),疾病穩定(SD,基線病灶長徑總和有縮小但未達PR 或有增加但未達PD)和疾病進展(PD,基線病灶長徑總和增加≥20%或出現新病灶)。客觀緩解定義為完全緩解或部分緩解(ORR=PR+CR),疾病控制定義為完全緩解、部分緩解或疾病穩定(DCR=CR+PR+SD)。無進展生存期(PFS)定義為從接受免疫治療開始,到觀察到疾病進展或者其他任何原因導致患者死亡的日期。所有患者通過電話、短信或查找住院及門診病例的方法隨訪至2022 年12 月31 日或任何原因死亡。記錄患者出現病情進展或死亡的時間作為終點事件。
1.4 觀察指標觀察各組患者的PFS、客觀緩解率(ORR)及疾病控制率(DCR)。
1.5 統計學方法采用SPSS 26.0 統計軟件進行數據分析,計數資料以n 或%表示,采用卡方檢驗。采用Kaplan-Meier 法進行單因素生存分析,采用Log-rank 檢驗分析和比較各組間生存差異。將單因素分析中差異有統計學意義的因素納入Cox 比例回歸模型進行多因素分析。所有統計檢驗均為雙側,P<0.05 表示差異具有統計學意義。
2 結果
2.1 PNI、AGR 最佳截斷值PNI、AGR 指標ROC曲線下面積(Area under the curve,AUC)均大于0.6,具有較好的預測價值。結果顯示,PNI 的最佳截斷值為41.75(此時敏感度為0.472,特異性為0.848,AUC 為0.659),根據截斷值把將患者分為兩組,當PNI ≥41.75 時為高PNI(H-PNI)組,當PNI<41.75 時為低PNI(L-PNI)組。見圖1。AGR的最佳截斷值為1.35(此時敏感度為0.750,特異性為0.727,AUC 為0.776),根據截斷值將患者分為兩組,當AGR ≥1.35 時為高AGR(H-AGR)組,當AGR<1.35 時為低PNI(L-AGR)組。見圖2。

圖1 PNI 的ROC 曲線
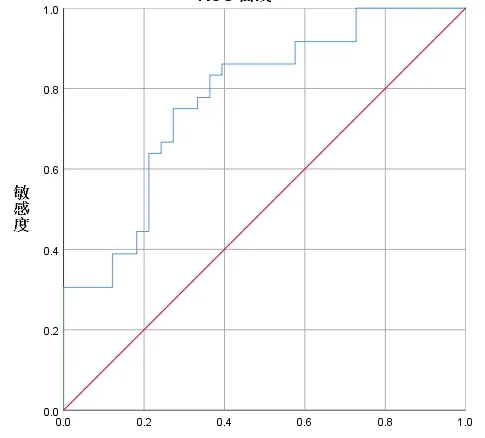
圖2 AGR 的ROC 曲線
2.2 Kaplan-Meier 單因素分析應用Kaplan-Meier進行單因素分析與患者預后相關的ORR、DCR 及PFS 指標,結果顯示:ORR、DCR 及PFS 與患者的性別、年齡、吸煙史、病理類型、遠處轉移部位無關,差異均無統計學意義(P>0.05);H-PNI 組與L-PNI 組患者中位PFS 比較,差異具有統計學意義(P=0.000),H-AGR 組與L-AGR 組患者中位PFS比較,差異具有統計學意義(P=0.000)。見表1。
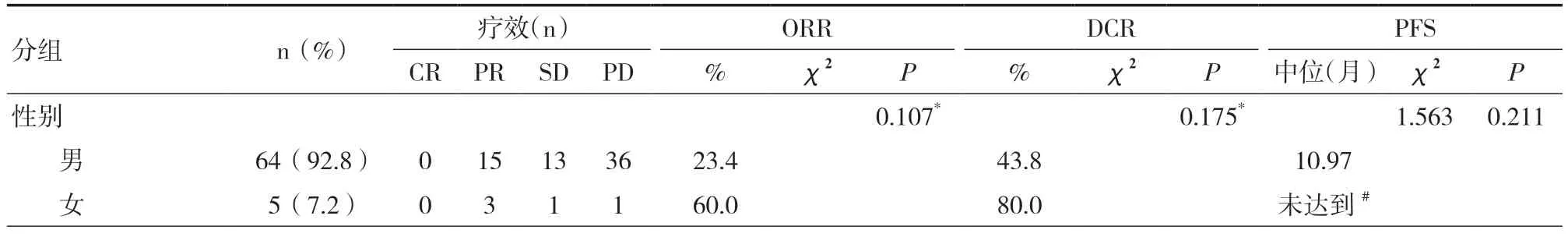
表1 ORR、DCR 與PFS 單因素分析
2.3 Cox 比例回歸多因素分析PNI、AGR 與PFS 的Kaplan-Meier 單因素分析結果提示PNI、AGR 均是PFS 的預后因素,差異有統計學意義。將PNI、AGR納入Cox 比例回歸多因素分析,結果顯示:PNI、AGR 是PFS 的獨立危險因素。見表2。

表2 Cox 比例回歸多因素分析
3 討論
近年來,主要由炎癥細胞維持的腫瘤微環境被認為是腫瘤形成過程中不可或缺的參與者,其促進了腫瘤的增殖、存活和遷移[9]。血清白蛋白[10~12]是宿主炎癥反應和營養狀況的重要指標,已被證明與各種癌癥類型的預后相關。淋巴細胞通過啟動細胞毒性免疫反應和抑制癌細胞增殖、侵襲和遷移,在癌細胞防御中發揮關鍵作用。總之,血清白蛋白和總淋巴細胞可以作為慢性炎癥、免疫和營養狀況的觀察指標,PNI 是根據血清白蛋白水平和外周血總淋巴細胞計數計算得出[13,14]。近幾年有研究[15]發現治療前PNI 水平既是ICI 治療反應的預測因素,也是NSCLC 患者ICI 治療后的預后因素。此外有研究[16]發現AGR 不僅與NSCLC 對抗PD-1 抗體的抗腫瘤反應相關,而且與PFS 和OS 相關,認為治療前血清AGR 可作為NSCLC 患者抗PD-1 治療的疾病控制和預后因素的有用預測因子。
因此本研究通過回顧性收集2018 年1 月~2022 年1 月就診于蘇北人民醫院呼吸內科接受免疫聯合化療一線治療的69 例晚期NSCLC 患者的臨床資料,分析治療前PNI、AGR 對免疫治療療效及預后的價值。結果顯示:治療前PNI、AGR 血清水平高于截斷值的患者顯示出更好的DCR、PFS。治療前不同PNI 組的患者ORR 差異無統計學意義,但是H-PNI 組顯示出療效較好的趨勢。而高AGR組患者ORR 高于低AGR 組,差異具有統計學意義。因此,本研究認為PNI、AGR 可以作為預測NSCLC免疫治療療效及預后的生物標志物。
考慮到高昂的治療費用、潛在的嚴重毒性和在治療無效情況下早期進展的危害,因此評估額外的、價格低廉和容易獲得的預后標志物勢在必行。作為生物標志物來源,外周血比腫瘤組織更易獲取、價格低廉。早期識別無應答者可幫助臨床醫生及時實施適當的治療策略,使患者盡可能早受益。
本研究局限性:本研究為單機構回顧性研究,納入的患者數量較少,有必要進行多中心大規模前瞻性研究,以評估本研究中采用的PNI、AGR 截斷值對免疫治療療效及預后的價值;由于是回顧性設計,使用的免疫抑制劑(納武利尤單抗和帕博利珠單抗)不同可能對療效也會產生影響。此外本研究沒有對PD-L1 進一步分層,作為回顧性研究,臨床資料主要靠病例收集,雖然部分患者病例并未準確書寫PD-L1 具體表達量,但是接受免疫聯合化療的患者都保證PD-L1 表達>1%。因此,有必要對更多患者進行進一步的研究,以確定外周血指標在預測抗PD-1 治療結果和NSCLC 患者預后方面的臨床應用。

