人工肝治療次數及模式對肝衰竭患者生存時間的影響
王一帆,楊艷芬,史 詩,鄧春青
(1.山西醫科大學第一臨床醫學院 內科,山西 太原,030001;2.山西醫科大學公共衛生學院,山西 太原,030001;3.山西醫科大學第一醫院 感染病科,山西 太原,030001)
肝衰竭是多種因素引起的嚴重肝臟損害,導致合成、解毒、代謝和生物轉化功能嚴重障礙或失代償,出現以黃疸、凝血功能障礙、肝腎綜合征、肝性腦病、腹水等為主要表現的一組臨床癥候群[1]。肝衰竭因其病情兇險、并發癥多、進展快,導致病死率較高,臨床病死率高達70%以上[2]。研究[3]表明,慢加急性肝衰竭患者預后極差,28 d病死率為30%~90%。由于內科治療效果有限,肝移植經濟負擔較重,而非生物性人工肝(NBAL)既可以減輕肝臟負擔,幫助恢復肝臟功能,又為肝移植提供機會并爭取時間[4],所以人工肝技術在臨床上迅速推廣。目前,中國應用的人工肝模式主要為血漿置換(PE)和雙重血漿分子吸附系統(DPMAS)[5]。本研究探討人工肝治療次數及模式對肝衰竭患者預后的影響,現報告如下。
1 資料與方法
1.1 一般資料
選取2019年1月—2022年3月診斷為肝衰竭并行人工肝治療的患者102例為研究對象,其中男56例,女46例,年齡14~79歲,平均(47.69±14.46)歲;肝衰竭病因中,病毒性肝炎39例(38.24%),藥物性肝損害24例(23.53%),不明原因肝病16例(15.69%),原發性膽汁性膽管炎10例(9.80%),酒精性肝病8例(7.84%),其他原因5例(4.90%);肝衰竭類型包括急性肝衰竭22例,亞急性肝衰竭17例,慢加急性肝衰竭49例,慢性肝衰竭14例。本研究通過山西醫科大學第一醫院倫理委員會審批批準{[2022]倫理字(K-K101)號)}。
納入標準:① 2019年1月—2022年3月就診于山西醫科大學第一醫院感染病科者;② 參照《肝衰竭診治指南(2018年版)》[1],診斷為肝衰竭者;③ 按照《非生物性人工肝治療肝衰竭指南(2016年版)》[6]行人工肝治療者。排除標準:因各種原因而導致資料無法收集者。
1.2 方法
所有患者均接受常規內科治療和人工肝治療,內科治療包括保肝、退黃、抗感染、補充白蛋白、糾正水電解質及酸堿失衡和預防并發癥等,根據不同患者病情選擇不同人工肝治療模式,治療次數不限。本研究中,行PE治療69例,DPMAS治療2例,PE+DPMAS治療31例。共計行人工肝治療310次,其中PE模式 225次,DPMAS模式 17次,PE+DPMAS模式68次。行1次人工肝治療者16例,2次治療者30例,3次者21例,4次者18例,5次者10例,6次者3例,7次者2例,8次者1例,9次者1例。
1.3 觀察指標
觀察102例患者入院時、每次人工肝前后的丙氨酸氨基轉移酶(ALT)、天門冬氨酸氨基轉移酶(AST)、白蛋白(ALB)、總膽紅素(TBIL)、直接膽紅素(DBIL)、凝血酶原時間活動度(PTA)等指標變化,隨訪所有患者24周(自入院當天開始)的生存結局。將所有資料歸納整理,統計分析,分別按人工肝模式、人工肝治療次數分組,對各項化驗指標及生存時間等資料進行比較分析。
1.4 統計學分析
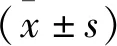
2 結 果
2.1 人工肝治療次數對肝衰竭患者預后的影響
2.1.1 4組患者人工肝治療前后各項化驗指標比較:4組肝衰竭患者治療前ALT、AST、TBIL、ALB、PTA指標比較,差異無統計學意義(P>0.05);1次人工肝治療組患者治療后ALT、AST高于其他組;2~4次人工肝治療組患者ALB改善情況低于其他組;1、2~4次人工肝治療組患者PTA改善情況低于5次人工肝治療組、≥6次人工肝治療組,上述差異均有統計學意義(P<0.05),見表1-1、1-2、1-3。
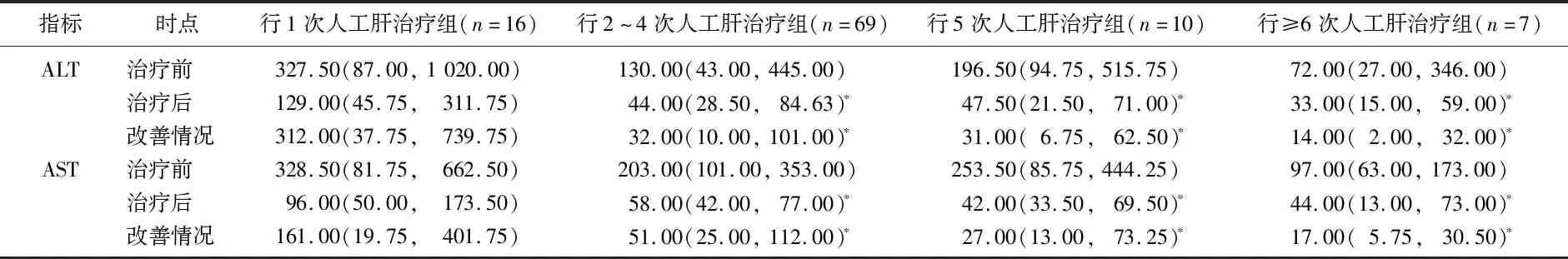
表1-1 行不同人工肝治療次數的肝衰竭患者ALT、AST指標[M(P25,P75)] U/L
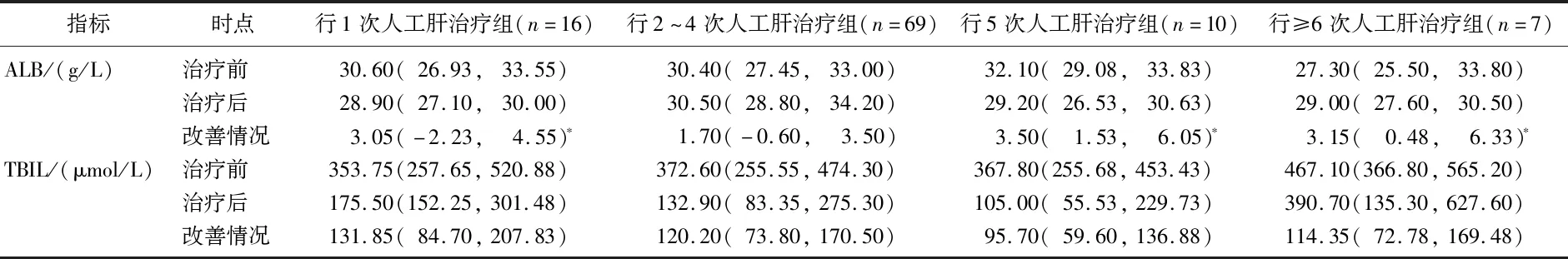
表1-2 行不同人工肝治療次數的肝衰竭患者ALB、TBIL指標[M(P25,P75)]
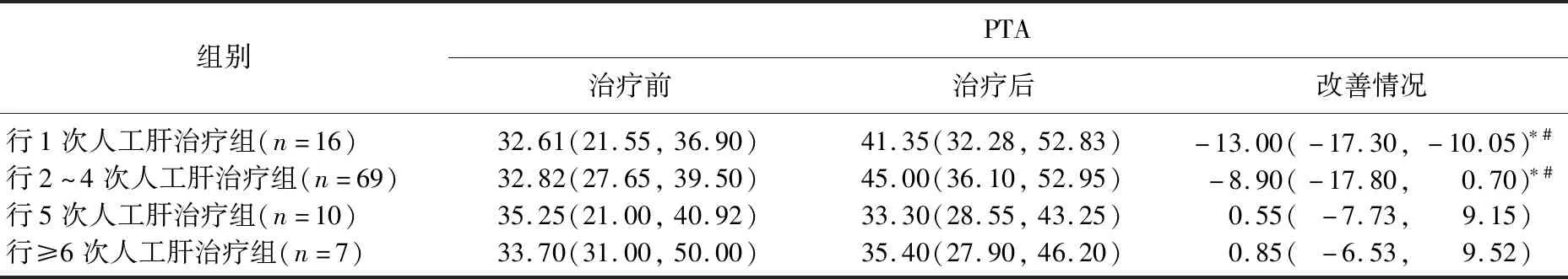
表1-3 行不同人工肝治療次數的肝衰竭患者PTA指標[M(P25,P75)] %
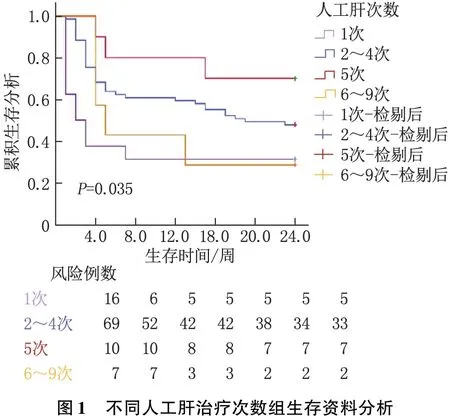
2.1.2不同人工肝治療次數組生存資料分析:以4組生存資料建立Kaplan-Meier生存模型,并行Log-rank檢驗。結果表明,4組生存率比較,差異有統計學意義(P<0.05)。結合數據看,行5次人工肝治療患者24周生存率最高,行6~9次人工肝治療患者24周生存率最低。生存曲線見圖1。
2.2 人工肝治療模式對肝衰竭患者預后的影響
2.2.1 人工肝治療前后各項化驗指標比較:行DPMAS模式治療的肝衰竭患者較少,所以以下只比較PE組和聯合治療組間各項化驗指標。2組肝衰竭患者治療前、治療后的ALT、AST、TBIL、ALB指標以及其改善情況比較,差異無統計學意義(P>0.05);治療前PE組PTA低于聯合組,差異有統計學意義(P<0.05),見表2。
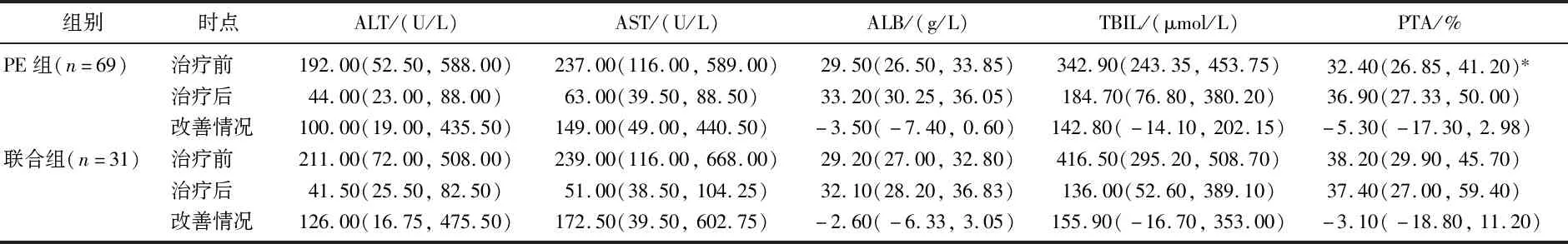
表2 行不同人工肝治療模式的肝衰竭患者各項化驗指標指標[M(P25,P75)]
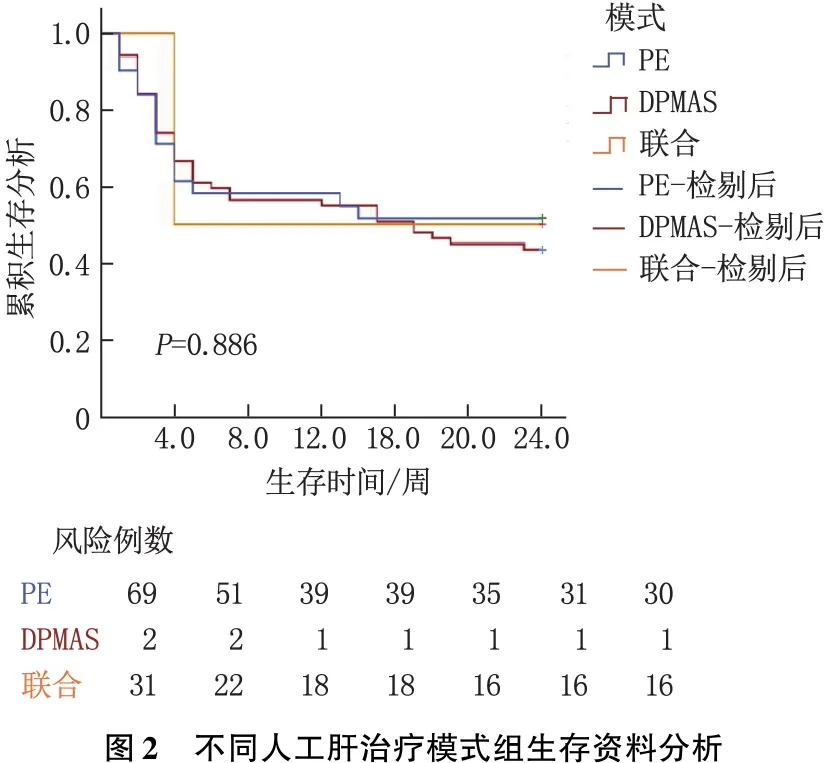
2.2.2 不同人工肝治療模式組生存資料分析:以3組生存資料建立Kaplan-Meier生存模型,并行Log-rank檢驗。結果表明,3組生存率比較,差異無統計學意義(P>0.05),見圖2。
2.3 不同年齡生存資料分析
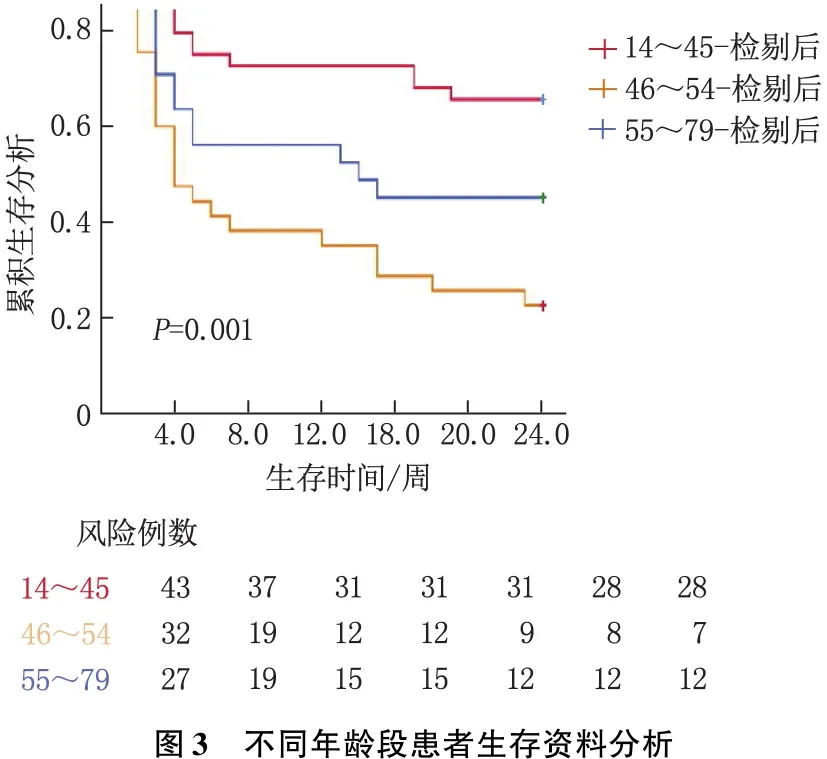
以不同年齡段生存資料建立Kaplan-Meier生存模型,并行Log-rank檢驗。結果表明,不同年齡段生存率比較,差異有統計學意義(P<0.05),結合數據看,14~45歲患者24周生存率最高,46~54歲患者生存率最低。生存曲線見圖3。
3 討 論
人工肝支持系統(ALSS)已經發展成為清除毒素、提高肝臟再生能力的治療手段[3]。PE治療模式是目前國內應用最廣的非生物性人工肝治療方式,能夠有效清除血液中的毒性物質,同時補充凝血因子和白蛋白等物質,但其對血漿的需求量較大,易發生過敏現象,并且可能會加重肝性腦病[7-9]。DPMAS治療模式能夠迅速清除患者血漿中的膽紅素、炎性物質、各種毒素等,改善患者的高膽紅素血癥、肝性腦病、炎癥反應等,不需要外源性血漿,但其不能補充凝血因子、白蛋白等,且體外循環容積較大,易發生低血壓[9]。PE+DPMAS治療模式結合兩者優點,既能夠徹底清除患者體內膽紅素、毒素等,又能夠補充凝血物質及白蛋白,且有效減少血漿用量,對鉀離子、血紅蛋白、血小板等影響也更小[9-11]。目前,關于不同人工肝治療模式對肝衰竭患者生存時間影響的研究結論并不完全相同,有研究[12-13]顯示PE+DPMAS治療模式4、12周生存率顯著高于PE組,也有研究[14-15]顯示PE與DPMAS治療模式之間、DPMAS與PE+DPMAS治療模式間12周生存率相當。本研究結果與后者相同,3種不同人工肝治療模式間患者的24周生存率無顯著差異,可見相比于選擇療效更全面的PE+DPMAS模型而言,根據患者個體情況選擇合適的人工肝模式更重要,不同的人工肝模式并不會對患者生存時間造成差異。
一項關于撲熱息痛引起肝衰竭的研究[16]發現,根據理論假設,連續3個療程的血漿置換會將分布在細胞外液中的“毒素”濃度降低到末次置換結束時初始濃度的18%,而額外的療程在理論上只會將其降低到16%[4]。這只是理論假設,和實際相比可能有一些出入,但也可以說明血漿置換次數是有臨界值的,超過臨界值次數而病情仍未見好轉者,生存時間可能會縮短。本研究結果顯示,行1次人工肝治療患者較行2~5次人工肝治療患者的24周生存率顯著下降(P<0.05),且行1次人工肝治療患者4周內生存曲線下降最明顯。既往研究[3,17-18]發現,人工肝治療次數與預后相關,行2、3、4次人工肝治療患者的生存期均較治療1次的患者延長,且隨著人工肝治療次數增加,生存時間明顯延長,原因可能與行1次人工肝治療患者的病情重、不能耐受或未能及時行下一次人工肝治療有關。本研究還顯示,人工肝治療次數≥6次患者的24周生存率較行2~5次者顯著下降(P<0.05)。一項關于兒童肝衰竭的研究[19]也顯示,如果不行肝移植,血漿置換≥6次對患者幾乎沒有益處。上述結果表明,多次人工肝治療較單次治療者生存率提高,且隨著人工肝次數增加生存時間延長,然而≥6次人工肝治療者生存率反而下降。但關于Kondrup的研究只是針對藥物性肝衰竭的研究,對于病毒性或自身免疫性肝衰竭患者,情況可能有所不同。本研究將繼續收集更多樣本來驗證上述研究結果。
既往研究[20-21]認為年齡、病因、PTA、ALB、TBIL、肝腎綜合征、腹水、電解質紊亂、自發性腹膜炎、上消化道出血、肝性腦病、腦水腫等并發癥與肝衰竭患者預后密切相關,其中年齡>40歲是影響肝衰竭患者短期預后的獨立危險因素,年齡越大,病死率越高。本研究發現,不同年齡組間患者生存率不同,其中≥55歲組患者較46~54歲組患者的24周生存率顯著更高,考慮原因可能為:46~54歲組患者年齡較低,患者及其家屬多愿意積極治療,即使一部分患者病情危重,也同意行人工肝治療,所以生存率較低;而≥55歲患者考慮其年齡大,潛在風險高,家屬多愿意保守內科治療,同意行人工肝治療的患者多病情較輕,所以生存率較高。
綜上所述,人工肝治療可以改善肝衰竭患者預后。人工肝次數和患者年齡對其預后影響顯著。

