環狀RNA_0005273對食管癌細胞生物學行為的影響及可能機制
姜 哲,韓佳慧,吳 婷,萬 盧,童 強
(1.錦州醫科大學十堰市太和醫院研究生培養基地,湖北 十堰,442000;2.湖北省十堰市太和醫院 腫瘤科,湖北 十堰,442000;3.湖北省武漢亞洲心臟病醫院 心功能科,湖北 武漢,430000;4.湖北省十堰市太和醫院 消化內科,湖北 十堰,442000)
食管癌是中國常見的惡性腫瘤,早期診治有助于改善患者預后,但食管癌早期癥狀較為隱匿,導致大部分患者確診時已處于中晚期。分子靶向治療、基因治療等方法已被用于腫瘤治療中,食管癌的發病機制目前尚未明確,探究食管癌的發病機制有助于尋找靶向治療的潛在靶點[1]。環狀RNA(circRNA)屬于內源性非編碼RNA分子,因不具有5′端帽子與3′尾巴,不易被外切核酸酶降解。研究[2-4]顯示,circRNA在食管癌中表達異常,并對細胞增殖、遷移等生物學過程發揮調控作用。環狀RNA_0005273(circ_0005273)在結直腸癌組織中表達升高,且與腫瘤生長及轉移相關,還可促進細胞增殖與轉移[5]。研究[6]表明,circ_0005273與微小RNA-1200(miR-1200)存在結合位點,且miR-1200表達上調可促進腫瘤細胞凋亡并抑制細胞增殖。靶基因預測軟件預測結果顯示miR-1200與信號轉導與轉錄激活因子3(STAT3)存在結合位點,而食管癌細胞增殖、遷移和侵襲與STAT3表達上調有關[7]。circ_0005273/miR-1200/STAT3在食管癌中的作用機制尚不明確,本研究探討circ_0005273對miR-1200/STAT3表達的調控作用及其對食管癌細胞生物學行為的影響,以期為食管癌發病機制的研究提供一定參考依據。
1 材料與方法
1.1 材料與試劑
選取2019年3月—2020年4月在湖北省十堰市太和醫院行手術切除治療的51例食管癌患者作為研究對象,男31例、女20例,年齡45~66歲,平均(55.24±6.46)歲,取患者癌組織和癌旁組織標本作為研究樣本。所有研究對象經病理診斷確診食管癌,未合并其他惡性腫瘤及自身免疫性疾病,并在明確各項操作步驟與注意事項的情況下自愿簽署知情同意書。本研究符合《赫爾辛基宣言》標準并經十堰市太和醫院倫理委員會審核批準。
人食管癌細胞EC109購自上海聯邁生物工程有限公司;Lipofectamine 3000和Trizol試劑購自美國invitrogen公司;cDNA反轉錄和實時熒光定量聚合酶鏈反應(qRT-PCR)相關試劑盒購自天根生化有限公司;si-circ_0005273、miR-1200 mimics、anti-miR-1200及其相應的陰性對照(si-NC、miR-NC)由銳博生物合成;噻唑藍(MTT)試劑和細胞凋亡遷移相關檢測試劑盒分別購自碧云天生物技術有限公司、北京索萊寶有限公司。LightCycler480型熒光定量PCR儀購自上海Roche公司;FACS Calibur流式細胞儀購自美國Beckman Coulter公司。
1.2 方法
1.2.1 細胞轉染及實驗分組:將EC109細胞接種于6孔板(1×104個/孔),按照Lipofectamine 3000說明書將si-NC、si-circ_0005273、miR-NC、miR-1200 mimics、si-circ_0005273與anti-miR-1200轉染至細胞,分別設為si-參照組、si-circ組、miR-參照組、miR-1200組、si-circ+anti組,轉染6 h后丟棄原有培養基,應用DMEM完全培養基培養48 h。另設對照組,該組EC109細胞按照正常條件培養。si-NC正向引物序列為UUCUCCGAACGUGUCACGUTT,反向引物序列為ACGUGACACGUUCGGAGAATT;si-circ_0005273序列為5′-GAAAGATTTCTGCCCAGCAGA-3′;miR-NC序列為5′-GGUUCGUACGUACACUGUUCA-3′;miR-1200序列為5′-CUCCUGAGCCAUUCUGAGCCUC-3′;anti-miR-1200序列為5′-GAGGCUCAGAAUGGCUCAGGAG-3′。
1.2.2 qRT-PCR檢測基因表達:分別取適量組織樣本和對數生長期的EC109細胞,均用Trizol試劑提取總RNA并進行純度檢測,取適量總RNA配置反轉錄反應溶液并反應合成cDNA。完成后將cDNA作為模板進行qRT-PCR反應,即95 ℃預變性2 min,95 ℃變性30 s,60 ℃退火30 s,72 ℃延伸30 s,共循環40次。使用LightCycler480型熒光定量PCR儀分析相關基因的相對表達量。circ_0005273正向引物序列為5′-AAGATTTCTGCCCAGCAGACC-3′,反向引物序列為5′-ACCAGGGTAGCCAGAAACCT-3′;STAT3正向引物序列為5′-TCTGTGTGACACCAACGACC-3′,反向引物序列為5′-TCCTCACATGGGGGAGGTAG-3′;GAPDH正向引物序列為5′-AGAAGGCTGGGGCTCATTTG-3′,反向引物序列為5′-AGGGGCCATCCACAGTCTTC-3′;miR-1200正向引物序列為5′-GTATGAGCTCCTGAGCCATTCTGA-3′,反向引物序列為5′-CTCAACTGGTGTCGTGGAG-3′;U6正向引物序列為5′-CTTCGGCAGCACATATACT-3′,反向引物序列為5′-AAAATATGGAACGCTTCACG-3′。以GAPDH和U6為內參基因,相對表達量采用2-△△Ct法計算。
1.2.3 MTT法檢測細胞增殖能力:將EC109細胞接種于96孔板,每孔加入20 μL MTT試劑反應4 h和150 μL二甲亞砜(DMSO)反應5 min。將檢測波長設為490 nm,使用酶標儀檢測各孔光密度(OD)值,計算細胞增殖抑制率。
1.2.4 平板克隆形成實驗檢測集落形成數:將EC109細胞接種于6孔板(每孔1×103個),培養2周(每3 d更換1次培養液),加入預冷磷酸鹽緩沖液(PBS)洗滌后,依次分別加入甲醇(500 μL)與1%結晶紫染色液(400 μL),采用蒸餾水洗滌后晾干拍照,觀察集落形成數。
1.2.5 流式細胞術檢測細胞凋亡率:將EC109細胞用PBS洗滌并離心,收集細胞沉淀并用緩沖液重懸。將細胞懸液與Annexin V-FITC和PI染液孵育,使用FACS Calibur流式細胞儀分析細胞凋亡率。
1.2.6 Transwell實驗檢測細胞遷移能力:將EC109細胞用無血清培養基重懸,然后接種至Transwell小室的上室,并向下室加入完全培養基。培養24 h后,將細胞用甲醇固定并用0.1%結晶紫染色液進行染色,30 min后使用流水洗滌并晾干,于顯微鏡下觀察細胞數量。
1.2.7 雙熒光素酶報告基因實驗檢測目的基因的靶向關系:Circular RNA Interactome、Targetscan預測結果顯示,circ_0005273與miR-1200之間、miR-1200與STAT3之間分別存在結合位點。由上海鈺博生物科技有限公司設計合成含有circ_0005273與miR-1200結合位點的野生型熒光素酶報告質粒(WT-circ_0005273)以及含有結合位點突變序列的突變型熒光素酶報告質粒(MUT-circ_0005273),含有miR-1200與STAT3結合位點的野生型熒光素酶報告質粒(WT-STAT3)以及含有結合位點突變序列的突變型熒光素酶報告質粒(MUT-STAT3)。將EC109細胞按照每孔1×104個接種于6孔板,采用脂質體轉染法將WT-circ_0005273、MUT-circ_0005273、WT-STAT3、MUT-STAT3分別與miR-1200 mimics、miR-NC共轉染至EC109細胞,轉染完成后將其放置于培養箱內,24 h后使用熒光素對細胞活性進行檢測。
1.2.8 蛋白質印跡法(Western blot)檢測蛋白表達量:采用RIPA裂解液提取總蛋白,然后用二喹啉甲酸(BCA)試劑盒進行定量。蛋白經十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)分離后轉移至聚偏氟乙烯(PVDF)膜。用5%脫脂奶粉封閉后,膜與STAT3一抗(1∶1 000)或內參GAPDH抗體(1∶2 000)孵育過夜,然后與二抗(1∶5 000)反應2 h。使用ECL化學發光液顯示蛋白條帶,并應用Gel-Pro32軟件進行灰度分析。
1.3 統計學分析
2 結 果
2.1 circ_0005273、miR-1200、STAT3在食管癌組織和癌旁組織中的表達
食管癌組織中circ_0005273表達量、STAT3蛋白表達量高于癌旁組織,miR-1200表達量低于癌旁組織,差異有統計學意義(P<0.05),見圖1。

2.2 干擾circ_0005273對EC109細胞增殖、凋亡、遷移的影響
si-circ組miR-1200表達量、細胞增殖抑制率、凋亡率均高于對照組、si-參照組,circ_0005273表達量、STAT3蛋白表達量、集落形成數和遷移細胞數均低于或少于對照組、si-參照組,差異有統計學意義(P<0.05),見圖2、表1。
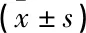
表1 干擾circ_0005273對miR-1200、STAT3表達和細胞增殖、遷移、凋亡的影響

2.3 過表達miR-1200對EC109細胞增殖、凋亡、遷移的影響
miR-1200組STAT3蛋白表達量、集落形成數、遷移細胞數均低于或少于對照組、miR-參照組,miR-1200表達量、細胞增殖抑制率、凋亡率均高于對照組、miR-參照組,差異有統計學意義(P<0.05),見圖3、表2。
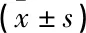
表2 過表達miR-1200對STAT3表達和EC109細胞增殖、遷移、凋亡的影響

2.4 circ_0005273與miR-1200的靶向關系分析
circular RNA Interactome預測結果顯示,circ_0005273與miR-1200存在結合位點,見圖4。miR-1200組WT-circ_0005273低于miR-參照組,差異有統計學意義(P<0.05),2組MUT-circ_0005273比較,差異無統計學意義(P>0.05),表明miR-1200過表達可降低WT-circ_0005273載體的熒光素酶活性,但對MUT-circ_0005273載體的熒光素酶活性無影響,見表3。
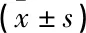
表3 circ_0005273與miR-1200靶向關系的雙熒光素酶報告基因實驗結果

2.5 miR-1200與STAT3的靶向關系分析
Targetscan預測結果顯示,miR-1200與STAT3存在結合位點,見圖5。miR-1200組WT-STAT3低于miR-參照組,差異有統計學意義(P<0.05),2組MUT-STAT3比較,差異無統計學意義(P>0.05),表明miR-1200過表達可降低WT-STAT3載體的熒光素酶活性,但對MUT-STAT3載體的熒光素酶活性無影響,見表4。

表4 miR-1200與STAT3靶向關系的雙熒光素酶報告基因實驗結果

2.6 抑制miR-1200對干擾circ_0005273后的EC109細胞增殖、凋亡、遷移的影響
si-circ組STAT3蛋白表達、集落形成數、遷移細胞數低于或少于對照組,細胞增殖抑制率、凋亡率高于對照組,差異有統計學意義(P<0.05);si-circ+anti組STAT3蛋白表達、集落形成數、遷移細胞數高于或多于si-circ組,細胞增殖抑制率、凋亡率低于si-circ組,差異有統計學意義(P<0.05),見圖6、表5。由此提示,抑制miR-1200可逆轉干擾circ_0005273對EC109細胞增殖、遷移的抑制作用及凋亡誘導作用。
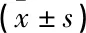
表5 抑制miR-1200對干擾circ_0005273后的EC109細胞增殖、遷移、凋亡的影響

3 討 論
circRNA主要存在于細胞質中,近年來多種新型circRNA如circ_0003340、circRNA PRKCI、circ_0006168、circ_0004370被證實在食管癌中異常表達,參與食管癌病理過程并發揮重要作用,或可作為食管癌的潛在治療靶點[8-11]。胰腺癌組織中的circ_0005273呈高表達,淋巴結轉移、遠處轉移及預后變化均與該指標表達異常升高有關,抑制circ_0005273表達可抑制胰腺癌細胞增殖與遷移[12]。circ_0005273在乳腺癌組織和細胞系中高表達,下調其表達可抑制乳腺癌細胞增殖與遷移,進而抑制乳腺癌進展[13]。乳頭狀甲狀腺癌組織和細胞系中circ_0005273表達上調,敲除circ_0005273可抑制細胞增殖、克隆形成、遷移和侵襲[14]。但食管癌中circ_0005273表達變化的具體機制及作用目前尚未闡明。本研究發現,食管癌組織中circ_0005273表達量高于癌旁組織,而干擾circ_0005273表達可升高食管癌細胞增殖抑制率和凋亡率,使集落形成數和遷移細胞數減少。
目前,circ_0005273靶向調控的微小RNA(miRNA)種類尚不明確。本研究發現,在干擾circ_0005273后,食管癌細胞中miR-1200呈高表達變化趨勢,進一步證實circ_0005273可靶向結合miR-1200。由此提示,circ_0005273在食管癌病理過程中有參與并通過靶向結合miR-1200發揮重要作用。相關研究[15-16]顯示,miR-1200在神經膠質瘤、胃癌組織中表達下調,上調其表達則可抑制細胞增殖及轉移。本研究結果顯示,miR-1200在食管癌組織中表達下調,過表達miR-1200可抑制食管癌細胞增殖、克隆和遷移,并誘導細胞凋亡,表明miR-1200在食管癌發生發展過程中具有抑癌基因作用。本研究還發現,上調食管癌細胞中miR-1200表達可抑制STAT3蛋白表達,而干擾circ_0005273表達也可抑制STAT3蛋白表達。食管癌組織中STAT3蛋白表達量顯著高于癌旁組織,進一步證實STAT3是miR-1200的靶基因,提示circ_0005273可通過靶向結合miR-1200而正向調控STAT3的表達。STAT3屬于信號轉導與轉錄活化因子(STATs)家族成員之一,可促進腫瘤細胞增殖、遷移、侵襲和抑制細胞凋亡,進而發揮癌基因作用[17-18]。研究[19]顯示,抑制STAT3表達可促進舌鱗癌細胞凋亡,抑制細胞增殖及移植瘤生長。本研究結果顯示,抑制miR-1200可以逆轉circ_0005273敲低對食管癌細胞生長、克隆形成和遷移的抑制作用,提示circ_0005273可靶向miR-1200/STAT3軸,進而促進食管癌的惡性進程。
綜上所述,食管癌組織中circ_0005273和STAT3呈高表達,miR-1200呈低表達,干擾circ_0005273表達可通過上調miR-1200表達和下調STAT3表達而發揮抑制食管癌細胞增殖、遷移的作用,并誘導細胞凋亡。circ_0005273在食管癌中發揮癌基因作用,或可作為食管癌的潛在治療靶點。

