波吉卵囊藻對凡納濱對蝦生長、抗氧化及腸道菌群的影響
陳紅麗,鄧承城,劉 陽,黃翔鵠,李 峰,張玉蕾,李長玲,張 寧
(廣東海洋大學水產學院,廣東 湛江 524088)
凡納濱對蝦(Litopenaeus νannamei)肉質鮮美、生長快速、適應性強、養殖效益高,已成為我國重要的養殖對象之一[1]。隨著對蝦高密度集約化養殖模式的廣泛應用,養殖環境惡化、對蝦抗病力下降及疾病感染等問題愈發突出,已嚴重影響對蝦養殖業的健康發展[2-3]。如何有效改善養殖環境,提高對蝦抗病力,實現綠色健康養殖,是對蝦養殖業亟待解決的問題。構建以良性微藻為優勢群落的綠色生態養殖模式是對蝦養殖行業健康發展的方向之一[4-5]。微藻是對蝦養殖生態系統中重要的組成部分,不僅直接影響對蝦養殖環境,而且與對蝦的生長、免疫和健康狀況關系密切。姚冬梅等[6]接種蛋白核小球藻(Chlorella pyrenoidosa)于凡納濱對蝦養殖池塘,發現水體亞硝態氮和氨氮含量顯著降低;Huang 等[7]在凡納濱對蝦養殖水體中分別添加眼點擬微球藻(Nannochloropsis oculata)和假微型海鏈藻(Thalassiosira pseudonana),發現兩者均可改善水質并顯著降低水體弧菌濃度,對蝦生長速率和終末體質量均顯著增加。Ge 等[8]使用小球藻(Chlorella νulgaris)、青島大扁藻(Platymonas helgolandica)和牟氏角毛藻(Chaetoceros mulleri)三種海洋餌料進行凡納濱對蝦無水交換養殖,發現微藻顯著改善了養殖水質、抑制了胃和腸道弧菌增殖,提高了對蝦的生長和免疫性能。
波吉卵囊藻(Oocystis borgei)是本團隊從對蝦高位池中分離并鑒定的一種有益綠藻,可用來構建良性微藻群落,有效吸收養殖水環境中的氨氮[9-11],抑制水體中弧菌的繁殖[12-13],增強對蝦抗病力,預防對蝦疾病暴發[14]。但目前對波吉卵囊藻提高對蝦免疫力的途徑和機制還缺乏系統認知。本研究將波吉卵囊藻定向引入凡納濱對蝦養殖水體,分析波吉卵囊藻對凡納濱對蝦早期生長、免疫及腸道菌群的影響,為卵囊藻在對蝦生態健康養殖中的應用提供理論基礎。
1 材料與方法
1.1 材料
波吉卵囊藻取自廣東海洋大學藻類資源開發與養殖環境生態修復實驗室,凡納濱對蝦幼蝦由湛江恒興水產科技有限公司提供,餌料為商品化幼蝦1 號餌料。實驗用水為天然海水,水體經砂濾后用50 mg/L 漂白粉(有效氯質量分數≥20%)消毒12 h,以10 mg/L 硫代硫酸鈉曝氣24 h 中和后使用。實驗用試劑均為分析純。
1.2 方法
1.2.1 微藻培養 一級培養:實驗室內,將波吉卵囊藻接種至含5 L 湛水107-13 培養基的三角燒瓶中,培養溫度(25 ± 1)℃,鹽度30 ± 2,自然光照輔以日光燈(70 W)24 h 照明,照度為(1 650±950)lx,充氣培養2周后進行沉淀濃縮收集。
二級培養:室外500 L PⅤC 水塔中加滿消毒海水,添加50 mg/L尿素和5 mg/L磷酸二氫鉀,接種濃縮后的一級培養藻液,于自然溫度(15~34 ℃)、照度(0.1×104~4.5×104lx)和光晝夜周期循環下充氣培養7~10 d。
1.2.2 對蝦養殖管理 養殖實驗于2022 年5 月在廣東海洋大學海洋生物研究基地進行。以接種波吉卵囊藻的對蝦養殖為實驗組(EC組),未接種的為對照組(CC 組),每組設定3 個養殖重復。選取初始體長(2.68±0.29)cm,初始體質量(0.35±0.02)g的健康凡納濱對蝦,隨機分配到含800 L波吉卵囊藻水(接種密度為3.6×104L-1,添加50 mg/L尿素和5 mg/L磷酸二氫鉀作為營養鹽)或消毒海水的1 000 L 養殖桶中,200 尾/桶。養殖周期為20 d,期間水溫25~30 ℃,pH 8.4± 0.3,持續充氧并保持溶氧在6 mg/L以上,每日6:30、12:00、18:00 定量投喂,初始日投喂量為對蝦初始體質量的5%,后根據每日攝食情況隨時調整日糧配比。每2 d 從底部吸去10%的養殖水體并補充消毒海水,EC組僅在10 d吸底后補充等量波吉卵囊藻藻液(密度3.6×104L-1),養殖期間不再補充營養鹽。
1.3 指標測定
1.3.1 樣品采集 養殖19 d 后,于各養殖桶中隨機取30 尾凡納濱對蝦,停飼24 h,稱量體質量,對蝦體表用無菌水清洗、用體積分數75%乙醇消毒,無菌解剖其鰓、肝胰腺和腸道組織,并稱量肝胰腺質量,取樣組織按組別混合后置于無菌凍存管中,液氮速凍后于-80 ℃超低溫冰箱中保存。
1.3.2 對蝦生長指標測定 計算對蝦增重率(Weight gain rate,WGR,%)、特定生長率(Specific growth rate,SGR,%/d)及肝體比(Hepatopancreas somatic indices,HSI,%)等生長指標:
式中,mm、mc和mh分別表示凡納濱對蝦實驗終末體質量、實驗初始體質量和肝胰腺質量(g);t代表實驗時間(d)。
1.3.3 對蝦免疫組織的非特異性免疫指標測定 委托南京建成生物工程研究所測定鰓和肝胰腺組織中的免疫酶活性,其中,超氧化物歧化酶(SOD)活性,比色法測定;谷胱甘肽(GSH)活性,DTNB 微板法測定;酸性磷酸酶(ACP)、堿性磷酸酶(AKP)活性,微量酶標法測定;總抗氧化能力(T-AOC),FRAP微板法測定。
1.3.4 對蝦腸道微生物的測定和多樣性分析 采用HiPure Stool DNA Mini Kit B(廣州美基生物科技有限公司)提取對蝦腸道組織微生物基因組DNA,使用含barcode的特異引物(341F:CCTACGGGNGGCWGCAG;806R: GGACTACHⅤGGGTATCTAAT)擴增其16S rDNA 的Ⅴ3-Ⅴ4 區,將純化后的擴增產物連接測序接頭,構建測序文庫后使用Illumina PE250進行高通量測序。對蝦腸道微生物組成的測定交由廣州基迪奧生物科技有限公司進行。
用軟件DADA2[15]對測序原始數據(raw reads)進行過濾和質控,獲得高質量干凈數據(clean reads),將干凈數據拼接并去除嵌合體后,獲得有效標簽(Effective tags),用軟件Uparse[16]對所有樣品的有效標簽以100%的相似性聚類為操作分類單元(Operational Taxonomic Units,OTUs),選取每 個OTU 中豐度最高的序列作為代表序列,利用RDP Classifier 樸素貝葉斯算法[17]與16S 數據庫對其進行物種注釋,分析微生物結構,置信度設為80%。
1.4 數據分析
采用統計軟件SPSS 20.0 分析生長和免疫酶活性數據,經比較平均值和獨立樣本t檢驗,分析EC組和CC 組數據的差異顯著性,數據以平均值± 標準差表示,有統計學意義的差異用星號表示(*,P<0.05;**,P<0.01)。
2 結果與分析
2.1 定培波吉卵囊藻對凡納濱對蝦生長性能的影響
與CC 組相比,波吉卵囊藻調控養殖凡納濱對蝦20 d 后對其增重率和特定生長率無顯著影響(P>0.05),但極顯著提高對蝦的肝體比(P<0.01)(表1)。
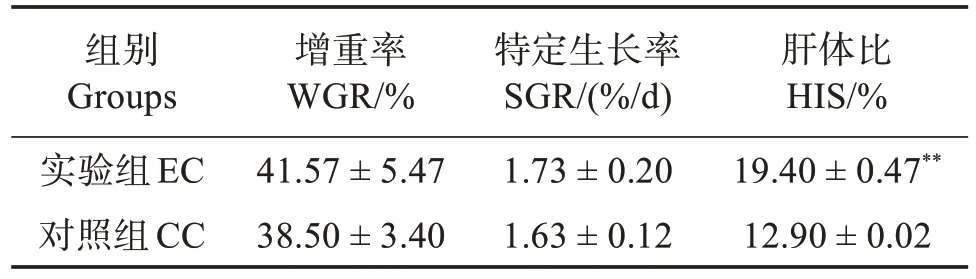
表1 定培波吉卵囊藻對凡納濱對蝦生長性能的影響Table 1 Effects of directional culture of Oocystis borgei on growth performance of Litopenaeus vannamei
2.2 定培波吉卵囊藻對凡納濱對蝦非特異性免疫的影響
相較于CC 組,EC 組中對蝦肝胰腺的SOD 和T-AOC 活性極顯著提高(P<0.01),GSH、ACP 和AKP活性均無顯著差異(P>0.05);同時,EC組對蝦鰓中的SOD 和T-AOC 活性均極顯著提高(P<0.01),GSH 和ACP 活性顯著提高(P<0.05),而AKP 活性無顯著差異(P>0.05)(表2),表明波吉卵囊藻調控養殖顯著提高了凡納濱對蝦肝胰腺和鰓的非特異性免疫能力。
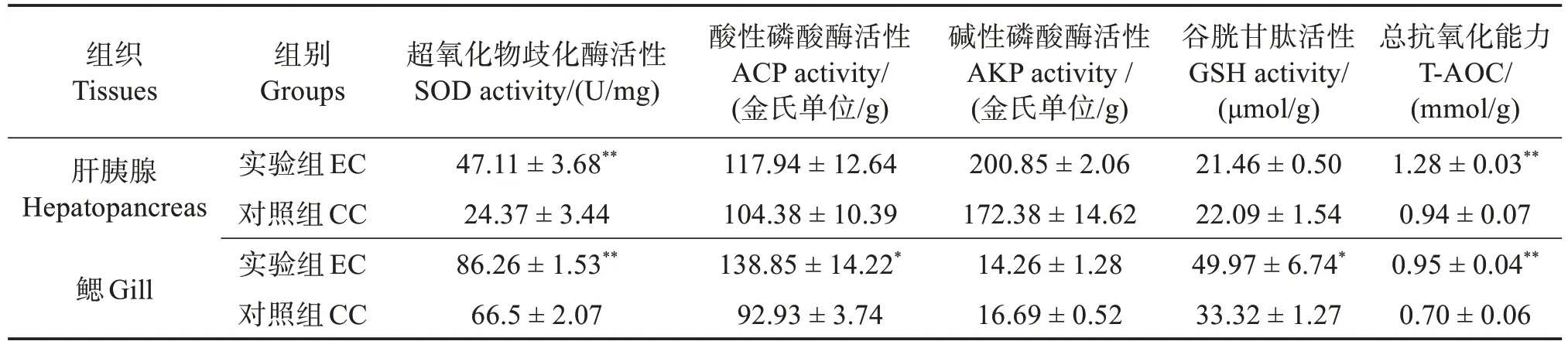
表2 定培波吉卵囊藻對凡納濱對蝦肝胰腺和鰓非特異性免疫的影響Table 2 Effects of directional culture of Oocystis borgei on nonspecific immunity of hepatopancreas and gill of Litopenaeus vannamei
2.3 定培波吉卵囊藻對凡納濱對蝦腸道菌群的影響
2.3.1 測序樣本序列信息 將6 個樣本測序后的776 538 條原始數據拼接、質控后獲得754 123 條純凈數據,純凈數據拼接去除嵌合體后獲得569 643條有效標簽,其N50和N90均為430 bp,聚類有效標簽最終得到18 347 個OTU 用于比較兩組樣品間微生物群落結構,其中,EC 組的OTU 數量均高于CC組(表3)。
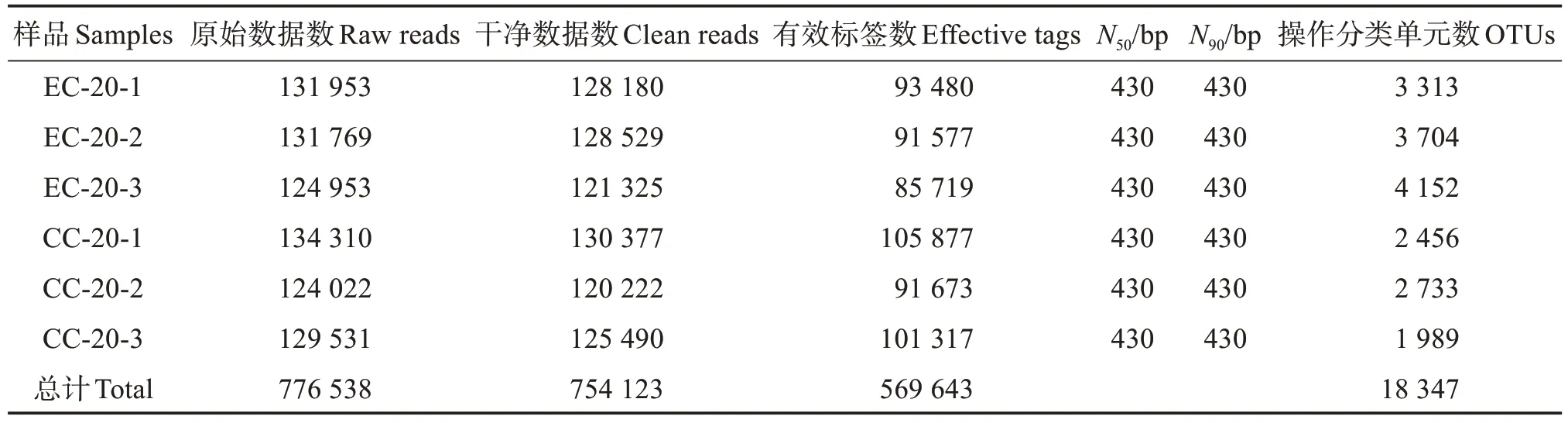
表3 凡納濱對蝦腸道微生物測序數據量及質量Table 3 Data quantity and sequencing quality of intestinal sequences of Litopenaeus vannamei
2.3.2 對蝦腸道微生物物種注釋與分布 對OTUs一致序列的物種注釋表明,OTUs主要隸屬26門,58綱,140 目,203 科和349 屬,還有一些OTUs 未鑒定出分類地位,屬于unclassified序列。
在門水平上,EC 組和CC 組凡納濱對蝦腸道菌群主要是由變形菌門(Proteobacteria)、浮霉菌門(Planctomycetota)、擬桿菌門(Bacteroidota)、梭桿菌門(Fusobacteria)和放線菌門(Actinobacteriota)等組成(圖1),在EC 組中分別占62.07%、10.75%、7.34%、3.90%和3.41%,在CC 組中分別占71.94%、7.84%、10.40%、1.18%和1.64%(表4),表明定向引入波吉卵囊藻,對蝦腸道菌群中變形菌門比例顯著降低(P<0.05),擬桿菌門含量有所下降,而梭桿菌門和放線菌門含量有所提高,但差異不顯著(表4)。

圖1 凡納濱對蝦腸道微生物在門、科、屬分類水平上的物種豐度Fig.1 Community abundance of intestinal microflora of Litopenaeus νannamei at phylum,family and genus classification level

表4 各組物種注釋中前10個優勢菌門的相對豐度Table 4 Community abundance of the top 10 dominant bacteriophyta in each group
在科水平上,除無法鑒別的種類外,凡納濱對蝦腸道優勢菌主要由弧菌科(Ⅴibrionaceae)、紅桿菌科(Rhodobacteraceae)及黃桿菌科(Flavobacteriaceae)組成(圖1)。與CC 組相比,EC 組中弧菌科豐度有降低趨勢,但差異不顯著(P=0.074 6),而紅桿菌科豐度有升高趨勢,但差異不顯著(P=0.176 9)。
在屬水平,EC 組和CC 組共有物種174 個,EC組特有物種75 個,CC 組特有物種91 個,兩組中弧菌屬(Vibrio)、發光桿菌屬(Photobacterium)和魯杰氏菌屬(Ruegeria)均為優勢菌屬(圖1),然而定向引入波吉卵囊藻后,EC 組弧菌屬相對豐度與CC 組相比明顯下降(P=0.058 6)。
2.3.3 對蝦腸道微生物的α多樣性α多樣性可反映樣本物種的多樣性和豐度情況,Shannon 和Simpson指數常用來度量樣品菌群多樣性,而用Chao 1 指數來度量樣品菌群豐度。由表5 可見,EC 組對蝦樣本腸道菌群的Shannon 和Chao 1 指數顯著低于CC 組(P<0.05),而Simpson 指數無顯著差異(P>0.05),表明在凡納濱對蝦養殖水體中定向培養波吉卵囊藻,降低了對蝦腸道微生物的多樣性和豐度。此外,所有樣本的Good’s覆蓋率均為100%,表明測序數據充足可靠,不存在沒有多樣性分析的序列。

表5 凡納濱對蝦腸道微生物α多樣性指數Table 5 Alpha diversity index of intestinal microbial community of Litopenaeus vannamei
2.3.4 對蝦腸道微生物的β多樣性分析 屬水平物種PCoA 主成分分析結果(圖2(A))顯示,EC 組樣本聚在在左側,而CC 組樣本聚集在右側,構成兩個獨立的組群,表明兩組物種組成有明顯差異。基于Weighted Unifrac 距離算法的屬水平物種UPGMA聚類分析(圖2(B))顯示,EC 組樣本和CC 組樣本單獨聚類,與PCoA主成分分析結果一致。
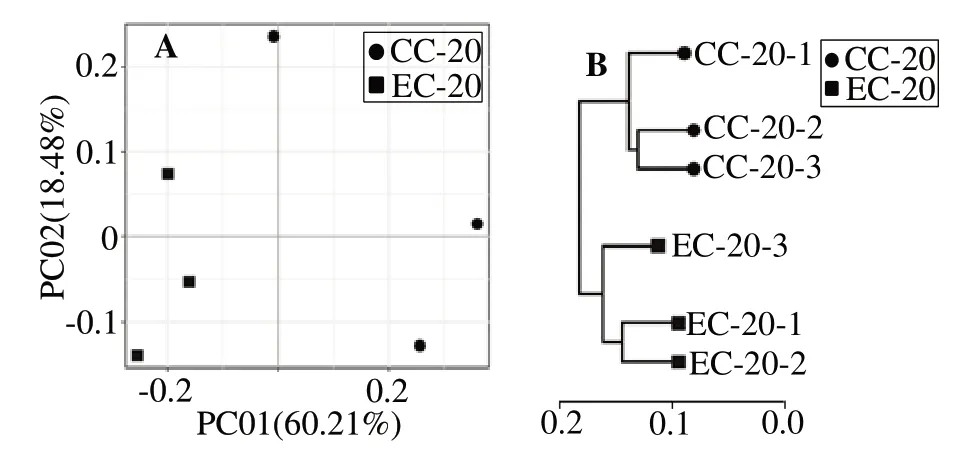
圖2 凡納濱對蝦腸道微生物屬水平的PCoA分析和UPGMA聚類樹Fig.2 PCoA analysis and UPGMA clustering tree of intestinal microbes of Litopenaeus νannamei at genus level
3 討論
3.1 定培波吉卵囊藻對凡納濱對蝦生長性能的影響
養殖水體中定向引入波吉卵囊藻對凡納濱對蝦早期的增重率和特定生長率無顯著影響,但對對蝦肝體比體有一定促進效應。肝體比是動物健康程度的重要評價指標,一定程度上可反映肝胰腺功能強弱與受損程度。在對蝦養殖中,肝胰腺明顯萎縮是對蝦不健康的表征之一,嚴重時可能會造成對蝦死亡[18]。周琳玉等[19]發現,凡納濱對蝦的肝體比、肝胰腺E 細胞、B 細胞和R 細胞數量的提高,使得對蝦肝胰腺再生能力增強,同時也能降低肝胰腺組織的氧化損傷,增強其免疫力,有利于對蝦生長。本研究中,定培波吉卵囊藻使凡納濱對蝦肝體比極顯著提高,表明對蝦肝胰腺免疫功能增強。此外,肝胰腺為甲殼動物儲存營養物質的重要器官,肝體比也是其能量儲備的指標之一。克氏原螯蝦(Procambarus clarkii)肝體比增加可能由成熟過程中脂質在肝胰腺中大量積累所造成[20]。綜上,本研究定向引入波吉卵囊藻后凡納濱對蝦生長早期肝體比顯著提高,說明卵囊藻可能增強了凡納濱對蝦肝胰腺的抗氧化能力和脂肪供能等生理過程。
3.2 定培波吉卵囊藻對凡納濱對蝦抗氧化能力的影響
活性氧(Reactive oxygen species,ROS,如O2-與H2O2等)是動物免疫系統中的細胞毒性成分,是在機體受到逆境脅迫及抗應激時產生的重要物質[21]。SOD 是動物體內重要的抗氧化酶之一,可及時清除機體產生的ROS,使機體細胞免受損傷[22],是評價實驗動物免疫水平的重要指標[23-25]。T-AOC 是評價細胞或機體內各種抗氧化酶和抗氧化物質等生物活性物質總抗氧化水平的綜合指標。GSH 作為機體抗氧化系統的重要組成部分,也是重要的抗氧化劑和自由基清除劑,可與谷胱甘肽系統中的其他三種酶(谷胱甘肽過氧化物酶GSH-Px、谷胱甘肽巰基轉移酶GST 和谷胱甘肽還原酶GSR)形成抗自由基防線[26]。此外,抗氧化能力的增強也有利于提高水生生物的解毒能力[27-28]。本研究中,EC 組凡納濱對蝦肝胰腺和鰓中SOD 和T-AOC 活性以及鰓中GSH活性顯著增加,表明定向引入波吉卵囊藻可增加凡納濱對蝦早期的免疫能力,提高對蝦肝胰腺和鰓的排毒能力。微藻提高水產動物免疫力主要有兩種方式,一是微藻富含多種生物活性物質,可作為餌料或飼料添加劑為養殖動物提供營養、能量和提高抗氧化力、增強免疫力等[29-30],二是將微藻引入養殖系統,改善養殖水體環境,增強養殖動物的抗病力、免疫力,如養殖水體接種蛋白核小球藻(Chlorella pyrenoidosa)可提高凡納濱對蝦肝胰腺的SOD 和GSH 活性[31];將不同濃度的產毒顫藻(Oscillatoriasp.)投加到凡納濱對蝦養殖水體中,低濃度顫藻引起機體免疫力增益,組織的過氧化物酶(POD)、SOD、PO、GST 和抗菌活性均增加[32],波吉卵囊藻和微綠球藻定向引入凡納濱對蝦成蝦養殖水體可顯著提高對蝦血清SOD和酚氧化酶(PO)活性[14],本研究將波吉卵囊藻引入凡納濱對蝦幼體養殖水體也得到了類似結論。
3.3 定培波吉卵囊藻對凡納濱對蝦腸道菌群的影響
對蝦腸道健康與腸道菌群的組成和結構密切相關,腸道菌群易受養殖水環境影響,其中,水體微生物(包括細菌、病毒、真菌以及一些小型的原生生物、微藻等)[33]是對蝦腸道菌群最關鍵的環境影響因子,尤其對早期腸道菌群的結構與組成有決定性作用[34],還會對宿主的健康有直接影響,如在健康狀態下,養殖水體中的細菌群落和對蝦腸道菌群間無顯著差異,但在患病情況下,二者存在顯著差異[35]。本研究多樣性分析表明,凡納濱對蝦養殖水體中定向引入波吉卵囊藻降低了對蝦腸道微生物的多樣性和豐度,在門水平上,EC 組和CC 組對蝦腸道菌群種類基本一致,均主要由變形菌門、擬桿菌門、放線菌門等組成,這與前人研究[36]一致;然而各菌群組成比例有明顯差異,EC組對蝦腸道菌群中變形菌門和擬桿菌門豐度降低,放線菌門豐度增加。研究表明,變形菌門豐度提高可能會對蝦類產生潛在風險[37-38],而患病的凡納濱對蝦腸道中的擬桿菌門豐度會顯著提高[39];此外,吳金鳳等[40]研究發現,健康對蝦腸道中放線菌門的相對豐度顯著高于發病對蝦腸道,與本研究結果一致。由此推斷,波吉卵囊藻是通過改變腸道菌群中核心門類的豐度,從而增強對蝦腸道菌群的穩態,改善對蝦腸道健康。
弧菌是對蝦養殖中常見的致病菌,也是對蝦罹患某些疾病狀態下(如患急性肝胰腺壞死綜合征)腸道內的絕對優勢菌群,嚴重影響其生存和健康[41]。Ge等[8]將小球藻(C.νulgaris)、青島大扁藻(P.helgolandica)和牟氏角毛藻(C.mulleri)引入凡納濱對蝦養殖系統,發現3 種微藻顯著抑制了對蝦腸道中的弧菌數量,其中青島大扁藻更能有效抑制腸道弧菌生長,并推測弧菌數量減少可能是由于養殖水體中存在微藻而有效控制了水質。此外,有些微藻可產生抑制細菌生長的抗生素[42],有些微生物絮凝物還可通過競爭性排斥來抑制弧菌的生長、調節機體免疫或提供營養來源[43]。本研究中EC 組對蝦腸道菌群中隸屬于變形菌門的弧菌科和弧菌屬含量均明顯降低,表明定向引入波吉卵囊藻可有效降低對蝦腸道某些主要門類中有害菌群的豐度,改善對蝦腸道健康,這也與擬桿菌門和黃桿菌科的豐度變化相呼應。黃桿菌科隸屬于擬桿菌門,是一種條件致病菌,在凡納濱對蝦養殖密度過高時對蝦腸道中黃桿菌科豐度也升高,可能對對蝦機體造成不利影響[44]。相比之下,定向引入波吉卵囊藻后對蝦腸道中的有益菌豐度有所增加,如紅桿菌科。紅桿菌科是一種重要的海洋細菌譜系,可產生廣譜性抗菌物質TDA(Tropodithietic acid),破壞目標微生物的質子動力或作為信號分子影響細菌基因表達[45],某些產TDA的菌群可對抗致病性弧菌的侵害,保護輪蟲等海洋餌料生物,可作為有益菌開發[46-47],這也可能是本研究中弧菌豐度降低的原因。綜上,波吉卵囊藻對凡納濱對蝦腸道菌群的影響表現為降低有害細菌豐度,而提高有益菌豐度,而其抑制腸道有害菌是由于波吉卵囊藻產生抑制生長的抗菌物質的抑制作用,或者僅由接種波吉卵囊藻改善了養殖水質導致,這需要進一步研究。
4 結論
定向引入波吉卵囊藻可極顯著提高凡納濱對蝦早期的肝體比,增強其抗氧化能力,影響腸道菌群中核心門類的組成,增加有益菌的豐度,減少有害弧菌的含量,進一步提高對蝦腸道菌群的穩定性,從而有助于完善其腸道免疫系統和提高抗病力。

