新型數(shù)字化實(shí)驗(yàn)系統(tǒng)在反應(yīng)熱測(cè)定中的應(yīng)用研究①
廖治華, 杜欽芝, 楊國(guó)敏, 張明曉, 陳時(shí)洪
1. 重慶市第一中學(xué)校,重慶 400030;2. 重慶市第八中學(xué)校,重慶 400030;3. 西南大學(xué) 化學(xué)化工學(xué)院,重慶 400715
化學(xué)反應(yīng)中的能量變化是中學(xué)化學(xué)教學(xué)的重點(diǎn)和難點(diǎn). 人教版高中化學(xué)必修第二冊(cè)第六章“化學(xué)反應(yīng)與能量”從鎂條與鹽酸的放熱反應(yīng)和八水合氫氧化鋇晶體與氯化銨晶體的吸熱反應(yīng)這兩個(gè)演示實(shí)驗(yàn)入手, 通過(guò)粗略的溫度變化和結(jié)冰現(xiàn)象讓學(xué)生定性地認(rèn)識(shí)化學(xué)反應(yīng)中伴隨著的能量變化. 選擇性必修I設(shè)計(jì)了鹽酸與氫氧化鈉溶液反應(yīng)的中和熱測(cè)定實(shí)驗(yàn), 其采用傳統(tǒng)的實(shí)驗(yàn)方法, 用簡(jiǎn)易量熱計(jì)作為反應(yīng)裝置測(cè)定溫度變化, 從而定量計(jì)算出中和熱, 使焓變(或反應(yīng)熱)的教學(xué)重點(diǎn)落腳于定量分析及計(jì)算的層面. 中和熱測(cè)定實(shí)驗(yàn)是高中化學(xué)教學(xué)的重要實(shí)驗(yàn), 也是為數(shù)不多的定量實(shí)驗(yàn)之一, 但因?yàn)楹?jiǎn)易量熱計(jì)的熱散失較多而導(dǎo)致測(cè)定準(zhǔn)確度差. 教材中針對(duì)反應(yīng)熱設(shè)計(jì)的所有實(shí)驗(yàn)都只有三重表征(宏觀、 微觀、 符號(hào))效果, 如果能夠借助連續(xù)、 實(shí)時(shí)、 動(dòng)態(tài)的溫度變化曲線, 則可以幫助學(xué)生更好地理解化學(xué)反應(yīng)伴隨著能量變化這一基本特征, 從而實(shí)現(xiàn)教學(xué)的四重表征(宏觀、 微觀、 符號(hào)、 曲線)效果.
數(shù)字化實(shí)驗(yàn)是教育信息化發(fā)展的必然趨勢(shì)[1], 其借助實(shí)時(shí)直觀的動(dòng)態(tài)變化曲線可實(shí)現(xiàn)四重表征效果, 強(qiáng)化教學(xué)重點(diǎn), 突破教學(xué)難點(diǎn), 提高化學(xué)實(shí)驗(yàn)水平, 已被廣泛用于滴定分析、 反應(yīng)速率、 化學(xué)平衡移動(dòng)等教學(xué)實(shí)踐探究[2-11]. 多類型的化學(xué)反應(yīng)對(duì)應(yīng)著多類型的反應(yīng)熱. 中和熱的數(shù)字化實(shí)驗(yàn)測(cè)定是數(shù)字化實(shí)驗(yàn)在中學(xué)化學(xué)教學(xué)實(shí)踐中的典型應(yīng)用, 其研究相對(duì)較多和較早. 利用手持技術(shù)或傳感器技術(shù)可以方便獲得實(shí)時(shí)直觀的溫度變化曲線, 以提高中和熱測(cè)定的直觀性和準(zhǔn)確度[12-13], 其他反應(yīng)熱如解離熱或燃燒熱的數(shù)字化實(shí)驗(yàn)測(cè)定也有報(bào)道[14]. 鹽酸與碳酸氫鈉的復(fù)分解反應(yīng)是中學(xué)化學(xué)教學(xué)中涉及的為數(shù)不多的吸熱反應(yīng)之一, 其熱效應(yīng)小, 反應(yīng)前后溫度變化較小, 傳統(tǒng)的實(shí)驗(yàn)設(shè)計(jì)難以獲得理想的結(jié)果. 其數(shù)字化實(shí)驗(yàn)設(shè)計(jì)雖有報(bào)道[15], 但其側(cè)重點(diǎn)是考察碳酸鈉和碳酸氫鈉分別與鹽酸反應(yīng)的熱效應(yīng)的差異, 僅粗略地通過(guò)溫度升高或降低的情況理解前者是放熱反應(yīng)后者是吸熱反應(yīng), 并未對(duì)反應(yīng)熱進(jìn)行定量測(cè)定和計(jì)算. 置換反應(yīng)屬典型的氧化還原反應(yīng), 也是中學(xué)教學(xué)的重點(diǎn), 其反應(yīng)熱測(cè)定與中和熱測(cè)定同等重要. 到目前為止, 未見(jiàn)關(guān)于置換反應(yīng)熱測(cè)定的數(shù)字化實(shí)驗(yàn)設(shè)計(jì)的研究報(bào)道, 也未見(jiàn)利用某一裝置探究系列典型反應(yīng)包括中和反應(yīng)、 置換反應(yīng)和復(fù)分解反應(yīng)體系的反應(yīng)熱測(cè)定的數(shù)字化實(shí)驗(yàn)報(bào)道.
基于中學(xué)化學(xué)反應(yīng)熱及其測(cè)定的教學(xué)實(shí)際和目前反應(yīng)熱測(cè)定的數(shù)字化實(shí)驗(yàn)研究現(xiàn)狀, 針對(duì)系列典型的化學(xué)反應(yīng)(中和反應(yīng)、 置換反應(yīng)和復(fù)分解反應(yīng))體系進(jìn)行反應(yīng)熱測(cè)定的數(shù)字化實(shí)驗(yàn)設(shè)計(jì)是很有價(jià)值的. 它可系統(tǒng)全面呈現(xiàn)不同反應(yīng)類型、 不同反應(yīng)熱效應(yīng)、 不同物態(tài)參與的反應(yīng)體系的反應(yīng)熱變化情況, 可作為中學(xué)化學(xué)反應(yīng)熱定量實(shí)驗(yàn)教學(xué)的重要參考, 也可彌補(bǔ)目前置換反應(yīng)熱數(shù)字化實(shí)驗(yàn)設(shè)計(jì)的空白. 本研究針對(duì)鎂與鹽酸置換反應(yīng)體系, 利用蓋斯定律計(jì)算了其反應(yīng)熱的理論值, 以衡量實(shí)驗(yàn)測(cè)定誤差, 這對(duì)學(xué)生理解和掌握蓋斯定律在反應(yīng)熱計(jì)算中的應(yīng)用這一教學(xué)重點(diǎn)和難點(diǎn)具有積極作用.
1 實(shí)驗(yàn)設(shè)計(jì)與原理
1.1 實(shí)驗(yàn)方案的設(shè)計(jì)
以鹽酸與氫氧化鈉溶液中和反應(yīng)、 鎂條與鹽酸置換反應(yīng)、 鋅粉與硫酸銅溶液置換反應(yīng)、 碳酸氫鈉與鹽酸復(fù)分解反應(yīng)等四類典型反應(yīng)體系為研究對(duì)象, 利用本課題組自制的MXLab21先進(jìn)數(shù)字化化學(xué)實(shí)驗(yàn)系統(tǒng), 以簡(jiǎn)易保溫裝置為反應(yīng)容器, 在無(wú)需對(duì)反應(yīng)器、 溫度傳感器和攪拌子的吸熱進(jìn)行處理或校正的情況下, 借助系統(tǒng)軟件自動(dòng)進(jìn)行雷諾溫度校正以消除反應(yīng)系統(tǒng)的熱散失, 準(zhǔn)確給出反應(yīng)的溫升或溫降, 顯著提高各類化學(xué)反應(yīng)熱測(cè)定的準(zhǔn)確性、 實(shí)時(shí)性、 操控性和可視性.
1.2 實(shí)驗(yàn)原理
化學(xué)反應(yīng)在等壓條件下進(jìn)行時(shí), 其反應(yīng)的熱效應(yīng)稱為等壓反應(yīng)熱, 用反應(yīng)體系焓(H)的變化ΔH來(lái)表示. 所考察四類體系的化學(xué)反應(yīng)方程式通式表達(dá)為:
aA+bB=dD+eE
反應(yīng)體系的反應(yīng)熱(ΔHm)分別稱為中和反應(yīng)熱、 置換反應(yīng)熱和復(fù)分解反應(yīng)熱. 在不考慮反應(yīng)器、 溫度傳感器和攪拌子吸熱的情況下, 可由如下公式計(jì)算求得:
(1)
式中: ΔHm為反應(yīng)熱(或摩爾焓變)(kJ/mol);Cp為反應(yīng)溶液的定壓比熱容(近似用水的比熱容4.18 J/(g/K)代替); ΔT為溫升或溫降(反應(yīng)前后溶液的溫度變化值)(K);m為反應(yīng)體系總質(zhì)量(g);n為完全反應(yīng)那種反應(yīng)物的物質(zhì)的量(mol).
能量守恒定律指出, 化學(xué)反應(yīng)放出的熱量等于其周圍環(huán)境吸收的熱量. 反應(yīng)體系與外界環(huán)境之間的熱交換會(huì)導(dǎo)致實(shí)驗(yàn)誤差, 反應(yīng)體系的熱散失可以通過(guò)雷諾溫度校正得以補(bǔ)償. 以放熱反應(yīng)為例, 其雷諾溫度校正原理如圖1所示. 圖中所示曲線為反應(yīng)溫度T隨反應(yīng)時(shí)間t變化的關(guān)系曲線. 保持一定的攪拌速度不變, 待反應(yīng)溶液(如鹽酸或硫酸銅溶液)溫度基本平穩(wěn)后, 加入另一反應(yīng)物(如氫氧化鈉溶液、 鎂條、 鋅粉或碳酸氫鈉), 反應(yīng)開始(C點(diǎn)), 溶液溫度迅速上升, 達(dá)到最高值(A點(diǎn), 即觀察到的最高溫度). 之后, 由于反應(yīng)體系與周圍環(huán)境的熱交換, 溶液溫度會(huì)緩緩下降, 對(duì)降溫曲線進(jìn)行線性擬合, 得到切線(BA), 延長(zhǎng)切線BA與反應(yīng)起始時(shí)刻C點(diǎn)所做的橫坐標(biāo)的垂線CC′相交于C′點(diǎn),C′C間的溫度差即為經(jīng)過(guò)雷諾溫度校正的溫升(ΔT).CA′間的差值為反應(yīng)達(dá)到最高溫度所需要的時(shí)間, 視為反應(yīng)時(shí)間(t).

圖1 雷諾溫度校正圖
本實(shí)驗(yàn)通過(guò)數(shù)字化實(shí)驗(yàn)系統(tǒng)軟件自動(dòng)進(jìn)行雷諾溫度校正, 以準(zhǔn)確測(cè)得反應(yīng)的溫升或溫降(ΔT), 再利用上述公式(1)計(jì)算出反應(yīng)熱(ΔHm).
2 實(shí)驗(yàn)材料與方法
2.1 實(shí)驗(yàn)儀器
MXLab21先進(jìn)化學(xué)實(shí)驗(yàn)系統(tǒng)如圖2所示, 其為本研究組研制的一種新型綜合性數(shù)字化實(shí)驗(yàn)儀器.

①傳感器支架; ②數(shù)據(jù)采集器; ③輸液泵; ④反應(yīng)容器; ⑤溫度傳感器; ⑥隔熱板; ⑦計(jì)算機(jī); ⑧USB線圖2 MXLab21先進(jìn)化學(xué)實(shí)驗(yàn)系統(tǒng)
其他實(shí)驗(yàn)儀器: 保溫裝置(150 mL的保溫杯, 用泡沫隔熱板代替保溫杯蓋子); 移液管(20 mL, 25 mL和50 mL); 容量瓶(250 mL, 500 mL和1 000 mL); 量筒(50 mL和200 mL); 攪拌子; 燒杯(50 mL); 試劑瓶(500 mL和1 000 mL); 電子天平(0.01 g); 分析天平(0.1 mg).
2.2 實(shí)驗(yàn)試劑
濃鹽酸(HCl的質(zhì)量分?jǐn)?shù)約為37%); 氫氧化鈉(分析純); 無(wú)水碳酸鈉(基準(zhǔn)物質(zhì), 于270~300 ℃干燥至恒重); 甲基橙指示劑; 鎂條(用砂紙打磨光亮); 五水硫酸銅(分析純); 鋅粉; 碳酸氫鈉(分析純); 去離子水.
1) 1.00 mol/L鹽酸溶液的配制: 用量筒量取41.8 mL濃鹽酸, 用去離子水稀釋至500 mL, 轉(zhuǎn)移到試劑瓶中保存?zhèn)溆茫?用分析天平準(zhǔn)確稱取無(wú)水Na2CO3基準(zhǔn)試劑2.0 g左右于250 mL錐形瓶, 用去離子水溶解后, 加入甲基橙指示劑2滴, 用待標(biāo)定的鹽酸滴定至終點(diǎn), 記錄消耗鹽酸的體積. 平行測(cè)定3次, 計(jì)算出所配制鹽酸的準(zhǔn)確濃度.
2) 1.10 mol/L 氫氧化鈉溶液的配制: 用電子天平稱取氫氧化鈉試劑22.00 g, 用500 mL去離子水溶解并轉(zhuǎn)移至試劑瓶中保存?zhèn)溆茫?/p>
3) 2.00 mol/L鹽酸溶液的配制: 用量筒量取167.0 mL 濃鹽酸, 加去離子水稀釋至1 000 mL, 轉(zhuǎn)移到試劑瓶中保存?zhèn)溆茫?/p>
4) 硫酸銅溶液(0.200 0 mol/L)的配制: 用分析天平準(zhǔn)確稱取五水硫酸銅(w≥99.0%)49.938 0 g, 用去離子水溶解并定容為1 000 mL, 轉(zhuǎn)移至試劑瓶中保存?zhèn)溆茫?/p>
2.3 實(shí)驗(yàn)方法
為統(tǒng)一描述操作步驟, 將四類反應(yīng)的反應(yīng)物均分為A和B, 具體情況見(jiàn)表1.

表1 各反應(yīng)體系的反應(yīng)物A和B
四類反應(yīng)的實(shí)驗(yàn)操作步驟如下:
1) 用移液管或MXLab21的輸液泵準(zhǔn)確移取反應(yīng)物A于150 mL保溫杯中.
2) 將保溫杯置于數(shù)據(jù)采集器中央, 為操作方便, 在其上面蓋一薄的泡沫隔熱層代替保溫杯蓋子以防止熱散失, 并在保溫杯中放入磁力攪拌子, 插入溫度傳感器.
3) 按圖2所示連接好儀器裝置, 將溫度傳感器連接到數(shù)據(jù)采集器的相應(yīng)接口, 并將數(shù)據(jù)采集器與計(jì)算機(jī)連接, 然后打開ACE系統(tǒng), 設(shè)置所需攪拌速度(如600r/min)并開啟攪拌.
4) 點(diǎn)擊開始測(cè)定按鈕, 系統(tǒng)將自動(dòng)記錄溶液溫度(T)隨時(shí)間(t)變化的曲線. 當(dāng)溶液溫度在30 s內(nèi)基本保持不變時(shí), 將反應(yīng)物B快速加入保溫杯中, 待溶液溫度達(dá)到最高或最低并下降一段時(shí)間, 約3 min左右結(jié)束測(cè)量.
5) 從系統(tǒng)記錄的T~t曲線上讀取反應(yīng)開始至反應(yīng)達(dá)到最高或最低溫度所需的時(shí)間, 視為反應(yīng)時(shí)間(t). 利用系統(tǒng)程序進(jìn)行雷諾溫度校正, 在溫度變化值中讀取該反應(yīng)的溫升或溫降(ΔT). 以NaOH溶液與鹽酸反應(yīng)及NaHCO3固體與鹽酸反應(yīng)體系為例, 實(shí)驗(yàn)系統(tǒng)直接記錄并導(dǎo)出的T~t曲線分別示于圖3A和3B中.

圖3 儀器直接導(dǎo)出的T~t曲線反應(yīng)
6) 保存圖像, 清洗反應(yīng)裝置及溫度傳感器, 關(guān)閉系統(tǒng), 結(jié)束實(shí)驗(yàn).
3 實(shí)驗(yàn)結(jié)果及數(shù)據(jù)分析
反應(yīng)物濃度或用量會(huì)直接影響ΔT, 攪拌速度會(huì)影響T~t曲線的形貌, 對(duì)ΔT也有一定影響. 因此, 需優(yōu)化這些參數(shù). 由于各反應(yīng)體系的情況不同, 優(yōu)化的細(xì)節(jié)不再詳細(xì)討論.
3.1 氫氧化鈉溶液與鹽酸中和反應(yīng)熱測(cè)定
首先按照2.2中1)所描述的方法, 用Na2CO3基準(zhǔn)試劑標(biāo)定鹽酸(約1.00 mol/L), 其準(zhǔn)確濃度為0.981 9 mol/L.
在優(yōu)化的攪拌速度(600r/min)下, 測(cè)定25.00 mL 鹽酸(0.981 9 mol/L)與25.00 mL NaOH溶液(1.10 mol/L)反應(yīng)的溫升(ΔT), 平行測(cè)定5次, 實(shí)驗(yàn)結(jié)果列于表2中, 其T~t曲線之一呈現(xiàn)于圖4a中. 由式(1)計(jì)算出中和反應(yīng)熱(ΔHm), 所用反應(yīng)體系的總質(zhì)量m為 25.00 mL 鹽酸(0.981 9 mol/L)與25.00 mL NaOH溶液(1.10 mol/L)的總質(zhì)量, 通過(guò)分析天平準(zhǔn)確稱量得到, 其5次測(cè)定的平均值為51.028 3 g.
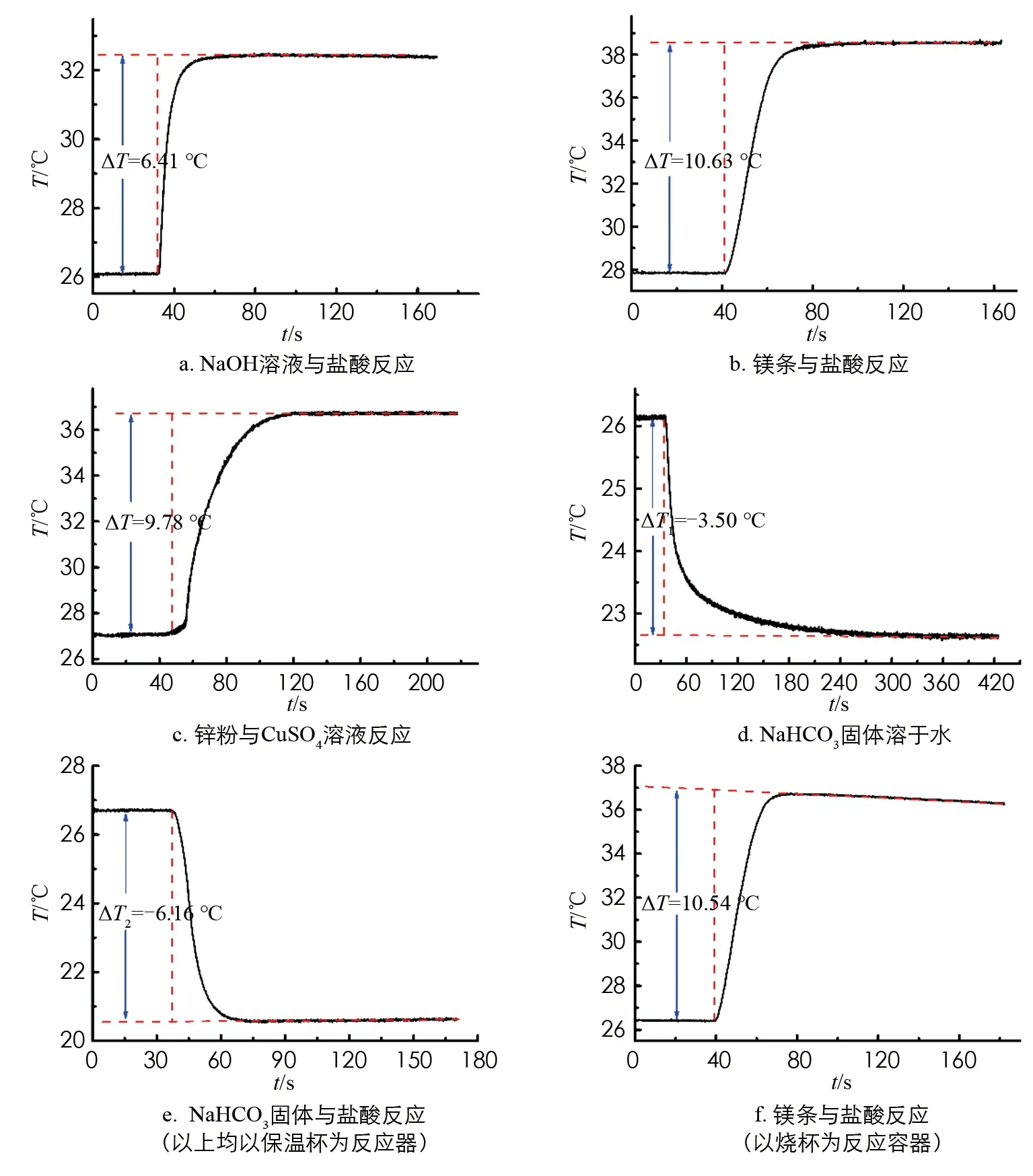
圖4 T~t曲線反應(yīng)
如表2所示, 在不對(duì)反應(yīng)容器、 溫度傳感器和攪拌子進(jìn)行吸熱校正的情況下, NaOH溶液與鹽酸中和反應(yīng)熱的平均值為-55.9 kJ/mol, 接近該反應(yīng)熱的理論值(-57.3 kJ/mol)[16]. 根據(jù)如下公式(2)計(jì)算ΔHm平均值的相對(duì)誤差為-2.4%, 5次測(cè)定的相對(duì)標(biāo)準(zhǔn)偏差(RSD)為0.5%, 表明測(cè)定的準(zhǔn)確度和精密度高, 且反應(yīng)時(shí)間短(不超過(guò)2 min).
(2)
3.2 鎂條與稀鹽酸置換反應(yīng)熱測(cè)定
根據(jù)蓋斯定律計(jì)算鎂與稀鹽酸置換反應(yīng)熱的理論值, 計(jì)算公式如下:
=-466.9 kJ/mol-0 kJ/mol-0 kJ/mol-0 kJ/mol
=-466.9 kJ/mol
(3)
各物質(zhì)的標(biāo)準(zhǔn)摩爾生成焓數(shù)值來(lái)自大學(xué)基礎(chǔ)化學(xué)[17]教材附錄, 計(jì)算所得鎂與稀HCl置換反應(yīng)熱ΔHm的理論值為-466.9 kJ/mol.
在優(yōu)化的攪拌速度(600r/min)和鎂條質(zhì)量(約為1.2 g)下, 測(cè)定鎂條與50.00 mL 2.00 mol/L 鹽酸的反應(yīng)溫升(ΔT), 平行測(cè)定5次, 實(shí)驗(yàn)結(jié)果列于表3中, 其T~t曲線之一呈現(xiàn)于圖4b中. 由公式(1)計(jì)算反應(yīng)熱(ΔHm), 所用反應(yīng)體系的總質(zhì)量m為鎂條與50.00 mL 2.00 mol/L 鹽酸的總質(zhì)量(忽略生成H2的質(zhì)量), 通過(guò)分析天平準(zhǔn)確稱量得到, 其5次測(cè)定的平均值為51.400 1 g.

表3 鎂條與鹽酸置換反應(yīng)熱測(cè)定的實(shí)驗(yàn)數(shù)據(jù)
如表3所示, 在不對(duì)反應(yīng)容器、 溫度傳感器和攪拌子進(jìn)行吸熱校正的情況下, 鎂條與鹽酸置換反應(yīng)熱的平均值為-463.7 kJ/mol, 接近該反應(yīng)熱的理論值(-466.9 kJ/mol). 根據(jù)公式(2)計(jì)算ΔHm平均值的相對(duì)誤差為-0.7%, 5次測(cè)定的相對(duì)標(biāo)準(zhǔn)偏差為0.8%, 測(cè)量的準(zhǔn)確度和精密度高, 且反應(yīng)時(shí)間短(不超過(guò)2 min).
3.3 鋅粉與硫酸銅溶液置換反應(yīng)熱測(cè)定
在優(yōu)化的實(shí)驗(yàn)條件下, 即控拌速度為900r/min, 鋅粉質(zhì)量為1.5 g時(shí), 測(cè)定鋅粉與50.00 mL CuSO4溶液反應(yīng)的溫升(ΔT), 平行測(cè)定5次, 實(shí)驗(yàn)結(jié)果列于表4中, 其T~t曲線之一呈現(xiàn)于圖4c中. 由公式(1)計(jì)算反應(yīng)熱(ΔHm), 所用反應(yīng)體系的總質(zhì)量m近似等于50.00 mL CuSO4溶液的總質(zhì)量, 通過(guò)分析天平準(zhǔn)確稱量得到, 其5次測(cè)定的平均值為51.294 2 g.

表4 鋅粉與CuSO4溶液置換反應(yīng)熱測(cè)定的實(shí)驗(yàn)數(shù)據(jù)
如表4所示, 在不對(duì)反應(yīng)容器、 溫度傳感器和攪拌子進(jìn)行吸熱校正的情況下, 反應(yīng)熱的平均值為-208.2 kJ/mol, 接近該反應(yīng)熱的理論值(-216.8 kJ/mol)[18]. 根據(jù)公式(2)計(jì)算ΔHm平均值的相對(duì)誤差為-4.0%, 5次測(cè)定的相對(duì)標(biāo)準(zhǔn)偏差為1.1%, 且反應(yīng)時(shí)間短(不超過(guò)2 min).
3.4 碳酸氫鈉與鹽酸復(fù)分解反應(yīng)熱測(cè)定
在優(yōu)化的攪拌速度(900r/min)下, 分別測(cè)定4.200 0 g NaHCO3固體溶于50.00 mL去離子水中的溫降(ΔT1)和50.00 mL 2.00 mol/L鹽酸中的溫降(ΔT2), 各平行測(cè)定5次, 結(jié)果分別列于表5和6中, 相應(yīng)的T~t曲線之一分別呈現(xiàn)于圖4d和4e中. 二者差值(ΔT2-ΔT1)即為NaHCO3固體與鹽酸復(fù)分解反應(yīng)的溫降(ΔT)(注: 由ΔT2和ΔT1的平均值計(jì)算). 由公式(1)計(jì)算置換反應(yīng)熱(ΔHm), 反應(yīng)體系的總質(zhì)量m為NaHCO3固體與50.00 mL 鹽酸的總質(zhì)量, 通過(guò)分析天平準(zhǔn)確稱量得到, 其5次測(cè)定的平均值為55.600 1 g.

表5 NaHCO3固體溶于去離子水中的溫度變化
如表6所示, NaHCO3固體與鹽酸復(fù)分解反應(yīng)熱的平均值為12.1 kJ/mol, 接近該反應(yīng)熱的理論值(12.5 kJ/mol)[15]. 根據(jù)公式(2)計(jì)算ΔHm平均值的相對(duì)誤差為-3.2%, 5次測(cè)定的相對(duì)標(biāo)準(zhǔn)偏差為1.9%. 反應(yīng)時(shí)間ΔT2小于2 min.

表6 NaHCO3固體與鹽酸復(fù)分解反應(yīng)熱測(cè)定的實(shí)驗(yàn)數(shù)據(jù)
3.5 以燒杯替代保溫杯的實(shí)驗(yàn)可行性探究
由于簡(jiǎn)易保溫杯不透明, 不利于學(xué)生觀察反應(yīng)體系的變化, 為更好拓展該實(shí)驗(yàn)在中學(xué)化學(xué)教學(xué)中的應(yīng)用, 我們探究了以燒杯替代保溫杯進(jìn)行該系列實(shí)驗(yàn)的可行性. 以鎂條與鹽酸置換反應(yīng)熱的測(cè)定為例, 控制攪拌速度為600r/min, 鎂條質(zhì)量約為0.12 g, 鹽酸濃度為2.00 mol/L時(shí), 以敞置的燒杯作為反應(yīng)容器, 測(cè)定反應(yīng)的溫升(ΔT), 平行測(cè)定5次, 結(jié)果列于表7中. 其T~t曲線之一呈現(xiàn)于圖4f中.

表7 鎂條與鹽酸置換反應(yīng)熱測(cè)定的實(shí)驗(yàn)數(shù)據(jù)
相較于保溫杯作為反應(yīng)器(圖4b), 以敞置的燒杯作為反應(yīng)器時(shí), 反應(yīng)溫度達(dá)到最高值后, 其溫度下降趨勢(shì)更明顯, 緣于敞置燒杯使得反應(yīng)體系與外界環(huán)境的熱交換更明顯. 而且可以非常明顯觀察到鎂條表面有大量氣體生成, 鎂條體積越來(lái)越小直到完全消失, 表明反應(yīng)完全. 由公式(1)計(jì)算出置換反應(yīng)熱(ΔHm), 其平均值為-456.4 kJ/mol, 相對(duì)誤差為-2.2%, 5次測(cè)定的相對(duì)標(biāo)準(zhǔn)偏差為1.0%, 結(jié)果列于表7中.
還以敞置燒杯為反應(yīng)器, 測(cè)試了鋅粉與CuSO4溶液的置換反應(yīng)熱, 實(shí)驗(yàn)結(jié)果為: 反應(yīng)熱的平均值為-206.4 kJ/mol, 測(cè)定的相對(duì)誤差為-4.8%, 5次測(cè)定的相對(duì)標(biāo)準(zhǔn)偏差為0.7%. 以燒杯為反應(yīng)器, 可以非常直觀地觀察到CuSO4溶液的藍(lán)色隨反應(yīng)進(jìn)行逐漸變淺, 直到完全消失, 最后燒杯中有大量褐色沉淀, 為沒(méi)反應(yīng)完的鋅粉和置換生成的單質(zhì)Cu的混合物, 如圖5所示.

圖5 鋅粉與CuSO4置換反應(yīng)
實(shí)驗(yàn)結(jié)果表明該數(shù)字化實(shí)驗(yàn)系統(tǒng)的雷諾溫度校正能較好彌補(bǔ)燒杯反應(yīng)器所導(dǎo)致的熱散失, 也表明了以燒杯替代保溫杯作為反應(yīng)器在反應(yīng)熱測(cè)定實(shí)驗(yàn)中的可行性. 以燒杯作為反應(yīng)器, 其最大優(yōu)點(diǎn)是反應(yīng)器非常簡(jiǎn)單, 易于實(shí)驗(yàn)且便于觀察, 在中學(xué)化學(xué)實(shí)驗(yàn)教學(xué)中具有很好的適用性.
4 研究?jī)r(jià)值與結(jié)論
4.1 對(duì)化學(xué)學(xué)科核心素養(yǎng)的發(fā)展和培養(yǎng)
反應(yīng)熱數(shù)字化實(shí)驗(yàn)設(shè)計(jì)有利于中學(xué)化學(xué)學(xué)科核心素養(yǎng)的發(fā)展和培養(yǎng), 具體分析如下.
培養(yǎng)“宏觀辨識(shí)與微觀探析”的素養(yǎng). 以典型放熱反應(yīng)(NaOH+HCl, Mg+HCl, Zn+CuSO4)及吸熱反應(yīng)(NaHCO3+HCl)體系為研究對(duì)象設(shè)計(jì)反應(yīng)熱測(cè)定的數(shù)字化實(shí)驗(yàn), 利于引導(dǎo)學(xué)生從不同反應(yīng)類型(中和反應(yīng), 置換反應(yīng)和復(fù)分解反應(yīng))的實(shí)質(zhì)分析化學(xué)能與熱能轉(zhuǎn)化的微觀本質(zhì), 理解化學(xué)反應(yīng)與體系能量變化是同時(shí)發(fā)生的; 有助于學(xué)生利用觀察到的微觀反應(yīng)本質(zhì)對(duì)宏觀現(xiàn)象進(jìn)行辨析和探索, 豐富學(xué)生對(duì)化學(xué)變化的視覺(jué)體驗(yàn), 增強(qiáng)學(xué)生對(duì)不同熱效應(yīng)的微觀本質(zhì)的理解和對(duì)微觀世界的好奇, 更好地搭建宏觀與微觀之間的橋梁, 激發(fā)學(xué)生學(xué)習(xí)興趣.
培養(yǎng)“證據(jù)推理與模型認(rèn)知”的素養(yǎng). 數(shù)字化實(shí)驗(yàn)系統(tǒng)所測(cè)T~t曲線連續(xù)、 直觀, 所得數(shù)據(jù)準(zhǔn)確. 不同類型反應(yīng), 不同熱效應(yīng)和不同物態(tài)參與的反應(yīng)體系的T~t曲線各有其特點(diǎn), 當(dāng)其全面系統(tǒng)呈現(xiàn)給學(xué)生時(shí), 更有利于學(xué)生總結(jié)熱效應(yīng)的變化規(guī)律, 收集證據(jù), 分析推理, 形成對(duì)反應(yīng)熱的認(rèn)知模型. 通過(guò)收集不同反應(yīng)體系的T~t曲線, 可以更好理解不同反應(yīng)的微觀本質(zhì)對(duì)反應(yīng)溫升或溫降的影響規(guī)律, 運(yùn)用已有知識(shí)推理解釋所得規(guī)律變化. 如對(duì)比NaHCO3固體溶于水和鹽酸中的溫度變化, 有助于學(xué)生更好理解NaHCO3固體的溶解熱和NaHCO3溶液與鹽酸的反應(yīng)熱, 均為吸熱反應(yīng); 其溶解時(shí)的溫度變化測(cè)定可以推廣到其他溶解熱的測(cè)定中. 此外, 本實(shí)驗(yàn)中形成的雷諾溫度校正思維模型, 根據(jù)過(guò)去和現(xiàn)在的發(fā)展趨勢(shì)推斷未來(lái)的結(jié)果, 可以推廣到其他反應(yīng)熱測(cè)定實(shí)驗(yàn)中.
培養(yǎng)“科學(xué)態(tài)度”與“創(chuàng)新精神”. 數(shù)字化實(shí)驗(yàn)顯著提高了化學(xué)反應(yīng)熱測(cè)定的準(zhǔn)確性、 實(shí)時(shí)性、 操控性和可視性. 通過(guò)探究以燒杯替代保溫杯進(jìn)行實(shí)驗(yàn)的可行性, 幫助學(xué)生形成嚴(yán)謹(jǐn)?shù)目茖W(xué)態(tài)度及尊重客觀事實(shí)的實(shí)驗(yàn)品質(zhì), 激發(fā)學(xué)生對(duì)科學(xué)現(xiàn)象的探究欲, 培養(yǎng)學(xué)生的創(chuàng)新意識(shí), 提高學(xué)生解決問(wèn)題的能力.
4.2 結(jié)論
1) 利用本研究組自制的MXLab21先進(jìn)數(shù)字化化學(xué)實(shí)驗(yàn)系統(tǒng), 以簡(jiǎn)易保溫裝置為反應(yīng)器, 在不對(duì)反應(yīng)器、 溫度傳感器和攪拌子的吸熱進(jìn)行校正的情況下, 利用軟件系統(tǒng)自主進(jìn)行的雷諾溫度校正, 即可得到滿意的ΔHm測(cè)定結(jié)果. 且裝置簡(jiǎn)單, 操作簡(jiǎn)便, 測(cè)試時(shí)間短.
2) 該數(shù)字化實(shí)驗(yàn)設(shè)計(jì)不僅適合于中和反應(yīng)熱、 置換反應(yīng)熱、 復(fù)分解反應(yīng)熱的測(cè)定, 還適用于不同反應(yīng)熱效應(yīng), 不同物態(tài)參與的反應(yīng)體系的反應(yīng)熱的測(cè)定, 可作為中學(xué)化學(xué)反應(yīng)熱定量實(shí)驗(yàn)教學(xué)的重要參考.
3) 利用蓋斯定律計(jì)算鎂與鹽酸置換反應(yīng)熱的理論值, 有助于學(xué)生理解和掌握蓋斯定律在反應(yīng)熱計(jì)算中的應(yīng)用這一教學(xué)重點(diǎn)和難點(diǎn).
4) 系列反應(yīng)熱的數(shù)字化實(shí)驗(yàn)設(shè)計(jì)對(duì)中學(xué)化學(xué)學(xué)科核心素養(yǎng)培養(yǎng)和發(fā)展具有重要價(jià)值.

