復發性阿弗他口腔潰瘍患者唾液外泌體miR-142-5p、FOXO3表達的相關性研究
童遠武,董方,李艷莉,肖瑩
復發性阿弗他口腔潰瘍(recurrent aphthous ulcer,RAU)是與體液免疫有密切關系的口腔黏膜破損疾病,主要表現為口腔局部黏膜變紅、腫脹、發熱、疼痛,多可自愈,但反復出現,影響患者進食、言語等[1-2]。各種因素(局部損傷、炎性反應、營養不良、B族維生素缺乏等)導致的免疫功能損傷可引發該病,因此從免疫學角度分析RAU的相關致病因子有助于該疾病的預防與治療[3-7]。唾液腺外泌體是指存在于唾液中的直徑30~50 μm的細胞外囊泡,唾液外泌體可作為治療的藥物載體,唾液外泌體miRNA可作為潛在的口腔疾病標志物[8-9]。已有研究證明[6],唾液外泌體miR-142-5p可介導獲得性中耳脂瘤的炎性免疫調節。叉頭轉錄蛋白O亞族3(FOXO3)在潰瘍性結腸炎中占據重要地位[5]。基于miR-142-5p、FOXO3在免疫功能中發揮的不同作用,猜測二者可能在RAU患者中同樣發揮作用。因此,本研究通過檢測RAU唾液外泌體miR-142-5p、FOXO3表達水平,并分析其與患者免疫功能的關系,以期為RAU的預防和治療提供新的理論依據,報道如下。
1 資料與方法
1.1 臨床資料 收集2019年12月—2021年12月三亞中心醫院/海南省第三人民醫院口腔科收治復發性阿弗他口腔潰瘍患者134例作為研究對象(觀察組), 其中男50例,女84例,年齡18~62(44.37± 5.27)歲。另選取同期健康志愿者134例作為健康對照組,男50例,女84例,年齡18~63(44.62±5.48)歲。2組性別、年齡比較差異無統計學意義(P>0.05),具有可比性。本研究經醫院倫理委員會批準(20191103),受試者及家屬知情同意并簽署知情同意書。
1.2 病例選擇標準 (1)納入標準:符合復發性口腔潰瘍診斷標準[10];患者均配合取樣、治療、研究;患者6個月內每2個月均復發超過1次,且患者就診時處于潰瘍期。(2)排除標準:存在顯著的心、肝、肺等器質性改變;紅斑狼瘡等自身免疫性疾病,近1個月內使用過免疫抑制劑;就診時潰瘍發作超過3 d;妊娠期、哺乳期女性。
1.3 觀測指標與方法
1.3.1 qPCR檢測miR-142-5p、FOXO3 mRNA水平:研究對象漱口后收集唾液標本(舌頂上顎,唾液流入收集盒),唾液離心去除細胞等雜質,通過唾液外泌體試劑盒提取唾液外泌體(Norgen Biotek),低溫保存。提取唾液外泌體總RNA(TRIzol試劑),將適量RNA逆轉錄為cDNA[miRcute miRNA cDNA 第一鏈合成試劑盒購自天根生化科技(北京)有限公司],使用miRcute miRNA熒光定量檢測試劑盒[天根生化科技(北京)有限公司]配置qPCR反應體系,使用羅氏LightCycler480 Ⅱ實時熒光定量PCR系統(Roche,型號:LightCycler480 Ⅱ)進行qPCR反應,反應條件:95℃預處理2 min、95℃ 10 s、55℃ 15 s、72℃ 10 s,共40次循環。引物序列見表1。采用2-△△CT法定量miR-142-5p、FOXO3 mRNA水平,U6、GAPDH分別作為內參。
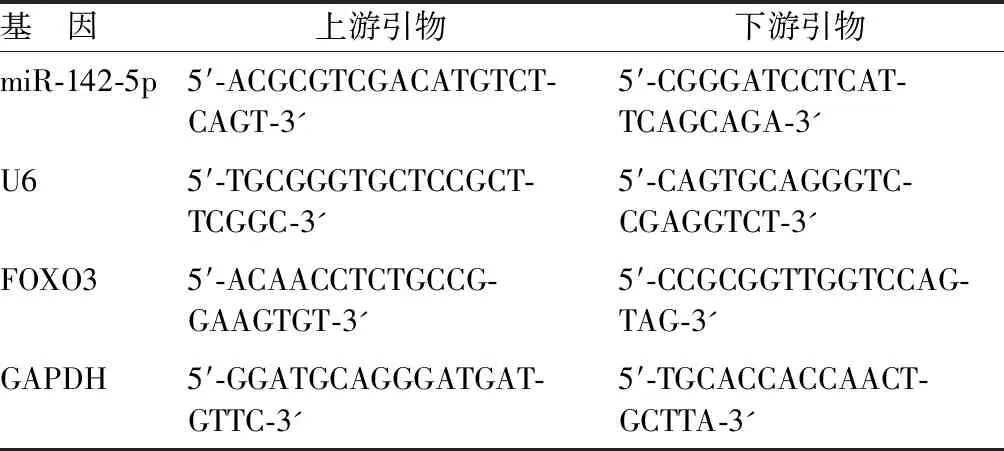
表1 qRT-PCR引物序列
1.3.2 Western-blot檢測唾液外泌體中FOXO3蛋白表達水平:提取唾液外泌體樣本中總蛋白,BCA試劑盒測量蛋白質濃度,行SDS凝膠電泳(LabYeah電泳儀,上海百賽生物公司),轉膜后封閉。添加一抗[FOXO3(abcam公司)1∶1 000、GAPDH(內參),1∶5 000]孵育過夜清洗后加入山羊抗兔二抗(1∶5 000)。清洗3次后,使用Axygen凝膠成像系統(廣州科適特科學儀器公司)測定蛋白條帶灰度值,Image J分析蛋白質灰度值。
1.3.3 流式細胞術檢測CD3+CD4+、CD3+CD8+細胞比例:晨起收集受試者空腹肘靜脈血10 ml于抗凝離心管中,離心后棄上清,-80℃保存待測。取上述抗凝血100 μl,加入相應CD3-CY5、CD4-FITC、CD8-PE熒光標記抗體各20 μl,避光孵育30 min,加入溶血素,混勻后離心,清洗2次后棄上清,PBS懸浮細胞,流式細胞儀(美國艾森公司,型號:NOVOCYTE3130)檢測CD3+CD4+、CD3+CD8+細胞比例,并計算CD4+/CD8+比值。
1.3.4 疼痛評分、潰瘍面積評定:采用視覺模擬量表(VAS)[10]評定疼痛指數,總分10分,評分越高,疼痛越重。鏡下用標尺測量患者潰瘍最大直徑和垂直直徑(與最大直徑垂直),計算潰瘍面積(mm2)=最大直徑×垂直直徑。
2 結 果
2.1 2組miR-142-5p、FOXO3 mRNA水平比較 與健康對照組比較,觀察組患者唾液外泌體miR-142-5p水平升高(P<0.01),FOXO3 mRNA、蛋白水平降低(P<0.01),見表2、圖1。

圖1 健康對照組與觀察組唾液外泌體FOXO3蛋白水平比較
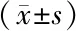
表2 健康對照組與觀察組唾液外泌體miR-142-5p、FOXO3 mRNA水平比較
2.2 2組免疫指標比較 與健康對照組比較,觀察組患者外周血CD3+CD4+、CD4+/CD8+細胞比值下降(P<0.01),外周血CD3+CD8+細胞比例升高(P<0.01),見表3。
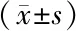
表3 健康對照組與觀察組外周血免疫指標水平比較
2.3 觀察組患者不同亞組間疼痛指數、潰瘍面積比較 將觀察組患者唾液外泌體miR-142-5p、FOXO3 mRNA分別按照均數2.35、0.35分組,miR-142-5p≥2.35為高表達亞組82例,<2.35為低表達亞組52例;FOXO3≥0.35為高表達亞組55例,<0.35為低表達亞組79例。與miR-142-5p低表達亞組比較,miR-142-5p高表達亞組患者疼痛指數升高、潰瘍面積增大(P<0.01)。與FOXO3高表達亞組比較,FOXO3低表達亞組患者疼痛指數、潰瘍面積升高(P<0.01),見表4。
表4 不同 miR-142-5p、FOXO3 mRNA水平患者疼痛指數、潰瘍面積比較
2.4 唾液外泌體miR-142-5p、FOXO3 mRNA與免疫指標相關性分析 觀察組患者唾液外泌體miR-142-5p與CD3+CD4+、CD4+/CD8+細胞比值均呈負相關(P均<0.01),FOXO3 mRNA與CD3+CD4+、CD4+/CD8+細胞比值均呈正相關(P均<0.01),患者miR-142-5p、FOXO3與CD3+CD8+細胞比例均無相關性(P>0.05),而miR-142-5p與FOXO3呈負相關(r=-0.368,P<0.001),見表5。
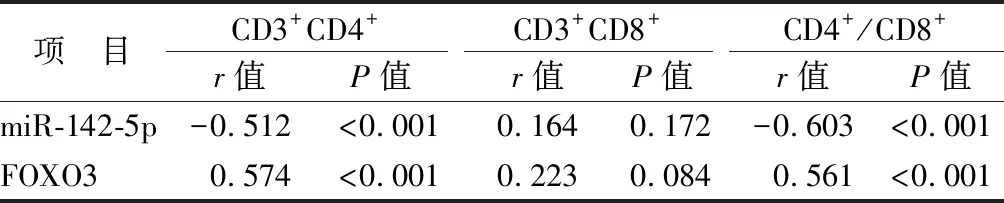
表5 復發性阿弗他口腔潰瘍患者唾液外泌體miR-142-5p、FOXO3 mRNA與CD3+CD4+、CD3+CD8+、CD4+/CD8+的相關性
2.5 miR-142-5p、FOXO3 mRNA表達水平預測RAU復發的價值 繪制ROC曲線,并計算曲線下面積(AUC),結果顯示,miR-142-5p、FOXO3 mRNA及二者聯合預測RAU復發的AUC分別為 0.810、0.809、0.947,二者聯合檢測優于各自單獨預測效能(Z=6.528、8.573,P均<0.001),見表6、圖2。
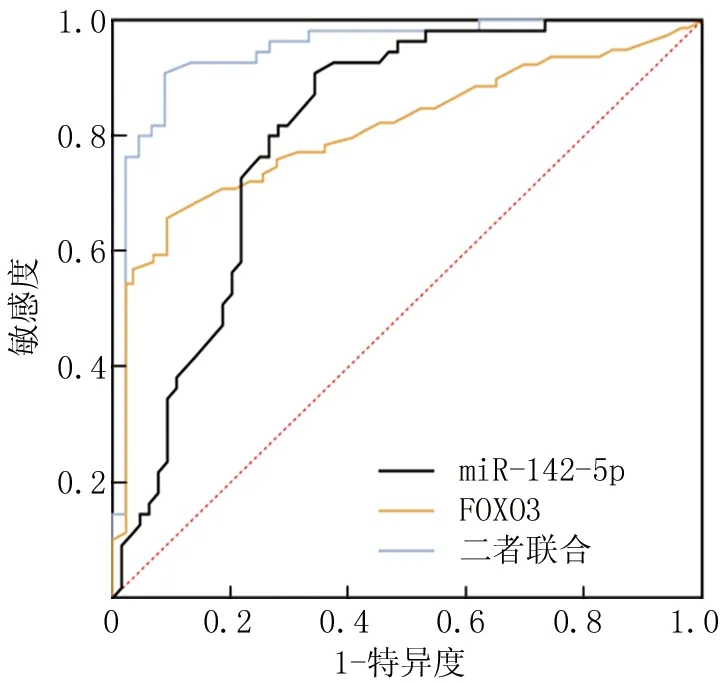
圖2 miR-142-5p、FOXO3 mRNA表達水平預測RAU復發的ROC曲線

表6 miR-142-5p、FOXO3 mRNA表達水平預測RAU復發的價值比較
3 討 論
RAU主要是以口腔黏膜反復破損為表現的深層次潰瘍,臨床上分為輕型潰瘍、腺周口創和皰疹樣潰瘍[1]。根據最新統計資料顯示,全球有25%的人曾經發生過口腔潰瘍[2]。RAU的誘發因素具有復雜性和多樣性特點,其中研究發現機體免疫反應在復發性口腔潰瘍的發病機制中占據重要地位[3]。研究表明[3-4],在復發性口腔潰瘍病理組織中,促炎性細胞因子IL-2、IL-12、TNF-α和IFN-γ處于高表達,同時炎性因子抑制劑TGF-β和IL-10低表達,說明炎性因子的分泌失衡是造成此疾病的誘發因素之一;研究顯示,CD4+細胞與復發性口腔潰瘍的發病具有密切相關性[4];另有研究提示,潰瘍前期、潰瘍發作期與間歇期T淋巴細胞亞群均有顯著變化,介導患者的免疫應答,最終導致口腔黏膜的持續炎性反應[6];在人體遇刺激引發免疫損傷時,機體內CD4+細胞比例下降,而CD8+占比升高,CD4+/CD8+比值降低,兩者的比值可顯示患者免疫力損傷嚴重程度[3]。因此,早期發現患者體液中異常的免疫反應,成為及時干預和早期治療RAU的關鍵。
目前,針對口腔類疾病診斷的方法越來越多,如液基細胞學檢測、組織病理學檢測等,但是上述診斷方式的有創性,常會引起患者和家屬的排斥。唾液是口腔疾病輔助性診斷體液,留取樣本方便,唾液的蛋白質組學、基因組學研究提高了口腔疾病的診斷水平,因此通過無創或微創采集患者唾液標本進行相關檢測和診斷,成為目前臨床診療中最常用的方式。唾液中的外泌體不僅可以作為治療的藥物載體,同時唾液外泌體miRNA可作為潛在的口腔疾病標志物[8-9],通過檢測唾液外泌體的差異性尋找疾病發生、發展的內在機制已成為學術界新的熱點。基于以上觀點,本研究以唾液外泌體標本中差異性表達的miRNAs為切入點,聚焦外泌體miR-142-5p和FOXO3的表達與RAU患者體液免疫之間的相關性。既往類似研究發現,在癌癥、免疫相關疾病患者的活檢組織中miR-142-5p呈過度表達[11-13]。Han等[14]研究顯示,miR-142-5p在排斥反應免疫應答中上調。李媛等[8]研究顯示,miR-142-5p可在體外直接影響CD4+T細胞亞群Th17細胞發育,促進IL-17的產生,大鼠組織炎性因子水平升高,促進自身免疫性葡萄膜炎進展。本研究結果顯示,RAU患者中唾液外泌體miR-142-5p水平顯著高于健康對照組人群,這與以上研究結果一致,因此從側面證實了miR-142-5p正向參與患者細胞免疫的調控。
FOXO3屬于FOXO家族,同樣在機體的免疫應答中發揮重要作用,在FOXO3缺乏的T細胞中,Th17細胞比例明顯上調[15]。閔敏[16]研究顯示,FOXO3在潰瘍性結腸炎中可被miR-155下調,調節IL-8參與潰瘍性結腸炎結腸黏膜炎性反應的發展。而潰瘍性結腸炎屬于非特異性炎性疾病,易反復發作,可能與免疫功能失常有關,這與復發性口腔潰瘍有部分病因、發病機制重合,且復發性口腔潰瘍發生幾率高于潰瘍性結腸炎。本試驗研究結果顯示,RAU唾液外泌體中FOXO3 mRNA與蛋白表達水平顯著低于健康對照組,與CD3+CD4+、CD4+/CD8+細胞比值呈正相關,說明FOXO3負向參與RAU中機體的免疫反應,筆者查閱以往的生物信息學分析結果發現[8,17-20],FOXO3是miR-142-5p的靶基因,兩者存在結合位點,miR-142-5p可調控FOXO3參與自身免疫性葡萄膜炎的發展。本試驗結果提示,RAU患者免疫調節中miR-142-5p過表達,但FOXO3表達顯著降低,因此提示在RAU患者中miR-142-5p過表達可達抑制FOXO3的表達,唾液外泌體miR-142-5p和FOXO3存在負相關調控,兩者共同參與RAU免疫失常,但其具體調控機制仍需進一步試驗得出相關數據。
本試驗還研究了miR-142-5p、FOXO3 mRNA表達水平與患者疼痛指數、潰瘍面積的影響,結果顯示,當miR-142-5p表達高于平均值時,患者的疼痛加劇,且潰瘍的面積明顯增大;當FOXO3處于低表達時,會出現相同的表現,這從側面表明miR-142-5p與FOXO3共同參與了RAU的免疫失常,并與其表達量成一定的關系,本試驗并未進行相關深入研究,未來會進行相關性定量分析。
綜上所述,復發性阿弗他口腔潰瘍患者唾液外泌體miR-142-5p/FOXO3分子作用靶點共同參與對RAU的免疫調控,其中miR-142-5p為正向調控,FOXO3為負向調控,同時關于兩者的表達定量對RAU患者的影響需要進一步深入研究。
利益沖突:所有作者聲明無利益沖突
作者貢獻聲明
童遠武:設計研究方案,實施研究過程,論文撰寫,論文審核;董芳、李艷莉:分析試驗數據,論文審核;肖瑩:資料搜集整理,分析試驗數據,論文修改

