重寄生枝孢菌的鑒定及轉錄組學分析
梅超 余進德 隋文靜 張夢秋 楊俊聰 陳玉惠 李靖

摘要:從感石楠葉銹病病菌的球花石楠葉片上獲得的3株重寄生菌SYC4、SYC23和SYC63,為確定其分類地位及在銹菌孢子誘導下菌絲體基因的表達情況,采用形態學特征結合分子序列分析將菌株鑒定到種,并對重寄生效果較好的菌株SYC63進行轉錄組測序。結果表明,經鑒定SYC4、SYC23為Cladosporium anthropophilum,SYC63為枝狀枝孢菌(C. cladosporioides)。對菌株SYC63獲得的轉錄組數據與不同數據庫進行比對,在Nr數據庫中有11 002個基因被注釋到,除其他物種外,枝孢菌SYC63與南極枝孢菌(Rachicladosporium antarcticum)有2 130個基因相似,所占物種匹配最高;在GO數據庫中注釋到8 088個基因,基因數量最多的是生物學過程,其次是分子功能和細胞組分。在差異表達基因中發現,與重寄生相關的凝集素、絲裂原活化蛋白激酶(MAPK)信號通路及抗性次級代謝物有關的基因經銹菌孢子誘導后顯著上調表達。以上研究為重寄生枝孢菌在植物病害的生物防治應用中提供了菌株來源,并為其重寄生機制的深入研究提供了理論基礎。
關鍵詞:重寄生;分子鑒定;石楠銹孢銹菌;枝孢菌;轉錄組
中圖分類號:S476.1;S182文獻標志碼:A
文章編號:1002-1302(2023)05-0019-11
在自然界中,重寄生(mycoparasitism)在銹病中普遍存在,通過營養關系使寄主植物、病原菌與重寄生菌形成一條完整的食物鏈[1]。因而利用重寄生菌防治寄主植物的病原菌,是保護生物多樣性和植物病害生物防治方面的新途徑[2]。目前,已有大量研究利用重寄生菌防治銹病,例如從花棒銹病菌[Uromyces onobrychidis (Desm.) Lev.][3]、樟子松皰銹病病原菌松芍柱銹菌[Cronartium flaccidum (Alb.et Schw.) Wint.][4]、小駁骨銹病[5]和茶藨生柱銹菌(Cronartium ribicola J.C.Fischer)[6]等中分離得到的重寄生菌株在銹病中表現出顯著的抑制作用。
園林綠化樹種石楠的葉銹病是因石楠銹孢銹菌(Aecidium pourthiaea)[現被更正為文山春孢銹菌(Aecidium wenshanese)]寄生而致病的,其重寄生菌主要包括擬盤多毛孢屬(Pestalotiopsis sp.)、枝孢屬(Cladosporium sp.)、鐮刀菌屬(Fusarium sp.)及木霉屬(Trichoderma sp.)等多種真菌[7-9]。1815年,Link建立和描述了枝孢屬,現在它主要分為三大復合體,即枝狀枝孢(C. cladosporioides)、多主枝孢(C. herbarum)和球孢枝孢(C. sphaerospermum),已知的枝孢菌有一半以上屬于C. cladosporioides復合體[10]。高度寄生的枝孢菌形態特征主要體現在無性形態上,由于形態鑒定是一個難點,但使用形態及分子聯合的方法,200個物種被重新定義,具有較清晰的形態和系統發育界限[10]。分子分析已成為鑒定枝孢屬種的有效方法。
近幾年,對于重寄生作用機制已經從生理生化及分子水平上展開了相關研究。多數學者認為,重寄生作用機制主要包括酶和毒素2個方面,其中酶方面指的是重寄生菌可產生降解寄主真菌細胞壁的酶,而毒素是重寄生菌與寄主菌相互作用產生的抗菌次級代謝物,能殺死寄主真菌[7,11-13]。隨著測序技術的飛速發展,基因組、轉錄組及代謝組學測序等已被廣泛應用于對重寄生菌的研究之中。轉錄組是指一個細胞在不同生長時期或生長環境下,自身基因的表達情況不完全相同,具有特定的時間性和空間性特征[14]。范海娟通過不同誘導物對哈茨木霉ACC30317進行誘導并轉錄組測序,分析發現有311條Unigene基因與重寄生機制相關,認為該菌的生防機制是以重寄生為主[15]。Reithner等同樣利用轉錄組測序手段,分析發現重寄生菌木霉IMI206040與立枯絲核菌(Rhizoctonia solani)相互作用后參與細胞壁降解的各類基因協同轉錄[16]。
實際上多種重寄生菌,特別是枝孢屬和銹生座孢屬(Tuberculina sp.)的真菌已經克服寄主障礙,顯示出寄生物的進化,這將有利于生防菌的開發與利用[17]。筆者所在課題組前期從患石楠銹孢銹菌的球花石楠葉片上分離得到3株重寄生菌,其具有破壞銹孢子壁,導致細胞質外溢而使銹孢子死亡的重寄生能力,而對寄主植物是安全的[7]。對重寄生效果最好的菌株SYC63進行了基因組測序并初步分析了重寄生機制,發現其真菌細胞壁降解酶類中的幾丁質酶(GH18、GH20家族)基因、β-1,3-葡聚糖酶(GH17、GH64和GH81家族)基因在經銹菌孢子壁誘導后表達量顯著上調[18]。本研究擬將3株枝孢菌鑒定到種,同時利用課題組前期獲得的枝孢菌SYC63轉錄組數據進行生物信息學分析,以期為促進枝孢菌SYC63重寄生作用機制的研究提供理論依據。
1 材料與方法
1.1 試驗材料
試驗時間為2020年9月至2021年12月。試驗地點位于云南省西南林業大學生命科學學院。
試驗菌株為編號是SYC4、SYC23和SYC63的3株重寄生菌,于2012年9月分離自患石楠葉銹病的球花石楠葉片上,并保存于4 ℃[7]。
1.2 試驗方法
1.2.1 枝孢菌的鑒定
對分離得到的3株重寄生菌采用PDA培養基[6]進行培養。通過常規形態學方法并結合分子生物學方法進行重寄生菌的種鑒定。通過查閱相關文獻進行形態學鑒定,主要是記錄菌株培養性狀、分生孢子的形態及大小等。分子鑒定參照隋國強等的方法[19],提取菌株DNA,于-20 ℃保存備用。以ITS5(5′-GGAAGTAAAAGTCGTAACAAG-3′)/ITS4(5′-TCCTCCGCTTATTGATATGC-3′)為引物擴增內轉錄間隔區基因;以EF-1-F(5′-CATCGAGAAGTTCGAGAAGG-3′)/EF-1-R(5′-TACTTGAAGGAACCCTTACC-3′)為引物擴增翻譯延伸因子1-α基因;以ACT-F(5′-ATGTGCAAGGCCGGTTTCGC-3′)/ACT-R(5′-TACGAGTCCTTCTGGCCCAT-3′)為引物擴增肌動蛋白基因[20-22]。擴增產物純化和測序由生工生物工程(上海)股份有限公司完成。
1.2.2 系統發育樹的構建
對測序所得的3個序列在NCBI數據庫中進行BLAST搜索,確定最可能的近緣類群。然后進行基因序列查找及多序列拼接,再查閱文獻下載已報道的近緣種基因序列片段,將基因序列數據集通過MAFFT(https://mafft.cbrc.jp/alignment/software/)網站進行比對,再利用BioEdit手工編輯并將聯合基因序列校正,以fasta格式的組合數據集在ClustalX中存為nexus格式。利用PAUP4.0b10軟件,輸入程序,以非加權最大簡約(MP)法構建系統發育樹[20-21]。最后結合形態觀察的菌落形狀、顏色和分生孢子形態特征等,對比Bensch等研究[23]中菌株形態特征,通過分子鑒定結合形態鑒定將3株重寄生菌鑒定到種。
1.2.3 轉錄組測序及分析
在前期研究中參照周航等的銹菌孢子壁誘導方法[24],采集西南林業大學樹木園內的石楠葉銹病病菌銹孢子,對重寄生效果較好的菌株SYC63進行誘導后提取菌絲體RNA,檢測合格的RNA用于文庫構建,利用Illumina平臺進行測序獲得轉錄組數據。將下機數據進行過濾得到整潔數據(Clean Data),與指定的參考基因組(枝孢菌SYC63:GCA_022457075.1)進行序列比對,得到映射數據(Mapped Data),進行插入片段長度檢驗、隨機性檢驗等文庫質量評估;根據基因在不同樣品中的表達量進行差異表達分析、差異表達基因功能注釋和功能富集等表達水平分析。
2 結果與分析
2.1 重寄生菌的鑒定
對分離得到的3株重寄生菌內轉錄間隔區、翻譯延伸因子(EF)-1和肌動蛋白(ACT)基因片段進行擴增并測序,利用單基因及多基因序列聯合構建系統發育樹。用內轉錄間隔區(ITS)序列構建系統發育樹結果(圖1)顯示:3株重寄生菌SYC4、SYC23和SYC63聚在同一個分支上,支持率為66%,其中SYC4和SYC23在分支上的距離相對較近,SYC63與兩者相距較遠,同時三者還與枝孢屬的已知物種C. anthropophilum、C. cladosporioides、角枝孢菌(C. angustisporum)、黑星病菌(C. cucumerinum)等聚在一支,不能夠說明其親緣關系,無法單以此系統發育樹來作為鑒定種的依據,還需進一步證明。
基于3個基因片段聯合構建的系統發育樹(圖2)顯示,SYC4與SYC23聚在同一個分支,支持率為97%,又與C. anthropophilum在同一個大支上,支持率為100%,表明SYC4與SYC23親緣關系較近,且兩者與C. anthropophilum的親緣關系較近;SYC63與C. cladosporioides的2個菌株(CPC 14021和CPC 14024)在同一個大分支上,支持率為97%,而C. cladosporioides的2個菌株又聚在同一支,支持率為96%,說明SYC63與 C. cladosporioides 的親緣關系較近。再根據菌株的菌落形態、分生孢子的大小、孢子顏色等形態特征進行對比,最終鑒定SYC4、SYC23為C. anthropophilum,SYC63為枝狀枝孢霉(C. cladosporioides)。
2.2 轉錄組分析
2.2.1 RNA提取與測序數據統計
分別對對照組(SYC63-C)和銹孢子壁處理組(SYC63-S)的6個菌絲體提取RNA進行質量檢測, 其D260 nm/D280 nm分別為1.76、1.77、1.90、2.19、2.03、2.07,說明所提取的RNA純度高,雜質污染較少,樣品質量能滿足建庫要求,可進行上機測序。利用Illumina平臺對本研究的6個樣品進行轉錄組測序,共獲得41.78 GB測序數據,各樣品總堿基數(Clean Reads)均達到 6.48 GB,Q30堿基百分比在94.18%及以上。分別將各樣品的Clean Reads與枝孢菌SYC3的基因組進行序列比對,發現比對效率為92.06%~95.93%(表1),說明測序數據可靠。
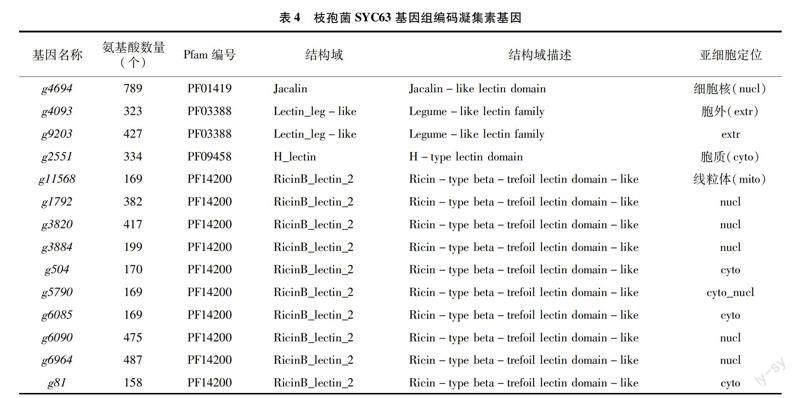
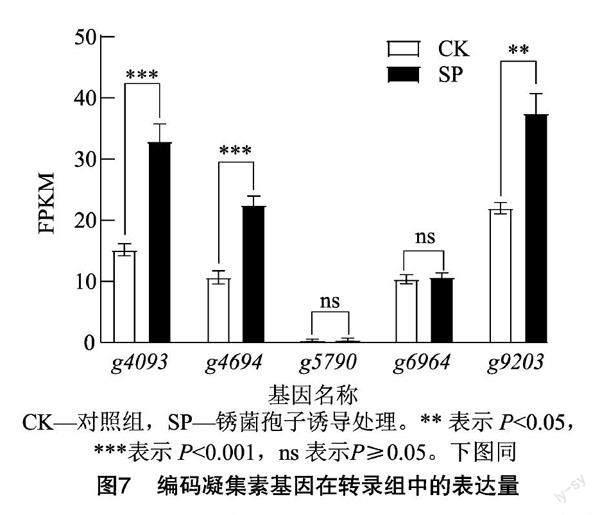
將參考基因組的12 327個基因比對到轉錄組表達量中,結果(表2)顯示,經銹孢子壁誘導處理后,有95.80%的基因表達,表達豐度分布在中高表達(10 2.2.2 Nr數據庫比對分析 通過Nr數據庫比對注釋,共有11 002個基因被注釋到,統計比對最多的前 9 個物種,其余劃分到其他(Other)類,物種分布如圖3所示,枝孢菌SYC63與南極枝孢菌(Rachicladosporium antarcticum)的相似基因最多,有2 130個基因,占19.36%,除其他物種外,所占物種相似性最高;其次與Rachicladosporium sp.有13%的相似基因。此外,與病原真菌Hortaea werneckii、Zasmidium cellare及Venturia nashicola等也有2%~8%[CM(20*2]的相似基因。 值得關注的是, 有41%的序列屬于其他物種,可能包含了枝孢菌SYC63與大多數物種不同的、自身特有的基因序列。 2.2.3 KOG數據庫比對分析 在KOG數據庫中枝孢菌SYC63共比對到4 948個基因,占總基因的38.4%,可被劃分到25類相應的功能中。由圖4可知,數量最多的功能類別是一般功能預測(general function prediction only),其次是翻譯后修飾,蛋白質轉換,伴侶(posttranslational modification,protein turnover,chaperones)441個基因、碳水化合物的運輸和代謝(carbohydrate transport and metabolism)370個基因及信號轉導機制(signal transduction mechanisms)342個基因。 2.2.4 GO分類 GO數據庫是一個結構化的標準生物學注釋系統,旨在建立基因及其產物知識的標準詞匯體系,適用于各個物種。對枝孢菌SYC63轉錄組進行GO功能注釋,共8 088個基因被注釋到。將基因的功能從細胞組分、分子功能、生物學過程等3個方面進行匯總統計后,結果如表3所示。枝孢菌SYC63編碼的基因主要富集在生物調節、細胞過程和代謝過程等生物過程;其次是在催化活性、結合和轉運活性等分子功能中;較少的基因被注釋到細胞組分中的細胞主體、胞內區和含有蛋白質的復合體。 2.2.5 差異基因篩選與功能注釋 將差異倍數(fold change)≥2且錯誤發現率(FDR)<0.01作為差異表達基因(DEGs)篩選標準,共得到3 196個DEGs,其中有1 674個上調基因、1 522個下調基因。對差異表達基因進行GO分類注釋,結果表明注釋數量最多的生物過程主要是代謝過程、細胞過程、單一生物體過程及定位;其次是催化活性、結合和轉運活性等分子功能組成;以及膜(membrane)和膜成分(membrane part)等細胞組分。這與枝孢菌SYC63的GO注釋結果在整體上是一致的,但經銹菌孢子壁誘導后細胞組分則是富集到細胞器、膜和膜成分等類別(圖5)。 進一步對1 674個上調基因的GO注釋進行分析,結果表明,在生物學過程中,主要富集在幾丁質生物合成過程(chitin biosynthetic process)、肌動蛋白絲的過程(actin filament-based process)及肌動蛋白絲的調節過程(regulation of actin filament-based process)等; 而細胞組分主要是膜,比如高爾基體相關囊泡(Golgi-associated vesicle)、囊泡外套(vesicle coat)、囊泡膜(vesicle membrane)等類型的基因富集;分子功能也顯示基因主要在幾丁質合成酶活性(chitin synthase activity)、鐵結合(ferric iron binding)及氧化還原酶活性(oxidoreductase activity)等的類別富集。 分析差異表達基因在某一通路上是否發生顯著差異即為差異表達基因的通路富集分析,選取顯著性Q值最小的前20個通路進行作圖,結果如圖6所示,可以看出,差異表達基因KEGG通路(pathway)數量最多的是碳水化合物(carbon metabolism),其次是色氨酸代謝(tryptophan metabolism)、纈氨酸、亮氨酸和異亮氨酸的降解(valine,leucine and isoleucine degradation)及氨基酸糖和核苷酸糖的代謝(amino sugar and nucleotide sugar metabolism)。表明經銹菌孢子壁誘導后差異基因在碳水化合物代謝途徑存在顯著差異,其可能是枝孢菌SYC63重寄生作用的一個重要組成部分。 2.2.6 重寄生相關的差異基因分析 凝集素是一種糖結合蛋白,可以特異地結合某種單糖或復雜的糖鏈結構,真菌凝集素是一類主要的凝集素,可以結合宿主的特定碳水化合物結構,起到識別和黏附的作用,或作為一種毒性因子在真菌對捕食者和寄生蟲的防御中發揮作用[25]。枝孢菌SYC63基因組編碼14個凝集素基因,包括10個蓖麻毒素B類的凝集素、 2個類似于伴刀豆蛋白的凝集素、1個甘露糖結合凝集素和1個H型凝集素(表4)。在經銹菌孢子誘導后,檢測到5個凝集素基因上調表達,其中類似于伴刀豆蛋白的凝集素(g4093、g9203)和甘露糖結合凝集素(g4694)的基因顯著上調,2個蓖麻毒素B類的凝集素(g5790、g6964)基因上調不顯著(圖7)。 其他重寄生或生物防治功能相關的基因,主要涉及到轉錄因子、細胞壁修復信號通路(MAPK singal pathway)及與抗生素代謝產物合成有關的細胞色素P450等。枝孢菌SYC63轉錄組數據中注釋到了87個P450基因,此外,還有71個基因在KEGG pathway中注釋為MAPK信號途徑(ko04011),在經銹孢子誘導后分別檢測到22及15個上調表達的差異基因,大部分基因都表現出極顯著(P<0.000 1)上調(圖8)。 3 討論與結論 枝孢菌具內生、人類致病、植物致病、腐生營養和極端環境生長等多種生態適應性[10]。已知的大多數枝孢菌物種是與植物相關的,常在植物葉片上產生危害且形成病斑。利用重寄生菌專性寄生而減少寄主植物受到的傷害特性,防治植物病害是生物防治的新措施[11,26]。近期的研究也表明,枝孢菌分泌的次生代謝產物在提高植物適應新生境能力,免受生物和非生物脅迫方面具有保護作用,因而作為植物生物刺激劑在農業應用中具有指導意義[27]。 將分子生物學的方法用于枝孢菌的分類鑒定,利用多基因復合序列構建系統發育樹并結合形態學,解決了形態特征分類上的難題。目前,枝孢屬真菌的物種鑒定主要基于3種遺傳標記,即rDNA的內部轉錄間隔區、肌動蛋白和翻譯延伸因子(EF-1α)基因的部分片段,前者不能提供良好的物種分辨率,后兩者卻表現出物種間高度的差異[28]。Bensch等利用三者組合對三大復合體中的其他類群進行了分子系統發育研究,來解釋枝孢屬的多樣性和進化趨勢[29]。Iturrieta-González等也利用此系統鑒定了不同環境來源中的枝孢菌,并報道其中發現的新物種,擴大了枝孢菌物種資源[30-31]。此外,也有學者用ITS和核糖體小亞基(SSU)編碼SSU序列鑒定了香蕉煤污病病原菌為枝狀枝孢霉[32],為枝孢屬的分子鑒定提供了可供選擇的多個基因片段。 重寄生是微生物微觀世界中一個重要現象,了解其發生機制可以有效提高對植物病原體的生物防治。在對廣譜生防真菌木霉的重寄生機制研究中發現,其主要是通過分泌一系列胞壁降解酶如葡聚糖酶、幾丁質酶和殼聚糖等參與重寄生作用[33]。本研究對重寄生枝孢菌SYC63利用銹菌孢子壁誘導后進行轉錄組測序,分析發現,其在KOG功能中有370個基因注釋到碳水化合物的轉運與代謝,且受銹菌孢子壁的誘導后差異基因的KEGG通路也顯著富集到該方面,說明該菌有較好的碳水化合物代謝能力,其可能是重寄生作用中重要的一部分。 研究表明,木霉的重寄生過程是復雜的,除胞壁降解酶外,次級代謝物、轉運蛋白、熱激蛋白及效應因子等也參與了重寄生過程[34]。凝集素具有獨特的識別和可逆結合特定碳水化合物配體的能力,無需任何化學修飾,這一特征使凝集素有別于其他碳水化合物結合蛋白和酶[35]。通過對輪枝菌凝集素(SRL)及其推定的內源性受體的研究結果表明,細胞壁相關的凝集素在真菌發育過程中發揮著重要的生物學功能[36]。據報道,一種具有生物活性的向日葵甘露糖結合凝集素(Helja)參與了植物對真菌的識別和防御,其與真菌孢子表面的相互作用穿透質膜,也可內化到細胞內誘導氧化應激,最終導致細胞死亡。Del Rio等提出它最初是與真菌細胞壁碳水化合物相互作用,并進一步內化,通過被定位到不同的細胞器,從而激活與細胞死亡相關的信號通路的抗菌機制[35]。從Parkia platycephala種子中分離純化得到一個凝集素PPL2,能水解幾丁質中連接 2-乙酰氨基-2-脫氧-β-D-吡喃葡萄糖單元的β-1,4糖苷鍵,通過N末端測序、基因克隆全長及X射線結晶學建立三維結構,結果表明,該凝集素與GH18家族的內切幾丁質酶同源,具有 N-乙酰氨基葡萄糖結合和幾丁質水解酶活性[37]。在本研究中,重寄生枝孢菌SCY63基因組中有14個凝集素編碼基因,在銹菌孢子誘導后,檢測到5個基因上調表達,其中1個甘露糖結合凝集素顯著上調表達。推測在重寄生過程中其可能與真菌細胞壁表面的碳水化合物結合產生間接的影響,從而引起細胞損傷,造成寄主死亡。 MAPK信號通路對細胞的糖基化狀態敏感,可調控胞壁蛋白的表達并修復極端環境下細胞壁的損傷,保持細胞壁完整,是脅迫環境下菌絲體正常生長的必要信號途徑,并在生防菌對病原菌的攻擊以及菌絲形成中起著重要作用[38]。幾丁質是許多真菌細胞壁的主要結構成分,它是由尿苷二磷酸 N-乙酰氨基葡萄糖(UDP-GlcNAc)經幾丁質合成酶生物合成的,真菌中的細胞壁應激反應通常可能導致幾丁質生物合成途徑的激活[39]。細胞色素P450可催化某些具有重要生理功能的內源性物質的生物合成,并在次級代謝產物的修飾中起重要作用,其含量高表明可能存在更多類型的次級代謝產物[40]。本研究中,枝孢菌SYC63在經銹菌孢子誘導后差異基因中上調表達數量明顯多于下調表達基因數量,進一步分析顯示上調表達的基因功能主要富集在質膜成分和幾丁質合成酶活性等功能,同時MAPK信號通路基因也顯著上調表達。推測可能是枝孢菌SYC63在接觸病原菌后啟動應激反應,調動重寄生功能相關基因或存在不利環境相關基因上調表達,而MAPK信號和幾丁質合成酶參與合成的幾丁質都保持了細胞壁的完整性,從而有利于寄生菌成功進入寄主,完成利于自身的侵染過程,即重寄生過程。 本研究利用形態學觀察結合分子鑒定,構建系統發育樹,最終將SYC4、SYC23鑒定為C. anthropophilum,將SYC63鑒定為C. cladosporioide,明確了菌株分類地位;對菌株SYC63的轉錄組測序數據進行了生物信息學分析,發現與重寄生相關的基因受銹菌孢子壁誘導而顯著上調表達,推測其可能參與了菌株SYC63重寄生的過程,為后續深入研究該菌的重寄生機制提供了理論基礎與基因數據資源。 參考文獻: [1]黃麗丹. 茶藨生柱銹重寄生菌(Pestalotiopsis sp.)的生物學特性及毒素研究[D]. 昆明:西南林學院,2006. [2]李 利. 白粉菌重寄生真菌的分離鑒定及生物學特性研究[D]. 楊凌:西北農林科技大學,2016. [3]袁秀英,白玉明,袁登勝. 重寄生菌對花棒銹病的抑制作用[J]. 中國沙漠,2006,26(6):1020-1023. [4]鄧 勛,張素華,宋小雙,等. 樟子松皰銹病重寄生菌的分離鑒定[J]. 中國森林病蟲,2012,31(2):4-6,10. [5]廖詠梅,熊 英,羅蕩平,等. 小駁骨銹病的重寄生現象及重寄生菌鑒定(英文)[J]. 中國生物防治學報,2008,24(增刊1):85-89. [6]李 靖,劉風路,陳玉惠. 茶麃生柱銹菌重寄生擬盤多毛孢產毒培養條件的篩選[J]. 江西農業大學學報,2017,39(2):395-401. [7]李夢婕,謝 津,李向楠,等. 石楠銹孢銹菌重寄生現象及其重寄生菌的種類鑒定[J]. 東北林業大學學報,2016,44(5):92-96. [8]蔡 燦,伍建榕. 球花石楠銹病病原物的初步研究[J]. 北方園藝,2008(1):208-210. [9]莊劍云,魏淑霞. 中國無性型銹菌新資料 Ⅰ. 春孢子階段的幾個式樣種[J]. 菌物學報,2016,35(12):1468-1474. [10]Ma R,Chen Q,Fan Y L,et al. Six new soil-inhabiting Cladosporium species from plateaus in China[J]. Mycologia,2017,109(2):244-260. [11]楊艷紅,陳玉惠. 植物病原菌重寄生菌作用機理的研究進展[J]. 西南林學院學報,2004,24(2):70-75. [12]尤佳琪,吳明德,李國慶. 木霉在植物病害生物防治中的應用及作用機制[J]. 中國生物防治學報,2019,35(6):966-976. [13]童曉茹,王學翠,溫學森,等. 植物葉片真菌病害生物防治的研究進展[J]. 山東科學,2008,21(1):41-46. [14]Velculescu V E,Zhang L,Zhou W,et al. Characterization of the yeast transcriptome[J]. Cell,1997,88(2):243-251. [15]范海娟. 哈茨木霉ACCC30371菌株轉錄組構建及生防相關基因功能研究[D]. 哈爾濱:東北林業大學,2013. [16]Reithner B,Ibarra-Laclette E,Mach R L,et al. Identification of mycoparasitism-related genes in Trichoderma atroviride[J]. Applied and Environmental Microbiology,2011,77(13):4361-4370. [17]趙桂華,管 斌,劉國華. 林木銹病生物防治的研究進展[J]. 江蘇農業科學,2010,38(4):115-116,192. [18]梅 超,范世昌,艾小滿,等. 一株重寄生枝孢菌的基因組測序及重寄生機制分析[J]. 微生物學通報,2022,49(8):3310-3323. [19]隋國強,張登云,孔 磊,等. 石楠銹孢銹菌重寄生菌的鑒定及產毒培養基篩選[J]. 生物技術通報,2020,36(7):104-111. [20]呂靖雯,劉 蕊,李國華,等. 柚果面枝孢菌斑點病病原鑒定[J]. 浙江大學學報(農業與生命科學版),2018,44(6):687-694. [21]Tibpromma S,Mortimer P E,Karunarathna S C,et al. Morphology and multi-gene phylogeny reveal Pestalotiopsis pinicola sp.nov.and a new host record of Cladosporium anthropophilum from edible pine (Pinus armandii) seeds in Yunnan Province,China[J]. Pathogens (Basel,Switzerland),2019,8(4):285. [22]Carbone I,Kohn L M. A method for designing primer sets for speciation studies in filamentous ascomycetes[J]. Mycologia,1999,91(3):553-556. [23]Bensch K,Braun U,Groenewald J Z,et al. The genus Cladosporium[J]. Studies in Mycology,2012,72:1-401. [24]周 航,鮑澤然,施玉玲,等. 4種木霉對松皰銹病菌細胞壁的破壞作用[J]. 西南林業大學學報(自然科學),2017,37(4):120-125. [25]Liu M J,Cheng X W,Wang J C,et al. Structural insights into the fungi-nematodes interaction mediated by fucose-specific lectin AofleA from Arthrobotrys oligospora[J]. International Journal of Biological Macromolecules,2020,164:783-793. [26]陳廣艷.國內研究植物銹菌重寄生菌的現狀[J]. 安徽農業科學,2006,34(8):1531-1532. [27]Rǎut I,Cǎlin M,Caprǎ L,et al. Cladosporium sp. Isolate as fungal plant growth promoting agent[J]. Agronomy,2021,11(2):392. [28]Torres D E,Rojas-Martínez R I,Zavaleta-Mejía E,et al. Cladosporium cladosporioides and Cladosporium pseudocladosporioides as potential new fungal antagonists of Puccinia horiana Henn.,the causal agent of chrysanthemum white rust[J]. PLoS One,2017,12(1):e0170782. [29]Bensch K,Groenewald J Z,Meijer M,et al. Cladosporium species in indoor environments[J]. Studies in Mycology,2018,89:177-301. [30]Iturrieta-González I,García D,Gené J. Novel species of Cladosporium from environmental sources in Spain[J]. MycoKeys,2021,77:1-25. [31]馬 銳. 土壤枝孢菌的分離鑒定及極端木聚糖酶的功能驗證[D]. 北京:中國農業大學,2017. [32]楊 迪,杜嬋娟,葉云峰,等. 廣西香蕉煤污病病原菌的分離鑒定及其生物學特性[J]. 植物病理學報,2021,51(4):507-514. [33]Naher L,Yusuf U K,Habib S,et al. Mycoparasitism activity of Trichoderma harzianum associated with chitinase expression against Ganoderma boninense[J]. Pakistan Journal of Botany,2018,50(3):1241-1245. [34]趙會長. 盾殼霉基因組學及其重寄生機制研究[D]. 武漢:華中農業大學,2020. [35]Del Rio M,de la Canal L,Pinedo M,et al. Internalization of a sunflower mannose-binding lectin into phytopathogenic fungal cells induces cytotoxicity[J]. Journal of Plant Physiology,2018,221:22-31. [36]Swamy B M,Bhat A G,Hegde G V,et al. Immunolocalization and functional role of Sclerotium rolfsii lectin in development of fungus by interaction with its endogenous receptor[J]. Glycobiology,2004,14(11):951-957. [37]Cavada B S,Moreno F B B,da Rocha B A M,et al. cDNA cloning and 1.75 ?crystal structure determination of PPL2,an endochitinase and N-acetylglucosamine-binding hemagglutinin from Parkia platycephala seeds[J]. The FEBS Journal,2006,273(17):3962-3974. [38]劉 青.哈茨木霉菌拮抗辣椒疫霉的轉錄組學研究[D]. 貴陽:貴州大學,2019. [39]Obi K,Uda J I,Iwase K,et al. Novel nikkomycin analogues:inhibitors of the fungal cell wall biosynthesis enzyme chitin synthase[J]. Bioorganic & Medicinal Chemistry Letters,2000,10(13):1451-1454. [40]Cˇrenar B,Petricˇ . Cytochrome P450 enzymes in the fungal kingdom[J]. Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics,2011,1814(1):29-35. 收稿日期:2022-03-09 基金項目:云南省農業基礎研究聯合專項面上項目[編號:2017FG001(-043)];中央引領地方科技發展專項資金(編號:219001);云南省教育廳科學研究基金(編號:2021Y270)。 作者簡介:梅 超(1996—),女,云南昭通人,碩士研究生,主要從事資源微生物的開發與利用研究。E-mail:1498789618@qq.com。 通信作者:李 靖,博士,副教授,碩士生導師,主要從事微生物生理生化研究。E-mail:lijingcas@163.com。

