茶樹NF-Y基因家族鑒定及非生物脅迫下的表達分析
許芳芳 劉文祥 鄭偉 孫耀清 王輝
摘要:NF-Y(nuclear factor-Y,NF-Y)通常是以NF-YA (CBF-B/HAP2)、NF-YB (CBF-A/HAP3)和NF-YC (CBF-C/HAP5) 3種亞基構成異源三聚體的形式調控下游基因的表達,并在生物與非生物脅迫耐受性等方面起著重要作用。本研究在茶樹基因組中鑒定分類了茶樹NF-Y基因家族成員,為后續的功能分析研究做準備。在研究中鑒定出45個NF-Y轉錄因子亞基(10個NF-YA,20個NF-YB,15個NF-YC)。染色體定位和同義分析表明,茶樹NF-Y基因分布在14條染色體上,9對基因具有大片段復制,4對基因串聯復制,片段復制是家族成員擴張的主要方式。通過序列分析,所有的NF-Y基因具有高度的結構保守性,大多數NF-Y基因有2個以上的內含子。通過啟動子順式元件分析發現,大部分基因含有激素和應激反應元件。轉錄組分析顯示,一部分基因在干旱情況下出現不同程度的轉錄組豐度增加,而在鹽處理后基本沒有變化或出現不同程度的豐度下降。隨后的qRT-PCR結果顯示,在選定的4個基因中,CsNF-YA6、CsNF-YB4在20%PEG處理下出現不同幅度的上調,200 mmol/L 鹽處理下,CsNF-YA6、CsNF-YB4、CsNF-YC5在鹽處理后2 d出現輕微上調。結合qRT-PCR結果分析表明,在候選基因中存在介導茶樹響應干旱脅迫與鹽脅迫途徑的基因。綜上所述,茶樹NF-Y基因在茶樹非生物脅迫防御等多方面響應并發揮作用,本研究也為揭示相關NF-Y基因在茶樹干旱脅迫與鹽脅迫下的確切作用奠定了基礎。
關鍵詞:茶樹;NF-Y家族;干旱脅迫;全基因組分析;基因表達
中圖分類號:S571.101文獻標志碼:A
文章編號:1002-1302(2023)05-0081-13
干旱是限制全球農作物產量的主要制約因素之一。干旱脅迫等非生物脅迫不僅導致植物細胞損傷、破壞細胞結構并降低酶的活性等,更重要的是會對植物生長發育造成影響,導致作物產量下降[1-2]。研究還表明,茶葉的超氧化物歧化酶活性在短期或輕度干旱脅迫下增加,但在長期或嚴重干旱脅迫下降低,茶樹[Camellia sinensis (L.) O. Ktze.]衰老會更快。干旱脅迫不僅會影響茶樹代謝活動以及生長發育,同時干旱還會導致茶樹芽葉數量、長度以及百芽質量等方面明顯下降,造成茶產量下降;并且導致茶葉中主導茶葉品質的總游離氨基酸、咖啡堿和水浸出物等品質成分降低。近年來隨著研究深入,NF-Y基因家族也被發現響應干旱處理,在干旱處理下,過表達BnNF-YA3的擬南芥在種子萌發、根生長上發揮作用[3];NF-Y基因作為參與非生物脅迫的基因在調節植物抗逆性上的功能逐漸被挖掘,這在其他物種中也已經被證實,NF-YB 基因與NF-YA、NF-YC基因之間具有協同作用并介導干旱等非生物脅迫。
核因子NF-Y是普遍分布于真核生物中的一類轉錄因子,又叫亞鐵血紅素激活蛋白(heme-activator proteins,簡稱HAPs)或CCAAT結合因子(CCAAT-binding factor,簡稱CBF),NF-Y蛋白是轉錄因子家族,普遍存在于真核生物中,每個基因家族不僅代表其蛋白結構具有一定的相似性,更是代表基因之間具有功能上的相似性。NF-Y基因家族屬于CCAAT結合因子家族,最初定義為酵母蛋白中的血紅素激活蛋白(HAP)家族。NF-Y轉錄因子因含有3種不同亞基被分為3個部分:NF-YA (HAP2/CBF-A)、NF-YB (HAP3/CBF-B)、NF-YC (HAP5/CBF-C)。由于近年來NF-Y基因在干旱脅迫下功能逐漸被挖掘,在植物中,已經有多種植物的NF-Y家族基因被鑒定出來,在擬南芥中一共鑒定出36個(10個NF-YA,13個NF-YB、13個NF-YC亞基)NF-Y基因[4],同時在擬南芥的轉基因研究中發現擬南芥大多數NF-YA基因在干旱脅迫下表達上調[5]。在楊樹中,共鑒定出52個NF-Y基因,并通過生信分析預測候選基因PtNF-YA3在抗逆性上可能有作用[6]。目前已有研究證實NF-YA相關基因在非生物脅迫中發揮作用,過量表達小麥TaNF-YA10-1的擬南芥植株在鹽脅迫下顯著上調[7],AtNF-YA5的過度表達也可以提高轉基因植物的耐旱性,減少葉片失水[8];此外,OsNF-YA7還被證實有可能以不依賴脫落酸(ABA)的方式增強水稻的耐旱性[9]。在NF-YB相關基因的研究中發現在狗尾草中SiNF-YB8在提高大豆抗旱性方面發揮了關鍵作用,同樣的在TaNF-YB3的研究中發現TaNF-YB3參與調節ABA信號通路,并呈現出改善植物抗旱性的作用[10]。在NF-YC相關基因的研究中發現在百慕大草中Cdt-NF-YC1的過表達水稻植株在干旱和鹽脅迫下增強了植株的耐受性,并對ABA的敏感性增加,擬南芥ABF3和ABF4與NF-YC一起通過在干旱條件下誘導SOC1轉錄來促進開花[11]。
茶樹原產于東亞,在我國云南省、四川省等地分布廣泛。茶因含有多酚類化合物、咖啡堿等多種生物活性物質以及抗氧化、延緩衰老、治療疾病等多種功效在某某領域廣泛應用,不僅營養豐富而且具有極高的經濟價值。盡管對于NF-Y基因的研究已經很多,茶樹全基因組重組序列的公布為茶樹NF-Y基因家族的鑒定與挖掘提供了便利,但是對于茶樹NF-Y基因家族的分析由于基因組未完全組裝存在著不確定性。本研究依據生物信息學方法從茶樹基因組中鑒定并分類CsNF-Y家族成員,并確認家族基因染色體位置,在分析基因重復、系統發育關系、基因結構和保守域以及順式元件的基礎上闡述CsNF-Y基因的生物學功能。通過 qRT-PCR 分析CsNF-Y基因的表達模式,分析它們在干旱與干旱ABA脅迫下的作用。以期為后續研究提供信息支撐。
1 材料與方法
1.1 材料處理
試驗材料來源于信陽農林學院教學實踐茶園,選取生長狀態良好、長勢基本一致的二年生福鼎大白茶樹移栽花盆中(丹麥泥炭土),設置人工氣候室生長條件為溫度(22±2) ℃,濕度65%,以未處理的植株作為對照(CK),進行模擬干旱(20% PEG-6000)、高鹽(200 mmol/L NaCl)處理,200 mmol/L 氯化鈉溶液和20% PEG-6000溶液分別澆灌植物(500 mL溶液),處理(0、24、48、72 h)后使用1芽3葉(混樣)的方法采樣。每個處理保持3個生物學重復,取樣后液氮速凍后保存于-80 ℃備用。
1.2 茶樹NF-Y基因家族鑒定
在擬南芥信息資源庫(TAIR;http://www.arabidopsis.org/)下載36個已經報道的擬南芥 NF-Y 蛋白序列備用,茶樹候選基因是通過在Pfam蛋白家族數據上下載隱馬爾可夫模型(PF02045和PF00808),以E-value<1.0e-10對茶樹基因組進行檢索。基因組與蛋白組數據從TPIA數據庫(http://tpia.teaplant.org/)下載。為了確認結果無誤篩掉非基因家族基因,將所得的基因蛋白序列上傳至PfamScan (https://www.ebi.ac.uk/Tools/pfa/pfamscan/)與SMART (http://smart.embl-heidelberg.de/)上,以E-value<1.0e-10進行檢索,通過檢索結果查看基因是否含有NF-Y結構域,然后做進一步篩選。此外,Siefer對NF-Y 3個亞族結構的描述如下:NF-YA保守結構域序列:f-V-N-A-K-Q-Y-h-x-I-l-r-R-R-q-x-R-A-k-l-E-a-x-x-K-l-i-k-x-R-K-P-Y-l-H-E-S-R-H-x-H-A-x-r-R-p-R-G-s-G-G-R-E,NF-YB保守結構域序列:r-e-q-D-r-x-L-P-I-A-N-v-x-R-I-M-K-x-x-L-P-x-x-n-x-k-i-s-k-D-A-K-e-t-x-Q-E-C-v-s-E-F-I-S-F-v-T-s-E-A-s-d-k-C-q-x-E-k-R-K-T-I-n-g-d-D-x-L-w-A-m-x-t-L-G-F-x-d-Y-x-e-p-L-x-k-x-Y-x-L-x-k-y-R-e-x-x-e-g-e,NF-YC保守結構域序列:l-P-l-a-R-I-K-K-I-M-K-x-D-e-D-V-x-m-I-s-a-e-A-P-x-l-f-a-K-A-c-E-M-F-I-x-e-L-T-x-R-s-W-x-h-t-e-e-n-k-R-r-T-l-q-k-x-d-i-a-a-A-v-x-r-x-d-x-x-f-D-F-L-x-x-D-x-V-P,大寫字母是完全保守的位點,小寫字母x代表非保守位點,其他均為相對保守的位點,通過保守結構域序列比對進一步篩選。
1.3 序列比對和系統發育分析
首先對CsNF-Y使用DNAMAN6.0進行蛋白序列比對并對保守結構域(>75%)進行標記,其次將茶樹、擬南芥[4]的NF-Y基因一起進行多重序列比對(Clustal W),再構建進化樹進行進化分析。使用MEGA 6.0軟件以ML(maximum likelihood)法構建并進行bootstrap測試(n=1 000),進化樹使用Evolview (https://evolgenius.info//evolview-v2)在線工具進行美化。
1.4 茶樹NF-Y基序與啟動子順勢作用元件分析
使用MEME (https://meme-suite.org/meme/tools/meme)對NF-Y基因的保守基序進行鑒定,設置參數:基序數量12,每個基序出現0或者1次,最佳基序寬度范圍為6~50個氨基酸殘基,最大錯配15個。使用TBtools將CsNF-Y基因上游2.0 kb啟動子序列提取并提交于PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)鑒定順勢作用元件。結果作圖使用TBtools軟件[12]。
1.5 染色體定位與復制事件
將鑒定基因通過提供的信息進行過濾整理,使用TBtools將鑒定的CsNF-Y基因可視化定位在茶樹染色體上,使用TBtools V1.098669進行同義分析,同時利用DNASP6.0軟件對重復復制事件的Ka、Ks、Ka/Ks[13]值進行計算,進一步分析重復復制發生的時間。
1.6 RNA提取,cDNA文庫獲取
根據十六烷基三甲基溴化銨(CTAB)方法從葉片組織中提取總RNA。每個樣品為0.5 g,進行3個生物學重復。使用 NanoDrop ND-1000 (Thermo Fisher Scientific,沃爾瑟姆,馬薩諸塞州,美國)測定RNA濃度,并在1%瓊脂糖凝膠上測定質量。TBtools用于生成熱圖。RNA-seq數據可從NCBI-SRA獲得(干旱與鹽脅迫:ERP012919),首先使用IlluminaRNA-seq軟件將原始數據去除低質量reads,并使用HISAT2與茶樹基因組[C. sinensis var. sinensis ‘Shuchazao(CSS-SCZ)]對齊。采用KALLISTO軟件首先對基因組轉錄本建立索引,將整理好的轉錄組數據比對建立好的索引計數獲得TPM (每千個堿基的轉錄每百萬映射讀取的Transcripts)轉錄組表達數據。根據TPM表達量制作熱圖,熱圖使用TBtools 生成。
1.7 實時熒光定量分析
對試驗處理不同節點樣品cDNA使用實時熒光定量PCR用于分析基因表達。首先使用Primer 5.0軟件設計基因引物,引物長度150~250 bp。使用實時熒光定量分析,以1 μL cDNA模板,10 μL SYBR Premix ExTaq (TaKaRa,日本),2 μL特異性引物,7 μL ddH2O為反應體系;PCR熱循環參數如下:95 ℃ 5 min;95 ℃ 20 s,60 ℃ 20 s,72 ℃ 10 s,45個循環。CsPTB-RT是茶樹肌動蛋白的特異性引物,用于內部對照,使基因表達正常化.基因的相對表達量采用2-ΔΔCT法進行分析,每個樣品進行3次生物重復。
1.8 數據分析
使用SPSS 22.0對所有數據進行統計方差分析并進行學生t檢驗,使用GraphPad Prism繪圖。
2 結果與分析
2.1 茶樹NF-Y基因家族鑒定
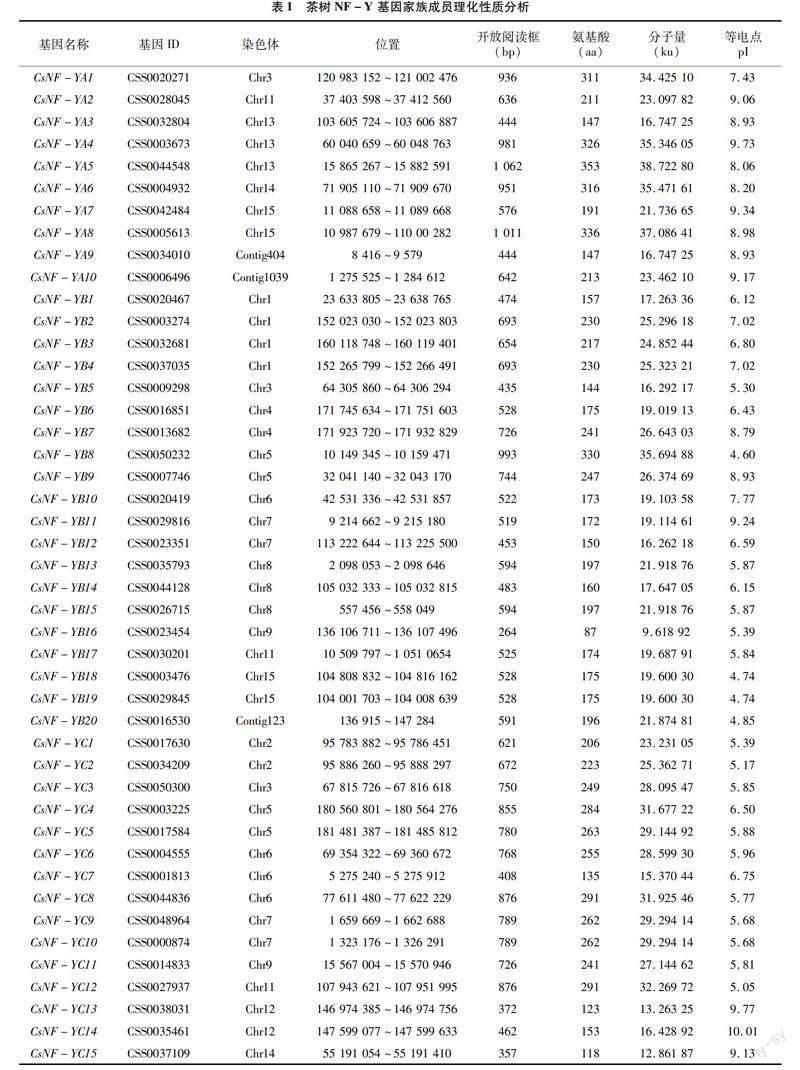
在茶樹CSS-SCZ基因組中共鑒定出45個 NF-Y 基因(10個NF-YA、20個NF-YB、15個NF-YC)。為了區分這些基因,根據基因的亞族與染色體位置進行分類命名:CsNF-YA1~CsNF-YA10、CsNF-YB1~CsNF-YB20、CsNF-YC1~CsNF-YC15(表1)。所有基因的基因名稱、基因ID、染色體位置、開放閱讀框(open reading frame,ORF)、氨基酸(amino acids)、蛋白質分子質量(molecular weight )、等電點(isoelectric point)見表1。通過序列分析,45個CsNF-Ys的氨基酸長度從87 aa (CsNF-YB16)到353 aa(CsNF-YA5)不等,CsNF-Y 3個亞家族中,CsNF-YA長度(范圍為147~353 aa,平均長度255.1 aa)最長,其次是 CsNF-YC 長度(范圍為118~291 aa,平均長度223.73 aa),CsNF-YB 長度(范圍為87~330 aa,平均長度191.35 aa)最短,氨基酸長度具有明顯的差異。開放閱讀框長度為264 bp (CsNF-YB16)~1 062 bp (CsNF-YA5),預測的分子量為9.62 ku (CsNF-YB16)~38.72 ku(CsNF-YA5),預測理論等電點為4.60(CsNF-YB8)~10.01(CsNF-YC14)。
2.2 2種植物 NF-Y 基因的系統發育分析
本研究根據其氨基酸序列,結合45個茶樹 NF-Y(10個NF-YA,20個NF-YB,15個 NF-YC),36個擬南芥NF-Y基因的氨基酸序列構建了進化樹(圖1)。通過成員數量比較發現,相比擬南芥NF-YB、NF-YC分別擴展了7、2個基因,NF-YA數量一致。進化分析發現,茶樹與擬南芥的NF-Y蛋白序列同源性較高,結果表明,相似基因可能在功能上具有相似性。
2.3 CsNF-Y基因的保守基序和基因結構分析
保守基序分析顯示,茶樹NF-Y基因家族保守基序數量為12個(圖2),基序長度范圍為15~50 aa,基因保守基序數量范圍為2~6個,大多數基因都含有2~6個基序,有趣的是NF-YAs特異性的含有基序(3)和(8),NF-YBs與NF-YCs特異性的都含有基序(1),除了NF-YB16沒有基序(2),NF-YBs、NF-YCs其他基因都含有基序(2),同時NF-YCs特異性含有基序(6)。因此,茶樹 NF-Y 基因在進化發育過程中是具有很大的差異性的。本研究對茶樹NF-Y基因外顯子-內含子進行結構分析(圖2),分析發現,14個(31.1%)無內含子,6個(13.3%)只有1個內含子,25個(55.6%)為2~6個內含子。因此,大多數基因都有內含子,基因結構相對復雜。
2.4 染色體定位,基因復制與進化分析
染色體定位顯示45個基因分布在14條染色體上(圖3),大部分染色體上分布2~4個基因,總體來看,基因分布比較均勻,每條染色體上均勻分布了2~4個CsNF-Ys。本研究對茶樹NF-Y基因的復制事件進行分析(圖4),發現在CsNF-Y基因中,9對基因對為片段復制,4對基因對為串聯復制。片段復制事件在染色體分布方面在Chr04上最多,其次是Chr03,而在Chr10上沒有復制事件產生。對復制事件發生時間進行分析發現,在剔除CsNF-YA3/CsNF-YA9和CsNF-YB15/CsNF-YB13 2對發生同義突變位點較多、進化距離較遠的基因對數據后得到11對復制事件的信息,有趣的是所有基因對Ka/Ks比值小于1,進化時間范圍為5.58×106~93.80×106年(表2)。
2.5 茶樹CsNF-Y基因的保守結構域
本研究使用DNAMAN 6.0對CsNF-YAs、CsNF-YBs、CsNF-YCs的蛋白序列進行多重比對。結果表明,3個亞科都有保守結構域,在CsNF-YAs中,由52個氨基酸組成的與擬南芥NF-YA保守結構域高度相似的氨基酸結構(圖5-A);與CsNF-YAs一樣,經過多重序列比對,CsNF-YBs與 CsNF-YCs 分別由84和75個氨基酸組成其保守結構域(圖5-B、圖5-C),并且結構域與擬南芥 NF-YB 和NF-YC亞家族保守結構域高度相似,這與Siefers對NF-Y3個亞族結構的描述[4]一致。但是,在CsNF-Y基因中個別基因保守氨基酸序列存在缺失和改變,說明基因在進化過程中功能出現分化。
2.6 茶樹CsNF-Y基因啟動子順式作用元件
通過順式作用元件分析發現,基因家族成員相關順式作用元件共有3類,分別是脅迫相關(防御和壓力反應、厭氧誘導、缺氧特異性誘導、干旱誘導、傷口反應元件、低溫);發育相關(胚乳表達、種子特異性調控、分生組織表達、玉米蛋白代謝調節、晝夜節律控制、柵欄葉肉細胞、細胞周期調控、胚乳特異性陰性表達、順式作用調控元件根特異性、光敏色素下調表達);激素相關(赤霉素反應、脫落酸響應、生長素反應、MeJA響應、水楊酸響應)的順勢作用元件(圖6-a)。在對非生物脅迫相關順式作用元件進行分析發現,有22個基因含有1個或多個干旱響應順式作用元件MBS,3個基因含有GC-motif,35個基因含有脫落酸響應順式作用元件ABRE(圖6-b),結合進化樹分析發現,3個亞家族成員中除了CsNF-YB9沒有ARE抗氧化順式作用元件,其余均有ARE順式作用元件,比較突出的是NF-YB亞家族90%成員含有ABRE順式作用元件,遠高于NF-YA亞家族(60%)、NF-YC亞家族(73%)。
2.7 茶樹CsNF-Y基因脅迫下的表達分析
本研究從NCBI-SRA獲得RNA-seq數據(干旱與鹽脅迫:ERP012919),根據轉錄組數據分析得出的TPM表達量篩選出NF-Y基因的表達量數據構建45個基因的熱圖,以觀察這些基因的表達水平(圖7)。結合熱圖與啟動子分析,本研究發現5個完全無表達基因(CsNF-YB3、CsNF-YB11、CsNF-YC13、CsNF-YC14、CsNF-YC15),表達的40個基因中有22個基因含有不同數量的MBS順勢作用元件,8個基因干旱脅迫下表達量升高,5個基因不表達,其余基因出現不同程度表達量降低。結合進化樹分類分析發現,在鹽處理下,相對于對照處理3個亞家族大部分基因轉錄組豐度變化差異很小,沒有明顯的上升出現,大部分出現降低或維持同一水平,部分基因如NF-YA6與NF-YC5明顯響應鹽脅迫并負反饋;對于干旱脅迫NF-YB13與NF-YB4、NF-YC7等基因表達出現顯著差異。
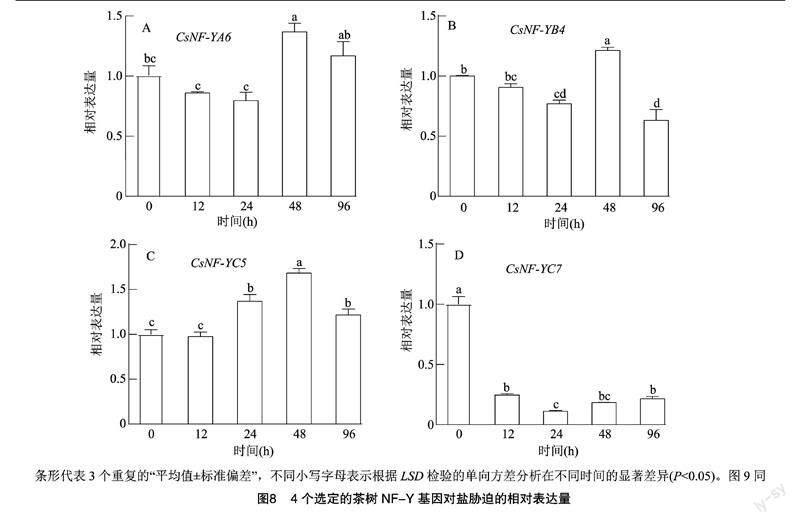
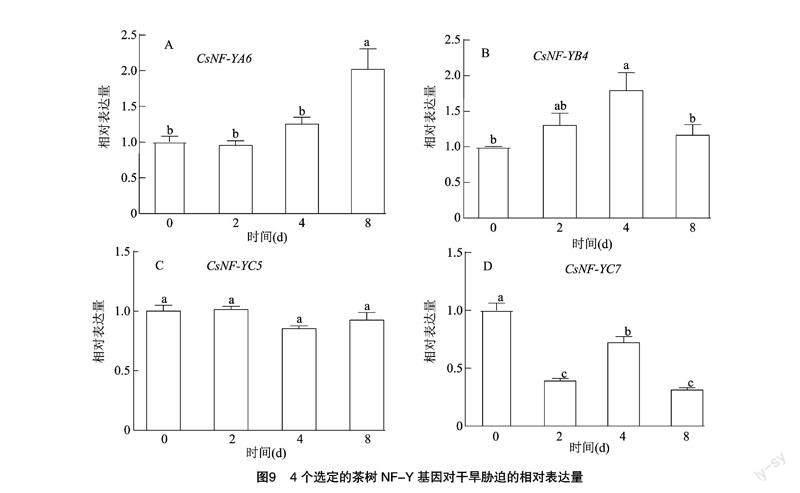
挑選了4個差異表達基因, 通過qRT-PCR分析進一步驗證基因在干旱與鹽脅迫下的功能(圖8、圖9),結果發現4個選定的基因(CsNF-YA6、CsNF-YB4、CsNF-YC5、CsNF-YC7)中除CsNF-YC7出現負調控,其他3個基因在鹽處理的第2天(48 h)均出現不同程度的顯著上調;在進行模擬干旱處理后,CsNF-YA6、CsNF-YB4在處理后4 d均出現明顯上調(圖9),CsNF-YC5無明顯差異,CsNF-YC7明顯下調并負反饋。
3 討論
NF-Y基因已經在很多物種中被證實響應干旱脅迫,目前已經在棉花[14]、柑橘[15]、大麥[16]、小麥[10]、桃[17]中鑒定出NF-Y基因并響應干旱脅迫。Mantovani 對NF-Y基因家族的特性做了描述,其中包括相對保守結構域、亞基分類以及相應的生物學功能[18],這為接下來的分析提供了便利。在茶樹中共鑒定出45個NF-Y成員,擬南芥(36個)、柑橘(22個)、西瓜(19個)、梨(24個)、番茄(59個)[19],對比之下茶樹的NF-Y基因相對較多,這可能是茶樹基因組相對較大或者在進化過程中出現大量的基因復制造成的。基因復制是基因多樣化的基礎,從而實現了遺傳新穎性,因此基因復制也是物種進化與適應的主要來源[20]。本研究中,筆者所在課題組鑒定了45個基因分布在14條染色體上,大多數CsNF-Y基因分布于2端,這可能為CsNF-Y基因復制提供了便利。在45個CsNF-Y基因組中發現有18個基因參與片段復制,7個基因參與串聯復制,因此片段復制是其擴張的主要復制方式。由于基因對的Ka/Ks值均小于1,表明所有CsNF-Y基因選擇了負純化選擇,同時發現,同源基因對CsNF-YC8和CsNF-YC13氨基酸保守序列相對較少,這可能與發生非同義突變有關。此外茶樹的進化起始點尚不清楚,無法判斷這些基因的進化是否影響評估物種的產生,但是在 CsNF-Y 基因中可以看到最老的基因重復時間為93.80百萬年前,我們從中可以看到這些基因的進化痕跡。
根據保守結構域序列可以對基因進行分類,NF-YB 和NF-YC通過他們的組蛋白折疊結構域(HFD)二聚,它可以以非序列特異性的方式結合DNA,同時作為NF-YA三聚化的支架,然后 NF-YA 特異性識別CCAAT box序列,因此NF-Y成員相互作用于相互作用域與CCAAT位點的DNA結合域識別[21];NF-Y基因在植物發育、生長和繁殖中的特異性特征生長發揮關鍵作用,這主要得益于NF-Y的亞基組織和DNA結合特性,以及對不同蛋白質模塊的適應能力[22]。以已知的酵母、植物和哺乳動物的NF-Y的DNA結合結構域為參照,CsNF-A保守區C端21個氨基酸序列Y-L-H-E-…G-G-R-F被認為,在CCAAT位點與DNA相互作用,推測CsNF-YA保守區N端21個氨基酸序列Y-V-N-A-...-A-K-A-E與其他2個亞基(CsNF-YB和CsNF-YC)相互作用。
NF-YB和NF-YC的保守序列在結構和氨基酸上具有相似性。NF-YB亞基與H2B組蛋白的組蛋白折疊基序相關,而NF-YC亞基與H2A組蛋白相關。以擬南芥中NF-YB的保守區域為參照,31個氨基酸序列:R-x-L-P-…-E-T-x-Q被認為是CsNF-YB的DNA結合域;此外,氨基酸序列A-N-V-x-…T-x-E-A與氨基酸序列 x-R-K-T-…Y-L-x-x長度分別為40 aa與32 aa,被認為是核心區域與CsNF-YA和CsNF-YC相互作用。在CsNF-YC中發現,保守區域的長度為73個氨基酸序列L-P-L-A-D-F-L-V與擬南芥相互作用域相似,被認為是CsNF-YC與CsNF-YA/CsNF-YB相互作用的核心區域,而DNA結合域由2個氨基酸殘基“A”和“R”組成,這也是NF-Y基因形成異源三聚體復合物的前提[17],個別氨基酸的突變可能是在進化過程中由于片段復制等原因造成同源性下降,同時也說明了基因家族成員的擴張不僅導致結構域發生變化也導致基因功能分化。
為了確定CsNF-Y基因的進化關系,基于茶樹、擬南芥NF-Y基因的氨基酸序列構建了系統發育樹。系統發育分析表明,茶樹NF-Y基因家族分為3個亞家族(NF-YA、NF-YB、NF-YC),同源關系越近代表著可能具有相似的生物學功能,相關研究中發現,大多數擬南芥NF-YA基因在干旱脅迫下上調表達[23],11個CsNF-YA基因有10個在干旱脅迫下上調表達。此外相關研究中,AtNF-YA5在高ABA濃度下被廣泛誘導[8],同樣的在茶樹中 CsNF-YA6 在干旱誘導下出現上調,而在NF-YB中CsNF-YB4也出現了上調,而對于鹽脅迫下只在第2天出現不同程度的上升,表明CsNF-YB4與CsNF-YA6響應干旱脅迫同時響應鹽脅迫。在CsNF-YC中,CsNF-YC5、CsNF-YC7對于干旱脅迫與鹽脅迫下的表達出現差異,這也驗證了之前的結論NF-YC對于干旱的耐受性表達不一致[24],CsNF-YA與CsNF-YB基因與干旱脅迫下的轉錄模式相似,而CsNF-YC基因與其他非生物脅迫下的轉錄模式相似。同時這些基因可以作為研究的候選基因,為進一步研究茶樹的抗旱抗鹽機制提供可能。
基因結構分析表明,大多數茶樹CsNF-Y基因有內含子,表明基因結構相對復雜,內含子可以增強它們所含基因的表達[25],CsNF-YA基因具有相似的外顯子-內含子結構,并且都具有較多的內含子。為了更全面地研究CsNF-Y基因的進化,對CsN-Y基因保守基序進行研究。每個亞科都具有相似的保守基序與外顯子-內含子組織,基因保守基序數為1~6個,其中NF-YA特異性的含有基序(3)和(9),有趣的是NF-YB與NF-YC特異性的都含有基序(1),這可能與NF-YB和NF-YC的保守區域具有同源性有關。
基因啟動子中的順式元素已被證明,在植物生理反應和環境脅迫中是必不可少的。在CsNF-Y基因中筆者所在課題組確定了其激素響應、脅迫響應和植物發育相關的順式作用元件,其中壓力響應順式作用元件最多,其次是激素響應順式作用元件。整體上可以看出,NF-YA(4.9個)與NF-YB (4.5個)基因在含有壓力順式作用元件種類和數量上平均值都比NF-YC (4.4個)基因要多。從側面也驗證了NF-YA、NF-YB、NF-YC 3個亞族響應了不同的轉錄模式,同時NF-YC可能在響應脅迫上不如其他2個亞族。在水稻中,在干旱和高鹽脅迫下,響應這2種非生物脅迫的基因啟動子區,ABRE元素比那些專門響應單一脅迫的基因啟動子區更多。在CsNF-Y基因中都含有1-7個抗氧化順式作用元件ARE,大部分基因都包含1至6個與ABA相關的順式作用元件ABRE,同時每個CsNF-Y基因都有光信號響應元件,說明CsNF-Y基因不僅參與了ABA生物通路同時也對植物生長發育具有影響。
相關研究已經證實包括擬南芥NF-YA5、百慕大草Cdt-NF-YC1[26]、大豆GmNF-YA3[27]、擬南芥AtNF-YB1與同源基因玉米ZmNFYB2等基因能顯著提高植株干旱抗性[28]。筆者所在課題組通過qRT-PCR分析表明,4個選定的基因中2個基因在干旱4 d后均出現不同程度的上調,在鹽處理下,大部分在2 d均出現上調。在BnNF-YA19、BnNF-YB16的啟動子區都包含1個或多個ABRE順式調控元件,這些基因對NaCl有特異性響應[3],結合順式作用元件分析,在選定的4個基因中發現大多含有不同數量的ABRE和MBS順式調控元件。眾所周知,ABREs、MBSs、G-boxs、W-boxs這些順式作用元件在干旱脅迫響應和對下游基因表達的調控上起著重要作用。表明茶樹NF-Y基因在干旱與鹽脅迫下存在潛在的響應機制。結合在脅迫、發育、激素中存在的其他順式作用元件,可以說明在茶樹中 NF-Y 基因在應激反應和生理發育過程中都有參與。研究結果表明,NF-Y基因響應干旱脅迫與鹽脅迫,響應程度的不一致說明了基因參與干旱脅迫與鹽脅迫響應途徑的不同。
4 結論
自NF-Y家族基因被發現與非生物脅迫密切相關以來,NF-Y基因家族也引來了大家的關注與研究。其中已經在玉米、番茄、桃、大豆上鑒定出了 NF-Y 基因家族成員,并對干旱脅迫等非生物脅迫響應。本研究以茶樹為對象,并在茶樹中鑒定確認了45個基因成員。通過結構分析、基序分析顯示每個亞家族具有典型的特征,對重復事件的分析可以清晰地看到CsNF-Y基因在基因組內通過片段復制進行擴展,通過構建茶樹、擬南芥的進化樹與抗旱響應啟動子順式元件分析,借助于擬南芥等植物相關基因的功能性報道,筆者所在課題組分析了基因的生物學功能、基因同源關系,并證實了一些基因對如CsNF-YA6、CsNF-YB4具有響應非生物脅迫的功能。這為進一步分析茶樹的抗旱與抗鹽相關機制打下了基礎。最終選取了CsNF-YA6、CsNF-YB4 作為候選基因,為進一步分析研究茶樹NF-Y基因的功能并為茶樹的抗旱抗鹽分子機制提供信息。
參考文獻:
[1]Zhu J K. Salt and drought stress signal transduction in plants[J]. Annual Review of Plant Biology,2002,53:247-273.
[2]Yamaguchi-Shinozaki K,Shinozaki K. Transcriptional regulatory networks in cellular responses and tolerance to dehydration and cold stresses[J]. Annual Review of Plant Biology,2006,57:781-803.
[3]Wang J,Jin Z Y,Zhou M J,et al. Characterization of NF-Y transcription factor families in industrial rapeseed (Brassica napus L.) and identification of BnNF-YA3,which functions in the abiotic stress response[J]. Industrial Crops and Products,2020,148:112253.
[4]Siefers N,Dang K K,Kumimoto R W,et al. Tissue-specific expression patterns of Arabidopsis NF-Y transcription factors suggest potential for extensive combinatorial complexity[J]. Plant Physiology,2008,149(2):625-641.
[5]Stephenson T J,McIntyre C L,Collet C,et al. Genome-wide identification and expression analysis of the NF-Y family of transcription factors in Triticum aestivum[J]. Plant Molecular Biology,2007,65(1/2):77-92.
[6]Liu R,Wu M,Liu H L,et al. Genome-wide identification and expression analysis of the NF-Y transcription factor family in Populus[J]. Physiologia Plantarum,2021,171(3):309-327.
[7]Ma X Y,Zhu X L,Li C L,et al. Overexpression of wheat NF-YA10 gene regulates the salinity stress response in Arabidopsis thaliana[J]. Plant Physiology and Biochemistry,2015,86:34-43.
[8]Li W X,Oono Y,Zhu J H,et al. The Arabidopsis NFYA5 transcription factor is regulated transcriptionally and posttranscriptionally to promote drought resistance[J]. The Plant Cell,2008,20(8):2238-2251.
[9]Lee D K,Kim H I,Jang G,et al. The NF-YA transcription factor OsNF-YA7 confers drought stress tolerance of rice in an abscisic acid independent manner[J]. Plant Science,2015,241:199-210.
[10]Yang M Y,Zhao Y J,Shi S Y,et al. Wheat nuclear factor Y (NF-Y) B subfamily gene TaNF-YB3;l confers critical drought tolerance through modulation of the ABA-associated signaling pathway[J]. Plant Cell,Tissue and Organ Culture,2017,128(1):97-111.
[11]Hwang K,Susila H,Nasim Z,et al. Arabidopsis ABF3 and ABF4 transcription factors act with the NF-YC complex to regulate SOC1 expression and mediate drought-accelerated flowering[J]. Molecular Plant,2019,12(4):489-505.
[12]Chen C J,Chen H,Zhang Y,et al. TBtools:an integrative toolkit developed for interactive analyses of big biological data[J]. Molecular Plant,2020,13(8):1194-1202.
[13]Zhang Z,Li J,Zhao X Q,et al. KaKs_Calculator:calculating Ka and Ks through model selection and model averaging[J]. Genomics,Proteomics & Bioinformatics,2006,4(4):259-263.
[14]王園園,趙春月,孫潤潤,等. 亞洲棉NF-YA基因家族的全基因組鑒定及表達分析[J]. 分子植物育種,2021,19(14):4564-4573.
[15]Pereira S L S,Martins C P S,Sousa A O,et al. Genome-wide characterization and expression analysis of citrus NUCLEAR FACTOR-Y (NF-Y) transcription factors identified a novel NF-YA gene involved in drought-stress response and tolerance[J]. PLoS One,2018,13(6):e0199187.
[16]Liang M X,Hole D,Wu J X,et al. Expression and functional analysis of NUCLEAR FACTOR-Y,subunit B genes in barley[J]. Planta,2012,235(4):779-791.
[17]Li M,Li G X,Liu W,et al. Genome-wide analysis of the NF-Y gene family in peach (Prunus persica L.)[J]. BMC Genomics,2019,20(1):612.
[18]Mantovani R. The molecular biology of the CCAAT-binding factor NF-Y[J]. Gene,1999,239(1):15-27.
[19]Li S,Li K,Ju Z,et al. Genome-wide analysis of tomato NF-Y factors and their role in fruit ripening[J]. BMC Genomics,2016,17:36.
[20]Sémon M,Wolfe K H. Consequences of genome duplication[J]. Current Opinion in Genetics & Development,2007,17(6):505-512. [HJ2mm]
[21]Myers Z A,Holt B F Ⅲ. NUCLEAR FACTOR-Y:still complex after all these years?[J]. Current Opinion in Plant Biology,2018,45(PtA):96-102.
[22]Chaves-Sanjuan A,Gnesutta N,Gobbini A,et al. Structural determinants for NF-Y subunit organization and NF-Y/DNA association in plants[J]. The Plant Journal,2021,105(1):49-61.
[23]Hackenberg D,Keetman U,Grimm B. Homologous NF-YC2 subunit from Arabidopsis and tobacco is activated by photooxidative stress and induces flowering[J]. International Journal of Molecular Sciences,2012,13(3):3458-3477.
[24]Li L L,Yu Y L,Wei J,et al. Homologous HAP5 subunit from Picea wilsonii improved tolerance to salt and decreased sensitivity to ABA in transformed Arabidopsis[J]. Planta,2013,238(2):345-356.
[25]Parra G,Bradnam K,Rose A B,et al. Comparative and functional analysis of intron-mediated enhancement signals reveals conserved features among plants[J]. Nucleic Acids Research,2011,39(13):5328-5337.
[26]Chen M,Zhao Y J,Zhuo C L,et al. Overexpression of a NF-YC transcription factor from bermudagrass confers tolerance to drought and salinity in transgenic rice[J]. Plant Biotechnology Journal,2015,13(4):482-491.
[27]Ni Z Y,Hu Z,Jiang Q Y,et al. GmNFYA3,a target gene of miR169,is a positive regulator of plant tolerance to drought stress[J]. Plant Molecular Biology,2013,82(1/2):113-129.
[28]Nelson D E,Repetti P P,Adams T R,et al. Plant nuclear factor Y (NF-Y) B subunits confer drought tolerance and lead to improved corn yields on water-limited acres[J]. Proceedings of the National Academy of Sciences of the United States of America,2007,104(42):16450-16455.
收稿日期:2022-08-04
基金項目:河南省林草局科技興林項目(編號:YLK202138);河南省科技攻關項目(編號:212102110186);信陽農林學院青年基金(編號:QN2021013、QN2021016)。
作者簡介:許芳芳(1993—),女,河南駐馬店人,碩士,助教,主要從事植物抗逆脅迫及生態保護研究。E-mail:906792515@qq.com。
通信作者:王 輝,碩士,副教授,從事植物造景與養護研究與教學。E-mail:13733159426@163.com。

