EGCG 改善高果糖飲食小鼠代謝紊亂的作用與機制研究
周繼紅,陳蔚,丁樂佳,王岳飛
浙江大學茶葉研究所,浙江 杭州 310058
隨著我國經濟飛速發展與人民消費水平不斷提高,國民對甜食及含糖飲料的喜愛度與日俱增[1]。高果糖玉米糖漿(High fructose corn syrup,HFCS)是甜食及軟飲料中甜味劑的主要來源之一[2]。飲食是健康的重要決定因素,已有流行病學研究發現過量攝入果糖的飲食習慣同肥胖癥、脂肪肝等代謝綜合征的發生具有相關性[3-6]。因此,通過安全有效的膳食調節方式防治高果糖飲食誘導的相關代謝綜合征成為了食品營養科學和健康領域亟待解決的重要問題。
茶作為一種具有促進健康作用的功能性食品和飲料,被人們廣泛飲用。表沒食子兒茶素沒食子酸酯(Epigallocatechin gallate,EGCG)作為綠茶中含量最高的多酚類物質組成成分之一,已被證明在緩解代謝障礙[7-8]及抗炎方面[9-10]效果顯著。然而,現有的EGCG調節食源性肥胖、代謝障礙及炎癥等方面的機制研究主要聚焦于高脂膳食模型或高葡萄糖、高蔗糖膳食模型,對高果糖飲食誘發的代謝障礙及炎癥反應的調節機制仍有待明晰。本研究基于高果糖飲食誘導的C57BL/6J 小鼠模型,從EGCG 對小鼠脂質積累、血糖調節能力、肝功能、脂質代謝以及炎癥反應的作用與機制展開研究,為挖掘膳食補充EGCG 改善高果糖飲食誘導的代謝紊亂的膳食干預新靶點奠定理論基礎和試驗基礎。
1 材料與方法
1.1 試驗材料
1.1.1 試驗動物
15 只4 周齡雄性SPF 級C57BL/6 小鼠購自上海斯萊克實驗動物有限公司[SCXK(浙)2018-0006],飼養于浙江大學動物實驗中心SPF 級動物房。小鼠均在標準環境內(溫度22~26 ℃,相對濕度40%~70%,12 h/12 h 光暗循環)合籠飼養(每籠5 只)。試驗期間小鼠自由攝食及飲水。
1.1.2 藥品與試劑
EGCG(純度≥98%)購自湖州榮凱植物提取有限公司;普通小鼠飼料、高果糖小鼠飼料(17%果糖供能,其他比例參照美國Research Diets 公司D12451 飼料配方)、高果糖添加1% EGCG 小鼠飼料(前者基礎上添加1% EGCG)購自上海帆泊生物技術有限公司;蘇木精-伊紅(Hematoxylin-eosin,HE)染色試劑盒、油紅O 染色試劑盒、腫瘤壞死因子α(Tumor necrosis factor,TNF-α)/白細胞介素-1β(Interleukin-1β,IL-1β)/白細胞介素-6(Interleukin-6,IL-6)酶聯免疫法(Enzyme-linked immunosorbent assay,ELISA)試劑盒、cDNA第一鏈合成試劑盒均購自武漢賽維爾生物科技有限公司;Trizol 試劑盒購自賽默飛世爾中國。
1.1.3 儀器與設備
SW-CJ-1FD 超凈工作臺,蘇凈集團蘇州安泰空氣技術有限公司;KZ-Ⅲ-FP 高速組織研磨儀、MX-F 渦旋混合器,武漢賽維爾生物科技有限公司;D3024R 臺式高速冷凍型微量離心機,大龍興創實驗儀器(北京)股份公司;One-Touch UltraVue 血糖儀及試紙,強生(中國)醫療器械有限公司;TBA-40FR 全自動生化分析儀,日本東芝;FBZ2001-up-p 標準試劑型純水儀,青島富勒姆科技有限公司;Epoch酶標檢測儀,美國伯騰儀器有限公司;CFX熒光定量聚合酶鏈式反應( Real-time Quantitative Polymerase Chain Reaction ,qRT-PCR)儀,美國Bio-Rad 公司;NanoDrop 2000 超微量分光光度計,賽默飛世爾中國。
1.2 試驗方法
1.2.1 動物分組及干預方案
15 只4 周齡雄性C57BL/6 小鼠適應性喂養14 d 后根據體質量(20±2)g 隨機分為正常飲食組(Normal chow diet,NCD)、高果糖飲食組(High-fructose diet,HFD)、高果糖補充1% EGCG 組(High-fructose+EGCG diet,HFE),其中EGCG 濃度在已有文獻[11-14]及前期預試驗的基礎上確定。持續飼喂8 周,每周記錄兩次小鼠攝食量(攝食量=給食量-剩食量)、體質量并計算能量利用率(能量利用率=增重量/攝入能量×100%)。本研究經浙江大學實驗動物倫理委員會審查批準(審批號:ZJU20210199)。
1.2.2 口服葡萄糖耐量檢測
第 8 周測定小鼠口服葡萄糖耐量(Oral glucose tolerance test,OGTT)值:對小鼠禁食16 h 后測定小鼠空腹血糖值,再以30%葡萄糖溶液按2 g·kg-1劑量對小鼠進行灌胃,使用快速血糖儀分別于15、30、60、90、120 min在小鼠尾部取血測定血糖值。通過計算血糖曲線下面積(Area under the curve of blood glucose,AUC)得出血糖貢獻比例:
式中,AUCB為NCD 曲線下面積;AUCP為HFD、HFE 曲線下面積。
1.2.3 血液生化指標檢測
第8 周末處死小鼠,取眼內眥靜脈竇血約3 mL 置于離心管中,靜置2 h 后以3 000 r·min-1離心20 min,取血清放置-80 ℃冰箱備用。后續利用全自動化分析儀檢測小鼠谷丙轉氨酶(Alanine Transaminase,ALT)和谷草轉氨酶(Aspartate Transaminase,AST)指標。
1.2.4 組織形態學觀察
將小鼠結腸同一位置部分組織置于4%多聚甲醛固定液中固定24 h,石蠟包埋、切片后,依照蘇木精-伊紅染色(Hematoxylin-eosin Staining,HE)試劑盒說明書進行染色,中性樹脂封片后在顯微鏡下觀察各組小鼠腸道組織學形態,判斷其組織完整性及受損情況。
將小鼠肝臟同一位置部分組織用蔗糖溶液脫水,冰凍切片包埋后依照油紅O 染色試劑盒說明書進行操作,在顯微鏡下觀察小鼠肝組織中脂滴積累情況。
1.2.5 ELISA 檢測炎癥因子釋放水平
取小鼠肝臟按質量體積比1∶9 加入0.9%生理鹽水,并在冰水浴條件下制備成10%的勻漿,3 000 r·min-1離心10 min,取上清液,依照ELISA 試劑盒說明書測定TNF-α、IL-1β、IL-6 的含量。以同樣的方式制備腸道組織勻漿,離心后取上清液,按說明書測定IL-6 的含量。
1.2.6 實時熒光定量 PCR 檢測關鍵基因表達水平
將肝臟、結腸組織研磨后,依照 Trizol試劑盒對其進行總RNA 抽提,使用NanoDrop 2000 超微量分光光度計測定RNA 濃度。根據濃度結果稀釋樣品并將其反轉錄為cDNA。調節cDNA 濃度后結合SYBR 反應體系,對肝臟中固醇調節元件蛋白 1c( Sterol regulatory-element-binding protein-1c ,SREBP-1c)、結腸中胞質閉鎖小帶蛋白-1(Zonula occludens-1,ZO-1)和跨膜緊密連接蛋白Occludin,肝臟和結腸中Toll 樣受體4(Toll-like receptor 4,TLR4)/髓樣分化因子(Myeloid differentiation factor 88,MyD88)的基因表達水平進行測定,PCR 引物序列見表1。

表1 熒光定量PCR 引物序列Table 1 Primer sequences of qRT-PCR
1.2.7 免疫組化檢測ZO-1、Occludin 蛋白分布及表達
將包埋的蠟塊切片進行常規脫蠟和水化,使用0.01 mol·L-1枸櫞酸緩沖液(pH 6.0)抗原修復,3%雙氧水進行處理,然后畫圈并進行血清封閉后,通過一抗(抗ZO-1、Occludin抗體)封閉保持4 ℃過夜孵育,第二天二抗室溫孵育,待顯色后再用蘇木精復染,最后將切片脫水、透明、封片。
1.2.8 數據處理及分析
采用 Image J 軟件處理圖像,GraphPad Prism 8 軟件處理試驗所獲數據并對其進行分析統計及圖表繪制。試驗數據采用平均數±標準差(±SD)表示,兩組間數據比較采用t檢驗,多組間數據比較采用One-way ANOVA單向方差分析和Tukey 事后檢驗,以P<0.05表示差異達到統計學顯著水平。
2 結果與分析
2.1 EGCG 對高果糖飲食小鼠體重、組織表征及血糖調節能力的改善作用
各組小鼠初始體重無顯著差異,相應飼料飼喂8 周后,HFD 組小鼠體重顯著高于NCD組(P<0.05),HFE 組小鼠體重增幅回降明顯,平均體重與NCD 組無顯著差異(圖1A)。在日平均進食量、攝入能量方面,各組小鼠均無明顯差異(圖1B 和圖1C)。在能量利用率方面,HFE 組顯著低于HFD 組(P<0.05),與NCD 組無顯著差異(圖1D)。小鼠脂肪組織質量及組織形態學染色結果表明(圖1E 和圖1F),HFD 組小鼠脂肪質量和體積顯著大于NCD 組和HFE 組(P<0.05);HFE 組小鼠附睪脂肪組織細胞大小顯著低于HFD 組(P<0.05),與NCD 組無明顯差異。以上結果說明,膳食補充EGCG 能夠在不影響小鼠的攝食量及日常行為活動的基礎上,減輕脂質的過量積累及脂肪質量,緩解高果糖飲食誘導的小鼠體重增長。
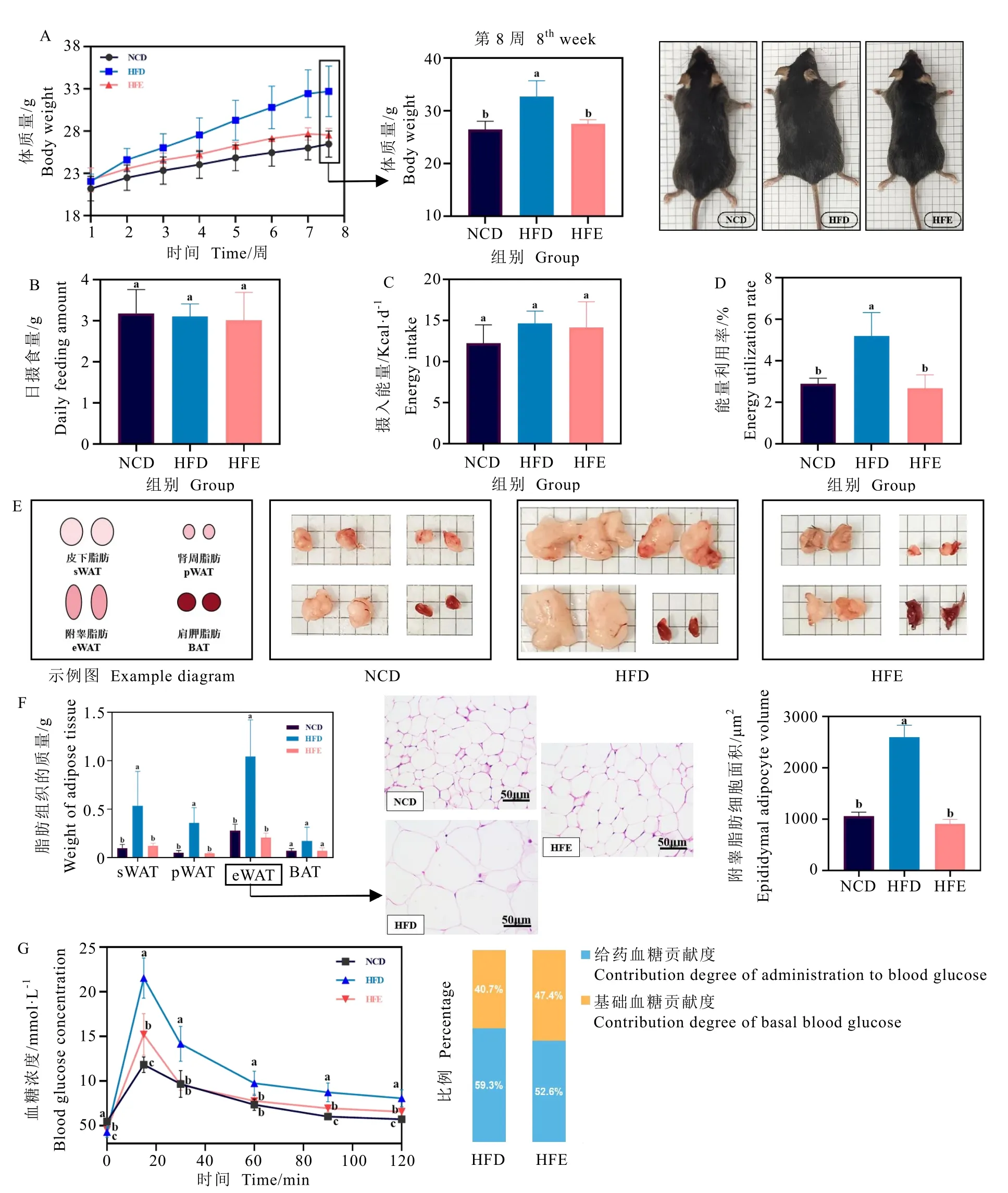
圖1 EGCG 對小鼠體重、組織表征及血糖調節能力的影響Fig. 1 The effects of EGCG on body weight, tissue characterization and blood glucose regulation ability in mice
OGTT 可反映小鼠的血糖調節能力。圖1G顯示,HFD 組小鼠血糖濃度在灌胃葡萄糖溶液15 min 后達到峰值,為(21.54±2.02) mmol·L-1,且無法在2 h 內回降到正常的糖耐量水平(<8.1 mmol·L-1);HFE 組小鼠的血糖濃度峰值為(15.22±2.09) mmol·L-1,顯著低于HFD 組(P<0.05),并可在2 h 內回穩至正常血糖濃度。進一步通過AUC 比較各組小鼠基礎血糖和給藥后對血糖濃度的貢獻比例,結果表明,HFE組給藥血糖貢獻度較HFD 組下降了約7%,提示EGCG 能夠延緩高果糖飲食誘導的小鼠升糖水平,并縮短回穩至正常血糖水平的時間。
2.2 EGCG 對高果糖飲食小鼠肝臟表征及炎癥反應的改善作用
肝臟能夠通過糖原合成、分解、儲存和釋放等調節血糖水平,因此進一步對肝臟進行形態學染色觀察及相關參數測定。在肝臟重量方面,HFE 組小鼠肝臟重量較HFD 組顯著降低(P<0.05),且與NCD 組無明顯差異(圖2A)。染色結果表明(圖2B),油紅O 可特異性吸附脂肪從而使其呈紅色,HFD 組細胞中存在大量脂滴,HFE 組脂滴面積顯著下降;HE 染色可使細胞核呈藍紫色,細胞質和細胞外基質呈紅色,未著色部分表示空泡,空泡越多面積越大代表肝脂肪變程度越高,圖2B 中可見HFD 組胞漿內界限不明,出現大量空泡,存在明顯的肝脂肪變,而HFE 組中上述情況有明顯改善。ALT、AST 水平是評估肝臟功能的基礎指標,圖2A 顯示,各組之間的ALT、AST 水平沒有顯著差異。在炎癥因子方面(圖2C),各組IL-6 含量無顯著差異,HFD 組炎癥因子TNF-α、IL-1β釋放水平顯著高于NCD組(P<0.05),HFE 組略有降低但同HFD 組相比差異并不顯著。以上結果表明,EGCG 可能通過抑制肝臟內脂質積累、降低炎癥TNF-α、IL-1β因子水平來維穩高果糖飲食背景下的肝臟功能。
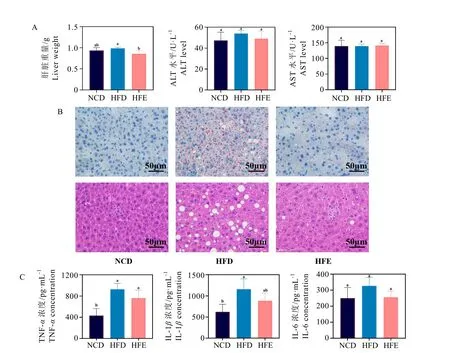
圖2 EGCG 對小鼠肝臟表征、肝功能及炎癥因子釋放水平的影響Fig. 2 The effects of EGCG on liver characterization, liver function and release levels of inflammatory factors in mice
2.3 EGCG 對高果糖飲食小鼠腸道表征及炎癥反應的改善作用
除肝臟外,腸道作為食物消化、營養吸收的主要器官,在穩定血糖血脂水平、調節脂質代謝等方面也具有重要作用。腸壁完整性是維持腸道功能的基礎,小鼠結腸組織HE 染色結果表明(圖3A),HFD 組小鼠腸壁顯著變薄、黏膜下層水腫、腺腔消失、腺體多數不完整、排列紊亂,說明HFD 組小鼠腸道發生了結構損傷;HFD 組小鼠黏膜淋巴細胞增生明顯,上皮細胞和杯狀細胞存在大面積丟失情況,表明HFD 組小鼠可能存在潛在的炎癥。與HFD組相比,HFE 組小鼠腺體結構較為完整,腺腔排列狀況明顯改善,僅存在少數杯狀細胞丟失現象。進一步從各組炎癥因子釋放水平判斷(圖3B),HFE 組小鼠的IL-6 含量低于HFD組,但差異并不顯著。上述結果表明,EGCG能夠緩解高果糖飲食誘導的腸道結構損傷,抑制炎性情況。
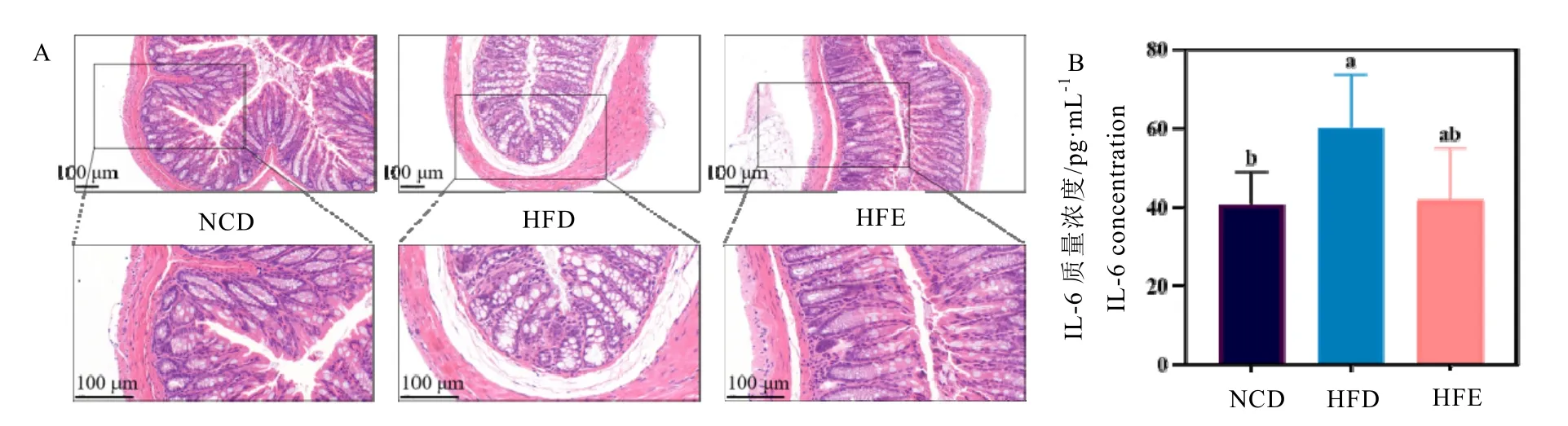
圖3 小鼠結腸HE 染色結果(20.0×、40.0×)及腸道炎癥因子IL-6 濃度Fig. 3 HE scanning of colon(20.0×、40.0×)and IL-6 concentration
2.4 EGCG 對高果糖飲食小鼠脂質代謝及炎癥反應相關通路關鍵基因表達的影響
在上述研究結果的基礎上,為進一步探究高果糖飲食下EGCG 通過肝-腸軸來抑制代謝紊亂的分子機制,檢測了肝臟中調控脂質代謝Srebp-1c和炎性反應Tlr4、Myd88基因的表達,以及腸道組織中調控腸壁完整性Zo-1、Occludin和炎性反應Tlr4、Myd88基因的表達。圖4A 顯示,與NCD 組相比,HFD 組小鼠肝臟中Srebp-1c、Tlr4和Myd88基因表達水平顯著上升(P<0.05),但與HFE 組相比沒有顯著差異。如圖4B 所示,在腸壁完整性方面,HFE 組小鼠腸道中Zo-1基因表達水平顯著高于HFD 組(P<0.05),Occludin基因表達水平在各組之間無顯著差異;在炎性反應方面,HFE 組小鼠的Tlr4、Myd88基因表達水平顯著低于HFD 組(P<0.05),且同NCD 組無明顯差異。為明確EGCG 對高果糖飲食誘導小鼠ZO-1、Occludin 的蛋白分布及表達水平的影響,進一步通過免疫組化檢測了ZO-1、Occludin 蛋白在腸組織的分布及平均光密度。圖4C 和4D 顯示,ZO-1 蛋白主要位于細胞膜內,Occludin 蛋白主要分布于細胞膜外,兩者均沿膜連續分布。HFD 組ZO-1 和Occludin蛋白均呈弱陽性表達,棕黃色顆粒明顯減少且染色淡,通過平均光密度值計算蛋白表達水平,統計顯示HFE 組ZO-1 和Occludin 蛋白表達水平明顯高于HFD 組(P<0.05),且同NCD 組無明顯差異。這表明膳食補充EGCG可能通過抑制肝臟Srebp-1c基因表達來調節高果糖飲食引起的脂質代謝紊亂,提高Zo-1基因表達水平,以及ZO-1 和Occludin 蛋白表達水平來保障腸道結構和功能,共同下調肝臟、腸道中Tlr4和Myd88基因表達水平來改善炎性情況。
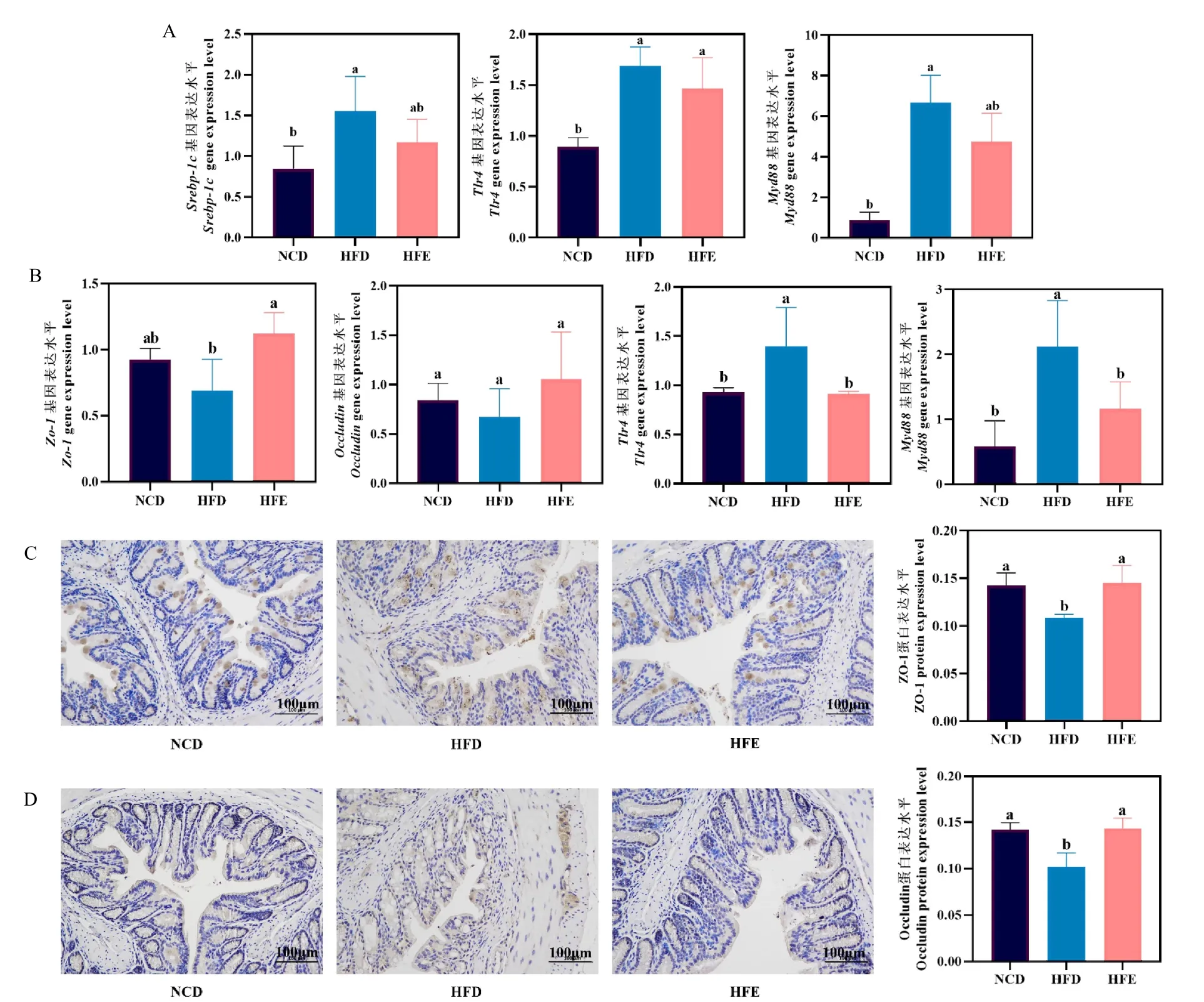
圖4 小鼠肝臟和腸道組織相關基因及蛋白表達水平Fig. 4 Expression levels of related genes in liver and intestinal tissues in mice
3 討論
19 世紀70 年代起,HFCS 因其甜度高、易獲取、成本低等特點,代替蔗糖逐漸成為食品加工業中糖果、蛋糕、軟飲料等產品的主要甜味添加劑之一,導致攝入高果糖的人群比例逐年升高。越來越多的研究表明,長期攝入高果糖會導致內臟脂肪積累、糖脂代謝紊亂、氧化應激和慢性輕度炎癥等,成為誘發肥胖癥、心腦血管疾病、非酒精性脂肪肝病、胰島素抵抗等代謝綜合征的危險因素[15]。Gao 等[16]研究發現,過量攝入果糖會使大鼠體重增加;Hernandez-Diazcouder 等[17]發現,果糖可激活脂肪生成途徑從而促進白色脂肪組織的積累。目前,針對高果糖飲食誘導的相關代謝障礙,主要采用藥物方法進行干預,但往往存在缺乏有效靶向治療途徑、副作用強、建立耐受周期長[18]等缺點,因此從天然食物中找尋改善高果糖飲食誘導代謝紊亂的潛在功能因子,探究其主要調控機制具有重要的科學價值與社會價值。Seo 等[19]試驗發現,長期飼喂富含多酚的釀酒葡萄籽粉能夠顯著緩解高脂高果糖飼喂小鼠體重增加、內臟肥胖和高脂血癥的情況;Han 等[20]發現,山楂提取物有效改善了小鼠肝臟的炎癥和血脂異常;Yamamoto 等[21]研究發現,黑豆多酚能夠抑制小鼠肝臟的脂質積累及炎癥反應。而EGCG 作為綠茶多酚類物質中含量最高、活性最強的兒茶素成分,在減少高果糖飲食引起的負面變化方面也具有良好潛力。程倩[22]發現,EGCG 能夠抑制高果糖飲食誘導的小鼠體重增長;Mi 等[23]發現,EGCG 能抑制高脂高果糖飲食引起的脂肪細胞肥大和脂質積累。與上述結果相似,本研究結果表明,膳食補充EGCG 能夠有效恢復高果糖飲食小鼠的血糖調節能力,顯著抑制小鼠脂肪組織重量增加、細胞體積增大及脂質積累,并通過調節ALT 和AST 水平來改善肝臟受損情況。但是,目前EGCG 對高果糖膳食模型的預防作用往往關注EGCG 對單一器官或單一通路的影響,缺乏對多組織多器官的綜合探討與分析,本研究旨在探討EGCG 在腸道、肝臟協同調控情況下對高果糖飲食的預防作用。
腸道和肝臟作為果糖代謝的關鍵器官,能夠通過門靜脈系統實現營養成分及代謝產物的相互聯系,這一雙向交流通路被稱作腸-肝軸[24]。果糖被攝入后首先會在小腸上皮細胞中與5 型葡萄糖轉運蛋白(Glucose transporter 5,GLUT5)結合,過量的果糖則會經由門靜脈溢出至肝臟[25]。因為果糖代謝不受胰島素調節,且催化其代謝的磷酸果糖激酶為非限速酶,所以果糖在肝臟中代謝速度遠高于葡萄糖,更易促進甘油三酯的合成和肝脂肪變性[26]。研究表明,過量攝入果糖會破壞腸壁完整性導致內毒素移位,增加促炎性反應信號釋放和黏附分子數量[27],以上信號又可經門靜脈血液循環作用于肝臟[28],誘發腸道和肝臟的炎癥反應和功能障礙[29]。與上述研究類似,在膳食多酚干預中,Tu 等[30]研究發現口服酚類物質經由腸道代謝、肝臟循環參與介導。Li 等[31]研究表明,薔薇多糖對肝臟有保護作用,并通過腸-肝軸調節炎癥因子水平;Hu 等[32]研究發現,柑橘皮粉對肝臟和腸道的脂肪積累、促炎細胞因子的釋放有較強的抑制作用。由此表明,腸-肝軸介導的脂質代謝和炎性反應是膳食多酚調節高果糖飲食誘導代謝紊亂的重要靶點。
腸道屏障是腸道發揮功能的基礎,ZO-1和Occludin 作為促使腸道上皮細胞緊密連接的主要蛋白,與腸道通透性關系密切。Wilkinson 等[33]發現,犬腎細胞被敲低或敲除Zo-1后,膜張力下降,腸壁通透性增強,內毒素等有害物質進入血液循環并引發炎癥反應。TLR4/MyD88 信號通路是介導炎性反應的重要通路,TLR4 識別對應信號后,通過下游信號傳遞分子MyD88 進行胞內信號傳導,以至激活核因子-κB(Nuclear factor-κB,NF-κB),促使細胞分泌相關TNF-α、IL-6、IL-8、IL-1β等促炎因子誘導炎癥的發生[33-34]。Wu 等[35]發現,TLR4 通過下調ZO-1 等緊密連結蛋白,并上調TNF-α、IL-1β、IL-6 促炎因子誘導炎癥性腸病。Mir 等[36]研究表明,Occludin 缺乏小鼠會使乙醇誘導的TLR4 水平上升,從而破壞結腸上皮的連接導致腸屏障功能障礙。EGCG 已被證明能夠通過恢復ZO-1、Occludin等蛋白表達水平[37]、改變白介素、TNF、TLRs等炎癥因子的釋放水平[38-39]、影響中性粒細胞相關酶活及形成途徑[40]等方式來緩解全身炎癥。本試驗聚焦于膳食EGCG 和腸-肝軸的協同調控作用,結果顯示,膳食補充EGCG 可顯著上調腸道Zo-1基因表達水平、ZO-1 和Occludin 蛋白表達水平,降低高果糖飲食誘導小鼠肝臟中TNF-α、IL-1β炎癥因子和腸道中IL-6 炎癥因子水平,并抑制腸-肝軸中Tlr4、Myd88基因表達來協同調控高果糖飲食誘導的代謝紊亂,后續將圍繞腸道菌群、膽汁酸、代謝酶類與激素等方面進行探究。
綜上所述,膳食補充EGCG 可有效改善高果糖誘導的小鼠體重增加、脂質積累、血糖紊亂以及肝功能障礙,并可上調Zo-1基因表達水平、ZO-1 和Occludin 蛋白表達水平,以加強腸屏障功能,下調肝臟、腸道中 IL-6、IL-1β、TNF-α促炎因子水平以改善炎癥反應,其作用機制可能與抑制TLR4/MyD88 信號通路有關(圖5)。本研究從膳食多酚EGCG 和腸-肝軸協同調控的角度揭示了膳食補充EGCG 改善高果糖飲食誘導代謝紊亂的作用與機制,為EGCG 防治高果糖相關代謝綜合征及相關功能食品的開發提供了試驗依據與研究基礎。
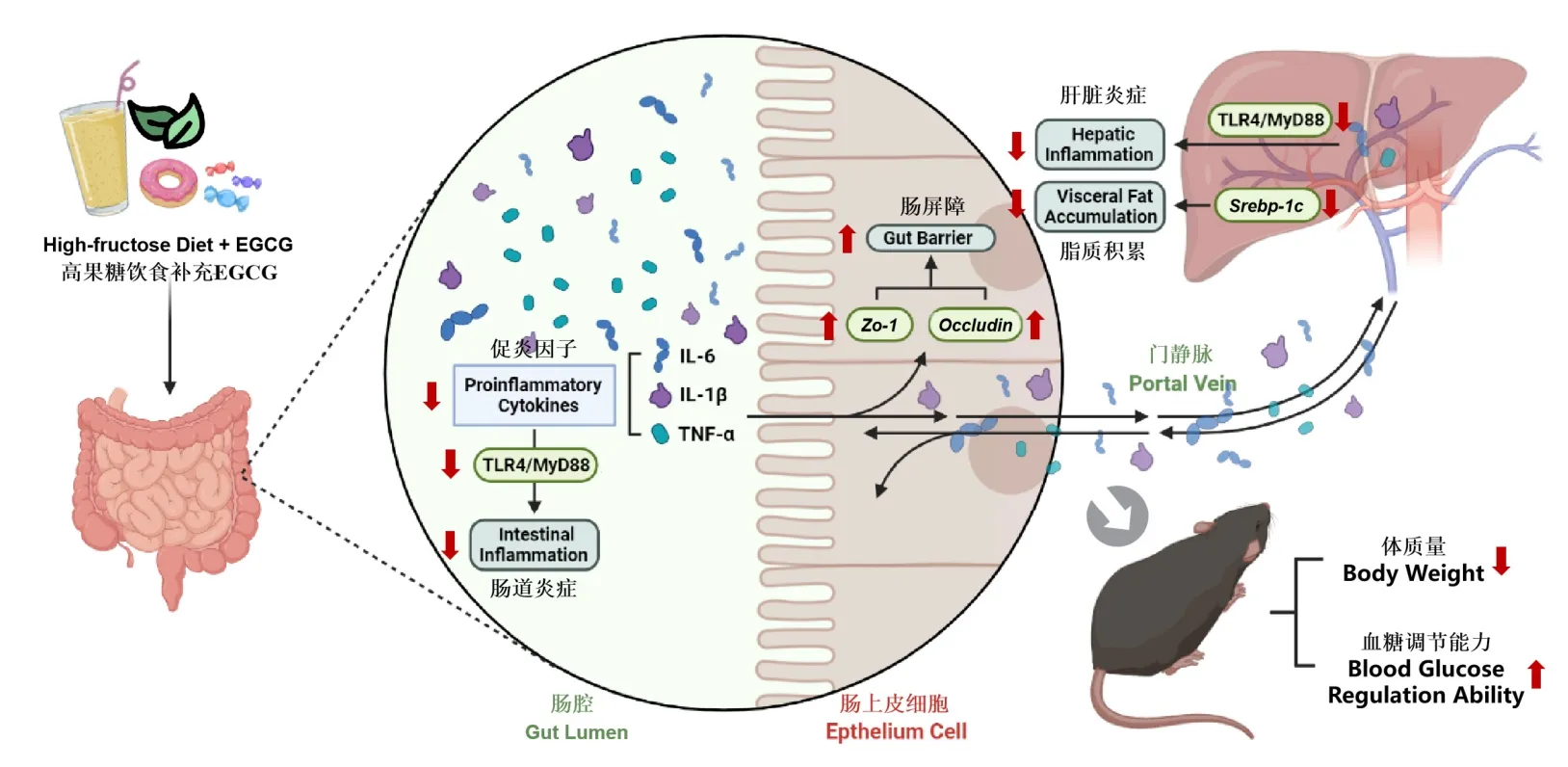
圖5 EGCG 通過肝-腸軸調節高果糖誘導代謝紊亂的作用機制圖Fig. 5 The mechanism of EGCG in regulating high-fructose diet-induced metabolic disorders through the gut-liver axis

