亞精胺下調AGE/RAGE信號通路改善糖尿病大鼠認知功能障礙
蔣淑娟 邢美艷
糖尿病 (diabetes mellitus,DM)作為常見的代謝性疾病會引發一系列并發癥,當前全世界有3.66億人患有DM,已嚴重威脅人類健康[1]。DM亦可累及大腦,患者腦部出現神經元丟失、軸突變性、突觸形成受阻和突觸可塑性障礙等,表現為慢性進行性加重的認知功能障礙,又稱為“糖尿病性認知功能障礙(diabetes-associated cognitive dysfunction,DACD)”[2]。然而,當前對于治療DACD尚無有效策略。因此,尋求開發有效的治療藥物對于臨床上防治DACD至關重要。亞精胺(spermidine,Spd)是一種廣泛分布在生物體內的天然多胺,對細胞穩態、細胞生長、細胞增殖、組織再生等具有關鍵的支持作用,在人體多種組織中扮演抗衰老的角色[3]。已有研究表明Spd對認知損傷具有一定改善作用[4],但Spd是否拮抗DACD尚未有人探索。在DM中,由高血糖引起的內皮細胞中晚期糖基化終產物 (advanced glycation end products,AGEs) 過度形成被認為是大腦認知能力下降的重要原因[5]。AGE通過晚期糖基化終產物受體 (the receptor of advanced glycation end products,RAGE) 控制血管內皮細胞的功能[6]。本研究以鏈脲佐菌素 (streptozocin,STZ) 誘導的DM大鼠為模型主要觀察Spd對DACD的改善作用以及對海馬AGE-RAGE信號通路的影響,旨在為Spd的臨床應用提供實驗依據。
1 材料與方法
1.1 實驗動物 選取40只體重200~250 g的SPF級別的雄性SD大鼠(6~8周齡),購自安徽醫科大學實驗動物中心,動物合格證號為SCXK(皖)2017-001。大鼠單籠飼養,允許其自由進食與進水,室內空氣、通風良好,人工光/暗周期為12/12 h(光照時間7∶00~19∶00),溫度20~25℃,相對濕度50%左右,并每周更換墊料2~3次以保證大鼠舒適的環境。所有實驗均遵循國家承認的《實驗動物管理條例》和《動物倫理委員會管理條例》。
1.2 實驗藥物與試劑 Spd(批號:S0381)及STZ(批號:S0130,純度>98%)粉末購自美國 Sigma 公司,血糖儀和血糖試紙購自德國羅氏 (ROCHE) 公司。AGE(批號:ab23722)Elisa試劑盒,RAGE(批號:ab37647) 和β-actin(批號:ab8226)蛋白特異性抗體,以及辣根過氧化物酶 (HRP) 標記二抗(批號:ab6721)均購于英國Abcam公司。BCA 蛋白檢測試劑盒(批號:P0012)和SDS-PAGE凝膠制備試劑盒(批號:P0012A)均購于上海碧云天生物科技公司。
1.3 方法
1.3.1 糖尿病模型:大鼠禁食過夜 (12 h) 后,DM模型組用55 mg/kg劑量的STZ腹腔注射,對照組給予相同劑量的檸檬酸鈉溶液。注射STZ后,禁食1 h后再喂食。STZ注射3 d后,用血糖儀檢測大鼠尾靜脈空腹血糖,血糖>16.7 mmol/L為DM大鼠,納入正式實驗。血糖不達標者,等大鼠恢復到正常血糖狀態下重新造模。
1.3.2 動物分組及處理:大鼠隨機分為4組(n=10):對照組、DM模型組、DM+低劑量Spd (5 mg/kg,腹腔注射)組、DM+高劑量Spd (10 mg/kg,腹腔注射) 組。在STZ處理的大鼠確認DM大鼠后,給予不同的藥物處理:Spd組予以不同濃度的Spd,其余組予以等量的蒸餾水。所有大鼠連續處理4周后進行認知行為學試驗,隨后取海馬組織檢測相關指標。
1.4 觀察指標
1.4.1 血糖與體重測定:STZ注射前當天,注射后第3天及第28天早晨進食前采集大鼠尾靜脈血, 用血糖儀檢測4組大鼠空腹血糖。在STZ注射當天及注射后第1~4周記錄4組大鼠體重。
1.4.2 認知功能:藥物干預結束后,所有大鼠經Morris水迷宮試驗評估空間學習和記憶能力。實驗分2個階段:①定位航行 (place navigation):水池分為4個象限,將直徑20 cm的平臺放置于其中一個象限中央,水面下5 cm處。大鼠隨機位置放入水中,每次記錄找到平臺的時間(逃避潛伏期)。每次試驗最長120 s;若超過120 s未找到平臺(逃避潛伏期記為120 s),則引導動物到平臺,讓動物在平臺上停留20 s。每只動物每天訓練4次(每次從不同的象限開始,每天的順序不同),2次訓練間隔15~20 min,連續訓練5 d;每天取4次平均值為最終結果。②空間探索 (spatial probe):第6天去掉平臺,將大鼠由原先平臺象限的對側放入水中,記錄其在120 s內在目標象限(原放置平臺的象限)所花的時間和跨越原平臺次數。
1.4.3 Western blot檢測大鼠海馬RAGE蛋白表達:大鼠斷頭處死后取海馬組織勻漿,4℃,12 000×g條件下離心,10 min,后取上清液,使用BCA蛋白定量試劑盒確定樣本蛋白濃度。將海馬蛋白樣品加入制備好的SDS-page膠中,電泳分離蛋白質,用濕轉法將蛋白轉到聚二氟乙烯 (PDVF)膜上。轉膜完成后將PVDF膜放于5%脫脂牛奶內,常溫下搖床封閉孵育2~3 h,加入一抗 (1∶1 000) 于4℃冰箱孵育過夜。第2天將膜取出用T-BST清洗 (5 min ×5),加入相對應的二抗 (1∶5 000) 孵育2 h。最后將膜用T-BST漂洗干凈后,加入化學發光液在凝膠成像儀 (tanon-5600 imaging system) 中顯影。蛋白條帶用AlphaImager 2200進行條帶灰度值掃描,以β-actin蛋白為內在參照,分析各組蛋白的表達水平。
1.4.4 Elisa檢測大鼠海馬AGEs含量:大鼠斷頭處死后取海馬組織勻漿,離心后收集上清液,使用BCA蛋白定量試劑盒確定樣本蛋白濃度。隨后遵照試劑盒說明書要求在96孔板上加入相同量的4組組織上清液及相應的試劑,在搖床上避光孵育30 min。最后用酶標儀在波長450 nm處檢測每孔的吸光度,計算出海馬中AGEs含量。
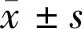
2 結果
2.1 亞精胺不影響STZ誘導的糖尿病大鼠血糖和體重水平 注射STZ (55 mg/kg) 后3 d,DM模型組、DM+低劑量Spd組和DM+高劑量Spd組大鼠血糖水平均顯著高于對照組。第28天,3組大鼠血糖水平仍顯著升高(P<0.05),同時DM模型組、DM+低劑量Spd組和DM+高劑量Spd組大鼠血糖水平無顯著差異(P>0.05)。注射STZ后每周測量1次體重:與對照組比較,DM模型組、DM+低劑量Spd組和DM+高劑量Spd組大鼠體重明顯降低(P<0.05),同時DM模型組、DM+低劑量Spd組和DM+高劑量Spd組大鼠體重無差異(P>0.05)。表明注射STZ導致大鼠DM狀態,但Spd不影響DM大鼠血糖水平和體重。見表1、2。
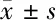
表1 4組大鼠空腹血糖水平比較 n=10,mmol/L,
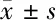
表2 4組大鼠體重水平比較 n=10,
2.2 亞精胺改善STZ誘導的糖尿病大鼠在水迷宮中的空間學習記憶 Morris水迷宮測試結果顯示:在定位導航期間,與對照組比較,DM模型組大鼠在試驗第2~5天的逃避潛伏期顯著延長(P<0.05),而DM+低劑量Spd組和DM+高劑量Spd組大鼠逃避潛伏期較DM模型組明顯縮短 (P<0.05),表明Spd給藥能明顯縮短DM大鼠的逃避潛伏期,改善DM大鼠的空間學習能力。在空間探索期:DM模型組大鼠在目標象限停留時間百分比和跨越平臺的次數明顯少于對照組,差異有統計學意義(P<0.05),而DM模型組、DM+低劑量Spd組和DM+高劑量Spd組的目標象限停留時間百分比和跨越平臺的次數較DM模型組明顯增加(P<0.05),表明Spd明顯提高DM大鼠的空間記憶能力。見表3、4。
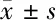
表3 水迷宮試驗中4組大鼠空間學習能力比較 s,
表4 水迷宮試驗中4組大鼠空間記憶能力比較
2.3 亞精胺下調STZ誘導的糖尿病大鼠海馬AGE/RAGE信號水平 Western blotting 和Elisa結果顯示:與對照組比較,DM模型組大鼠海馬組織中AGEs含量明顯增加,RAGE蛋白表達水平顯著上調(P<0.05);但DM+低劑量Spd組和DM+高劑量Spd組大鼠海馬組織中AGEs含量顯著減少,RAGE蛋白表達明顯下調(P<0.05),表明Spd明顯抑制DM大鼠海馬AGE/RAGE信號水平。見表5。
表5 4組大鼠海馬組織中AGEs含量和RAGE蛋白表達比較
3 討論
DM及其并發癥和治療可導致一過性或永久性的認知異常,這些異常是由急性和慢性血糖穩態紊亂引起的[2]。DM的患病率在全球范圍內急劇增加,2030預計將有5.52億患者[1]。隨著糖尿病的日益流行和人口老齡化,DACD預計將上升,并成為未來健康影響的一個挑戰。最近的研究表明,作為一種天然的促進自噬的多胺,飲食中的Spd具有保護健康和延長壽命的作用。Gupta等[7,8]發現膳食補充Spd可在果蠅中抑制年齡誘發的記憶損傷和保持突觸靈活性;后續研究中Spd也被證明可逆轉脂多糖誘導的小鼠記憶缺陷[9]。此外,腹腔或腦內注射Spd可顯著增強嚙齒動物在不同任務中的認知能力[10]。近期研究發現Spd影響老年小鼠在家庭環境任務中的行為,改善空間學習[11];并且在臨床試驗中Spd顯著提升老年人群及阿爾茲海默癥患者的認知表現[12,13]。
Morris水迷宮是主要用于測試實驗動物對空間位置感和方向感(空間定位) 的學習記憶能力,被廣泛應用于學習記憶、老年癡呆、海馬/外海馬研究等領域[14]。本研究中,我們通過一次性STZ腹腔注射構建DM認知障礙模型。水迷宮結果顯示:與正常對照組比較,大鼠DM制模成功4周后出現了學習記憶障礙,表現為逃避潛伏期明顯延長,在目標象限停留時間和跨越平臺的次數明顯降低;Spd干預后DM大鼠的逃避潛伏期明顯縮短,目標象限停留時間和跨越平臺的次數顯著增加。這些結果表明Spd改善DM大鼠的空間學習記憶障礙,驗證了Spd在預防DM模型記憶障礙方面的藥理活性。同時,我們結論與上述前人研究基本一致,進一步拓展了Spd在不同疾病模型中的學習記憶改善作用。
已有研究發現,Aβ-AGE通過RAGE通路加重了大鼠的認知障礙[15]。同時,DM與幾種腦血管內皮細胞功能障礙高度相關,如腦血管中脂質[16]和AGEs[17,18]過度積聚。隨后,這些變化導致血流減少,神經血管解偶聯,以及低氧應激引起的神經元損傷[19],最終導致腦梗塞和血管性癡呆的發病[20]。大量研究表明,AGE-RAGE通路的激活與DM患者的微血管和大血管功能以及認知功能障礙有關[21]。因此,我們推測Spd對DACD的拮抗作用可能涉及對AGE-RAGE通路的調控。結果顯示:與正常對照組比較,DM大鼠海馬組織中AGEs含量增加,RAGE蛋白表達上調;Spd干預后,DM大鼠海馬組織AGEs含量明顯減少,RAGE蛋白表達顯著下調,表明Spd抑制DM大鼠海馬AGE-RAGE信號通路。因此我們認為下調海馬AGE-RAGE信號通路參與了Spd對DACD的改善作用,這也提示海馬AGE-RAGE信號可能作為防治DACD的有效靶點。當前,炎性和氧化還原敏感的AGE-RAGE通路可作為阿爾茨海默病的治療靶點[22],這也佐證了我們的觀點。
綜上所述,Spd對STZ 誘導的DM大鼠認知功能障礙具有改善作用,其機制與抑制海馬AGE-RAGE信號通路有關。

