探討低氧環境下SDF-1 復合PLGA/膠原三維支架對間充質干細胞增殖和遷移的影響
姜楊,侯繼野,徐桂清,郭林娜,李永濤,沈雷,姚立杰
1.齊齊哈爾醫學院解剖教研室,黑龍江齊齊哈爾 161006;2.齊齊哈爾市建華醫院介入科,黑龍江齊齊哈爾 161006
隨著體育運動常見化,肌腱損傷也變得常見化。肌腱處于低氧微環境中,缺少血管滋養,組織再生能力較差[1],傳統手術不理想,如何修復損傷肌腱,是醫學領域需要主要解決的問題[2],許多學者制備復合肌腱材料來修復肌腱損傷[3]。聚乳酸-羥基乙酸共聚物[poly(lactic-co-glycolic acid), PLGA]為良好生物相容性和生物降解性可控的材料[4],但細胞粘附力低。膠原可被人體吸收,但力學性能較差,兩者結合有良好生物相容性和力學性能[5]。骨髓間充質干細胞(bone marrow mesenchymal stem cells,BMSCs)是肌腱組織工程常用的種子細胞之一[6]。基質細胞衍生因子-1(stromal cell derived factor,SDF-1)在損傷部位上調SDF-1 可募集循環系統或損傷部位的間充質干細胞和前體細胞到達損傷部位,修復受損組織[7-8]。本研究于2021年6 月—2022年6 月齊齊哈爾醫學院分子生物學實驗室制備PLGA∕膠原三維支架,在低氧環境下SDF-1 復合PLGA∕膠原三維支架誘導BMSCs 增殖和遷移,為闡明低氧環境下三維培養BMSCs 在肌腱組織工程應用提供實驗研究基礎。現報道如下。
1 對象與方法
1.1 研究對象
選取大鼠骨髓間充質干細胞進行試驗,隨機分為4 組,分別37℃,1%O2低氧箱內培養骨髓間充質干細胞為低氧對照組;37℃,1%O2低氧箱內PLGA∕膠原支架培養骨髓間充質干細胞為低氧P∕C 支架組;37℃,1%O2低氧箱內SDF-1 復合PLGA∕膠原支架為低氧S-P∕C 支架組;37℃,5%CO2培養箱培養為正常對照組。
1.2 實驗材料
材料:胎牛血清;DMEM 培養基;青鏈霉素;胰蛋白酶;4%多聚甲醛;大鼠骨髓間充質干細胞;大鼠SDF-1;PLGA;新鮮牛肌腱。
器材:超凈工作臺;二氧化碳恒溫細胞培養箱;三氣培養箱;倒置顯微鏡;SU3500 掃描電子顯微鏡;Transwell 小室;CCK-8 試劑盒;Emax 酶標儀;高速離心機;震蕩儀;靜電紡絲機(型號SS-2535DC)。
1.3 方法
①膠原的制備:采用李曉寅等[9]方法,將購買新鮮的牛肌腱作為原料,剔除周圍的肌肉、筋膜、血管、神經等結構,放入冰箱-10℃冷凍硬化,手術刀清理去除肌腱表面上殘余筋膜,洗凈后,切成薄塊,約1 cm,使用0.05 mol∕L Tirs 緩沖液浸泡24 h,收集沉淀物,含胃蛋白酶的醋酸消化后取上清液,加入3.5 mol∕L NaCl 溶液,收集鹽析沉淀,4℃去離子水透析5 d,測定濃度為4.5%。
②PLGA∕膠原三維生物材料支架的制備:PLGA和膠原按照75∶25 的質量比例溶解于六氟異丙醇(1,1,1,3,3,3-hexafluoroisopropanol, HFIP),室溫下磁力棒攪拌約24 h,配比制成10%的靜電紡絲液,設置靜電紡絲技術參數,正向電壓設置24 kV,噴絲毛細管口徑0.5 mm,針口距接收器距離12 cm,紡絲速度0.6 m∕s,紡絲環境的溫度和濕度分別為(26.0±0.5)℃和(40.0±0.7)%,接收裝置覆蓋鋁箔紙接收,噴射后得到固化PLGA∕膠原三維生物材料放入真空干燥箱內干燥24 h,掃描電子顯微鏡下觀察支架超微形態結構,等待實驗備用。
③骨髓間充質干細胞種植PLGA∕膠原三維生物材料支架:將PLGA∕膠原三維生物材料支架剪成圓片,直徑大小約為3 cm,放入培養皿中,在紫外線下消毒1~2 h,培養皿中加入青鏈霉素。加入殼聚糖緩釋的100 ng∕mL 濃度SDF-1,在紫外線下消毒1~2 h。將4×105個BMSCs 滴加到SDF-1 復合PLGA∕膠原三維生物材料支架上,于37℃,5%CO2和1%O2細胞培養箱中分別培養,激光共聚焦顯微鏡觀察。
④CCK-8 實驗檢測各組骨髓間充質干細胞增殖情況:按照以上細胞實驗分組,0.9×104cells∕孔BMSCs 種植96 孔細胞培養板,在培養第7 天利用CCK-8 試劑盒檢測BMSCs 增殖情況。按照CCK-8試劑盒說明,使用酶標儀450 nm 測定各組吸光度值(A 值),設置每組為5 個復孔。
⑤Transwell 實驗檢測各組骨髓間充質干細胞遷移情況:按照Transwell 試劑盒(8 μm 大小孔徑)說明書進行操作,將大鼠骨髓間充質干細胞用0.25%胰蛋白酶消化1~2 min,細胞計數器調整骨髓間充質干細胞密度約3×105個∕mL,將Transwell 小室置于24 孔板中,將制備的支架放入小室底面的通透膜上,取細胞懸液200 μl 加入無血清DMEM 的Transwell 小室的上室,在Transwell 小室下室中,對照組為500 μl 的DMEM 培養液,另外3 組分別為500μl DMEM 含120 ng∕mL 濃度SDF-1 因子復合PLGA∕膠原上清液的培養液和含PLGA∕膠原上清液的培養液,每組設3 個復孔,37℃,放入5% CO2培養箱和1% O2專用低氧箱內培養12 h,去除纖維支架,用無菌紗布擦去小室內底面的細胞,4%多聚甲醛固定20 min,0.1%結晶紫染色20 min,PBS 清洗兩次,在倒置顯微鏡下觀察,每個復孔隨機選取5 個視野進行拍照統計穿膜細胞數,取平均值,重復實驗3 次。
1.4 觀察指標
①檢測PLGA∕膠原三維生物材料支架微觀形態結構;②檢測各組骨髓間充質干細胞的增殖情況;③檢測各組骨髓間充質干細胞的遷移情況。
1.5 統計方法
采用SPSS 24.0 統計學軟件進行數據處理,符合正態分布的計量資料以(±s)表示,組間差異比較采用t檢驗;計數資料以[n(%)]表示,組間差異比較采用χ2檢驗,P<0.05 為差異有統計學意義。
2 結果
2.1 PLGA/膠原三維生物材料支架微觀結構觀察
掃描電鏡顯示PLGA∕膠原三維生物材料支架纖維表面光滑,縱橫交錯、粗細均勻、連續無斷裂,無顆粒串珠,空隙清晰規則,相互貫通,纖維直徑約為(680.10±3.54)nm,空隙直徑約為(3 160.50±6.89)nm,見圖1。
2.2 BMSCs 在PLGA/膠原三維生物材料支架生長情況
激光共聚焦顯微鏡觀察可見DiL 標記的BMSCs在PLGA∕膠原三維生物材料支架生長情況良好,纖維支架表面和間隙內均可見BMSCs,見圖2。
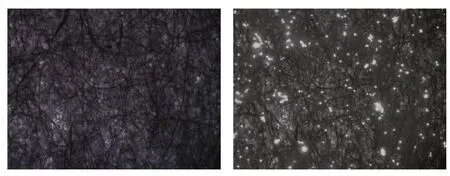
圖2 BMSCs 在PLGA/膠原三維生物材料支架生長情況
2.3 各組骨髓間充質干細胞活性比較
各組間骨髓間充質干細胞活性(吸光度值)比較,差異有統計學意義(P<0.05),見表1。
表1 各組骨髓間充質干細胞活性(吸光度A 值)比較(±s)

表1 各組骨髓間充質干細胞活性(吸光度A 值)比較(±s)
注:在培養第7 天,低氧對照組與正常對照組比較,差異有統計學意義(t=2.724,P=0.027);低氧P∕C 支架組與低氧對照組比較,差異有統計學意義(t=2.909,P=0.020);低氧S-P∕C 支架組與低氧P∕C 支架組比較,差異有統計學意義(t=2.486,P=0.038)
組別正常對照組(n=5)低氧對照組(n=5)低氧P∕C 支架組(n=5)低氧S-P∕C 支架組(n=5)A 值1.07±0.12 1.26±0.10 1.50±0.15 1.71±0.13
2.4 各組細胞骨髓間充質干細胞遷移數量比較
各組間比較,差異有統計學意義(P<0.05),見表2。
表2 各組細胞骨髓間充質干細胞遷移數量比較[(±s),×103個]
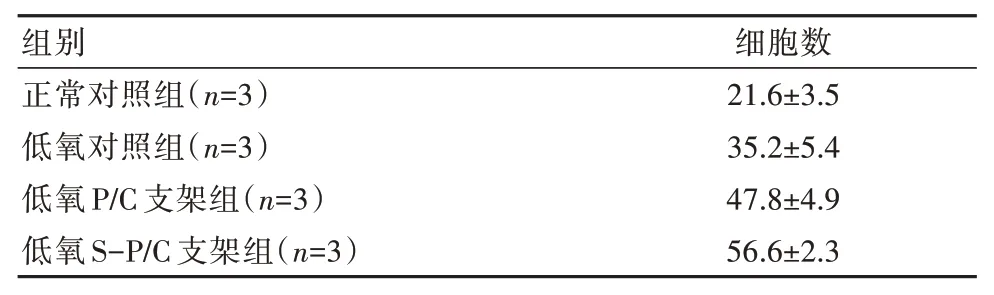
表2 各組細胞骨髓間充質干細胞遷移數量比較[(±s),×103個]
注:低氧對照組與正常對照組比較,差異有統計學意義(t=3.661,P=0.022);低氧P∕C 支架組與低氧對照組細胞比較,差異有統計學意義(t=2.993,P=0.040);低氧S-P∕C 支架組與低氧P∕C 支架組比較,差異有統計學意義(t=2.816,P=0.048)
組別正常對照組(n=3)低氧對照組(n=3)低氧P∕C 支架組(n=3)低氧S-P∕C 支架組(n=3)細胞數21.6±3.5 35.2±5.4 47.8±4.9 56.6±2.3
3 討論
隨著社會的快速發展,全球體育運動的興起,許多人都加入體育運動中。但是,許多人由于體育運動方式的不恰當或老齡化等因素導致肌肉損傷、斷裂等運動系統疾病。肌腱損傷是常見的運動系統疾病之一,據統計,全球每年約有3 000 萬例的肌腱損傷的病例[10],手術治療后容易發生再次斷裂[11]。肌腱組織工程給肌腱損傷治療帶來了希望。
3.1 肌腱組織工程支架材料
支架材料包括天然高分子材料、人工合成高分子材料、復合材料。天然高分子材料主要有膠原、蠶絲、小腸黏膜下層,具有可降解性、無毒,親水性和細胞粘附性好的優點,缺點為力學性能差、降解速度快、加工性差。人工合成高分子材料主要有聚乳酸(polylactic acid, PLA)、聚羥基乙酸(polyglycolic acid, PGA)、聚乳酸-聚羥基乙酸共聚物(PLGA)3種,優點是來源廣泛、易加工、可降解,缺點為細胞親水性差、細胞粘附性差。復合材料由天然材料和人工合成材料復合而成,取兩者的優點,具有力學性能好、降解性好、細胞粘附性好等特性。本研究掃描電鏡結果顯示PLGA∕膠原三維支架纖維粗細均勻、光滑無結節、孔隙率高、且相互連通。激光共聚焦顯微鏡下可見細胞在支架材料生長情況良好,在纖維空隙內和表面可見細胞黏附,細胞和三維支架相容性良好。
3.2 基質細胞衍生因子-1
基質細胞衍生因子-1(SDF-1)作為趨化因子,即CXCL12,CXCR4 作為趨化因子CXC 受體,兩者親和力極高,SDF-1 和CXCR4 結合后可以產生定向遷移的作用,能趨化骨髓間充質干細胞、造血干細胞、內皮祖細胞、腫瘤細胞等。上調SDF-1 有效的召集間循環系統或損傷部位間充質干細胞和前體細胞到達損傷部位,修復損傷部位[12]。
3.3 肌腱組織工程支架性能
CCK8 實驗表明,在細胞培養第7 天,正常對照組吸光度值為(1.07±0.12)、低氧對照組吸光度值為(1.26±0.10)、低氧PLGA∕膠原支架組吸光度值為(1.50±0.15)、低氧SDF-1 復合PLGA∕膠原支架組吸光度值為(1.71±0.13),姜楊等[13]研究低氧PLGA∕膠原支架組是低氧對照組的(1.350±0.545)倍,低氧對照組是正常對照組的(1.417±0.55)倍,同時與王洋等[14]認為CXCL12∕CXCR4 軸增加BMSCs 生存活性及增殖等作用相一致,在第7 天吸光度值低氧S-P∕C 支架組為最大。Transwell 實驗結果可見,與正常對照組比較,低氧對照組細胞遷移數量相對表達量增高;與低氧對照組比較,低氧PLGA∕膠原支架組細胞遷移數量相對表達量增高(P<0.05);與低氧PLGA∕膠原支架組比較,低氧SDF-1 復合PLGA∕膠原支架組細胞遷移數量相對表達量增高(P<0.05),說明在低氧環境下,細胞具有一定遷移性,趨化因子SDF-1 與其受體CXCR4 之間相互作用是BMSCs 趨化過程的主要調節因素,與郝璐等[15]研究發現低氧條件可增強BMSCs 的遷移能力,而在加入SDF-1 的刺激下,BMSCs 遷移能力較大提升的結論相一致。
綜上所述,體外實驗模擬肌腱周圍低氧環境,SDF-1 復合PLGA∕膠原三維立體支架對骨髓間充質干細胞的增殖和遷移影響,實驗結果相對二維空間更具準確性,證實SDF-1 復合PLGA∕膠原支架三維立體支架具有良好的生物相容性,可有效促進細胞的增殖和遷移。下一步進行建造動物肌腱損傷模型,在動物體內放入三維仿生支架,評價仿生三維支架對肌腱損傷的修復影響,為治療肌腱損傷提供有力的理論基礎。

