稀釋和熟化對鈦鹽絮凝效果及混凝機制的影響
趙 旭, 連會情, 趙艷俠, 許偉穎, 辛曉東, 賈瑞寶
(1. 濟南大學 水利與環境學院, 山東 濟南 250022; 2. 濟南市供排水監測中心, 山東 濟南 250014)
混凝是污水處理過程中常用的操作單元之一, 廣泛應用于給水的凈化處理, 具有成本低、 易操作的特點, 可以有效去除水中的污染物。 目前, 較常用的混凝劑是鋁鹽和鐵鹽混凝劑, 然而鋁系混凝劑存在鋁鹽殘留問題, 具有生物毒性[1], 鋁元素進入人體會導致記憶喪失, 進而誘發阿爾茨海默病, 鐵鹽會造成出水著色。 此外, 鋁鹽和鐵鹽在混凝后均產生大量污泥, 處理不當會對環境造成二次污染[2-3]。
地球上鈦資源豐富,儲量僅次于鐵、 鋁、 鎂[4]。鈦元素沒有生物毒性[5],廣泛應用于塑料、 橡膠、 造紙、 醫藥及電子材料等。氯化鈦(TiCl4)作為一種新型水處理劑,具有良好的除濁和脫色效果[6-9]。在去除水體的顆粒物和有機物等方面,鈦鹽的去除效果與鋁鹽、 鐵鹽相近,且鈦鹽產生的絮體粒徑明顯更大,致密性強,沉降性能更加優良[10]。Shon等[11]研究發現,TiCl4混凝后所產生的污泥在經過高溫煅燒后可以生成二氧化鈦(TiO2),為污泥的處理提供了一條新途徑。
目前, 鈦鹽混凝劑的研究已經從單體鈦鹽逐漸轉向無機高分子類型以及各種復合類型[12-15], 并且重點在于聚合鈦鹽混凝劑的制備與應用。 Zhao等[10]采用微量滴堿法制備聚合氯化鈦(PTC), 結果發現, PTC比TiCl4能更有效地去除水體中的有機物, 同時, 使用電噴霧電離飛行時間質譜法(ESI-TOF-MS)分析了鈦的水解產物及其分布, 證明了從Ti1到Ti20核的單核及多核羥基鈦的存在。 ESI-TOF-MS首先將鈦的聚合物在質譜儀中轉化為氣相, 然后在質譜儀中檢測到不同的粒子質量與電荷之比(簡稱質荷比)的峰, 不同的質荷比有不同的響應強度。 黃鑫[16]采用復合法和共聚法合成了聚合硅酸硫酸鈦(PTSS)和聚合硅酸氯化鈦(PTSC), 具有高效的濁度和有機物脫除效能。 綜上所述, 鈦鹽混凝劑因具有高效、 無毒的特性而受到越來越多的關注。
影響鈦鹽混凝效果的因素有很多,目前,研究者們主要針對鈦鹽混凝劑種類、 投加量、 水溫和pH等因素進行研究。鈦鹽混凝劑的水解速度比傳統鋁鹽、鐵鹽混凝劑的更快,鈦鹽在使用過程中的稀釋和熟化將會對其絮凝效能產生重要影響,關于這方面的研究還鮮有報道,因此,本文中重點研究稀釋和熟化對鈦鹽絮凝效能及其混凝機制的影響,為鈦鹽混凝劑的實際工程應用提供參考。
1 實驗
1.1 材料
氯化鈦(TiCl4,上海阿拉丁生化技術有限公司),純度(質量分數)99.0%,冰水浴稀釋至TiCl4質量分數為20%的溶液[10]。以上述TiCl4溶液和質量濃度為200 g/L的氫氧化鈉(NaOH)溶液為原料,在磁力攪拌作用下,采用慢速滴堿法在室溫下制備PTC(堿度為1.5)。通過移液槍將NaOH溶液逐滴加到TiCl4溶液中,滴入NaOH液滴時會產生白色絮狀懸浮物,在磁力攪拌作用下,白色絮狀懸浮物逐漸減少, 待白色絮狀懸浮物完全消失后再繼續滴加。以硫酸鈦(Ti(SO4)2,日本關東化學株式會社)和NaOH溶液為原料制備聚合硫酸鈦(PTS,堿度為1.5),制備方法同上。
實驗水樣來自光大水務(濟南)有限公司二廠中水, 水中有機物在波長為254 nm的紫外光下的吸光度UV254為(0.095±0.002) cm-1, 濁度為(1.0±0.1) NTU, pH為7.8±0.2, Zata電位為(-5.8±1.0)mV。
1.2 混凝劑的稀釋和熟化
鈦鹽混凝劑投加量以鈦離子的質量濃度計,數值為5~30 mg/L。分別將TiCl4、 Ti(SO4)2、 PTC、 PTS混凝劑稀釋0~9倍, 經一定熟化時間后應用于后續混凝實驗。
1.3 混凝實驗
采用六聯攪拌機(MY3000-6F型, 武漢市梅宇儀器有限公司)在轉速為200 r/min的條件下攪拌1.5 min, 在此階段加入混凝劑, 隨后以轉速為40 r/min攪拌15 min后靜置15 min。 在液面下2~3 cm處取上清液用便攜式濁度儀(100Q型, 山東振強國際貿易有限公司)、 紫外可見分光光度計(TU-1810型, 北京普析通用儀器有限責任公司)和納米粒徑電位分析儀(Zetaszier Nano-ZS90型, 英國馬爾文公司)分別測量濁度、 UV254和Zata電位。
2 結果與討論
2.1 稀釋對混凝劑絮凝效果和混凝機制的影響
2.1.1 稀釋實驗結果
圖1所示為稀釋有機物去除率的影響。由圖可以看出:稀釋提高了TiCl4絮凝效能,實驗水樣中有機物去除率顯著提升。稀釋9倍后的TiCl4的有機物去除率都優于未稀釋前的。特別是,當混凝劑投加量為20 mg/L時,提升作用尤為明顯(見圖1(a))。反觀PTC, 在稀釋后, 有機物去除率降低(見圖1(b))。 在混凝劑投加量為5~30 mg/L時,PTC經稀釋后其有機物去除率都明顯降低。
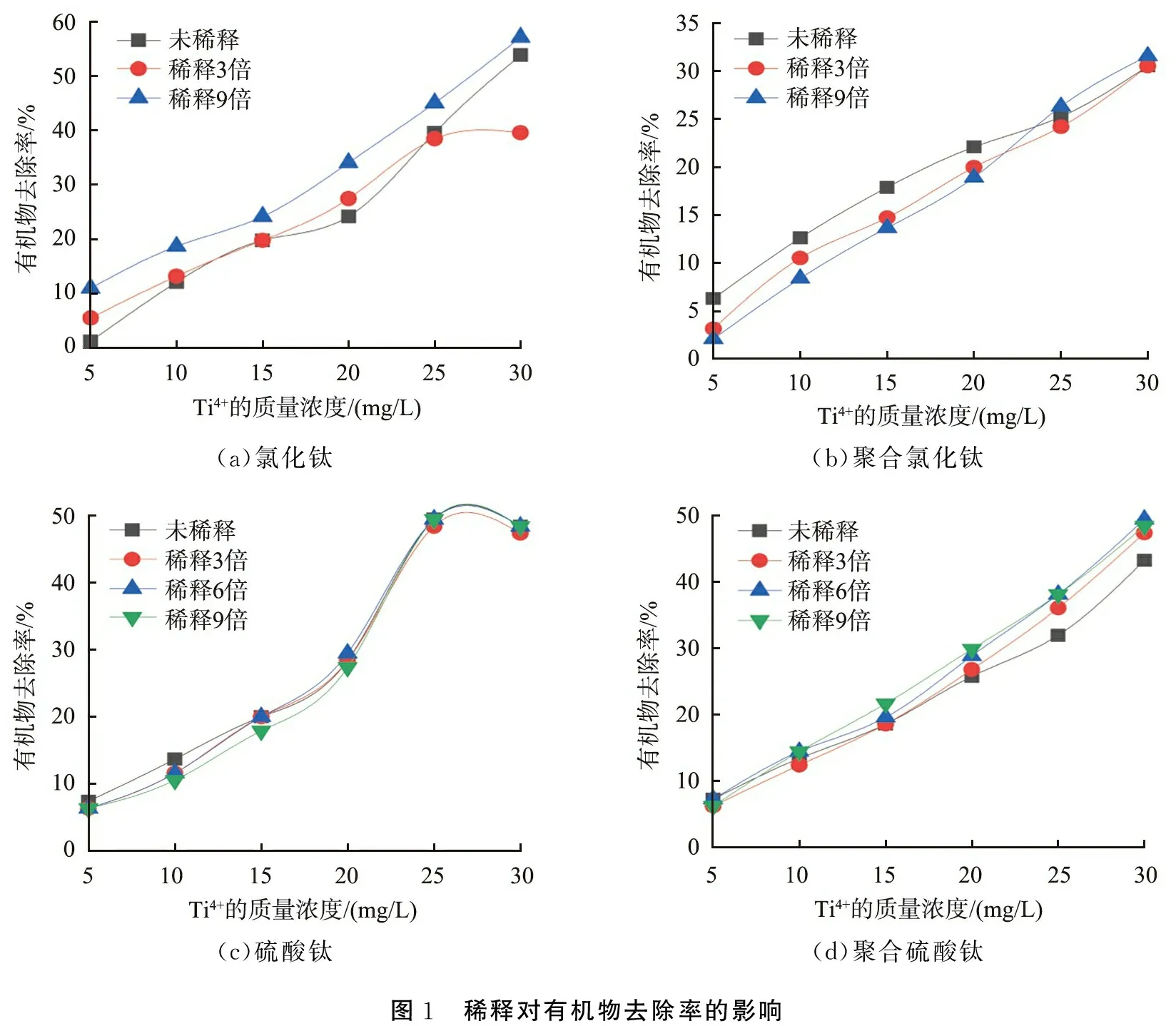
對于Ti(SO4)2,在所研究的稀釋倍數范圍(3~9倍)內,其絮凝效能受到的影響較小(見圖1(c)),說明稀釋對Ti(SO4)2的水解形態影響很小。對于PTS,當投加量大于20 mg/L時,稀釋后的PTS對有機物去除率有較明顯的提高(見圖1(d)),表明PTS在稀釋后能水解產生優勢絮凝形態,從而促進其絮凝效能的發揮。
圖2 所示為稀釋對出水濁度的影響。由圖可以看出: TiCl4經稀釋后產生了優勢絮凝形態,使出水濁度減小,在投加量為15~25 mg/L時較為明顯(見圖2(a))。當投加量較小時,PTC經稀釋后的混凝出水濁度增大,隨著投加量增加,出水濁度逐漸與未稀釋的相當(見圖2(b)),這是由稀釋后原絮凝形態被破壞且不夠穩定所致。
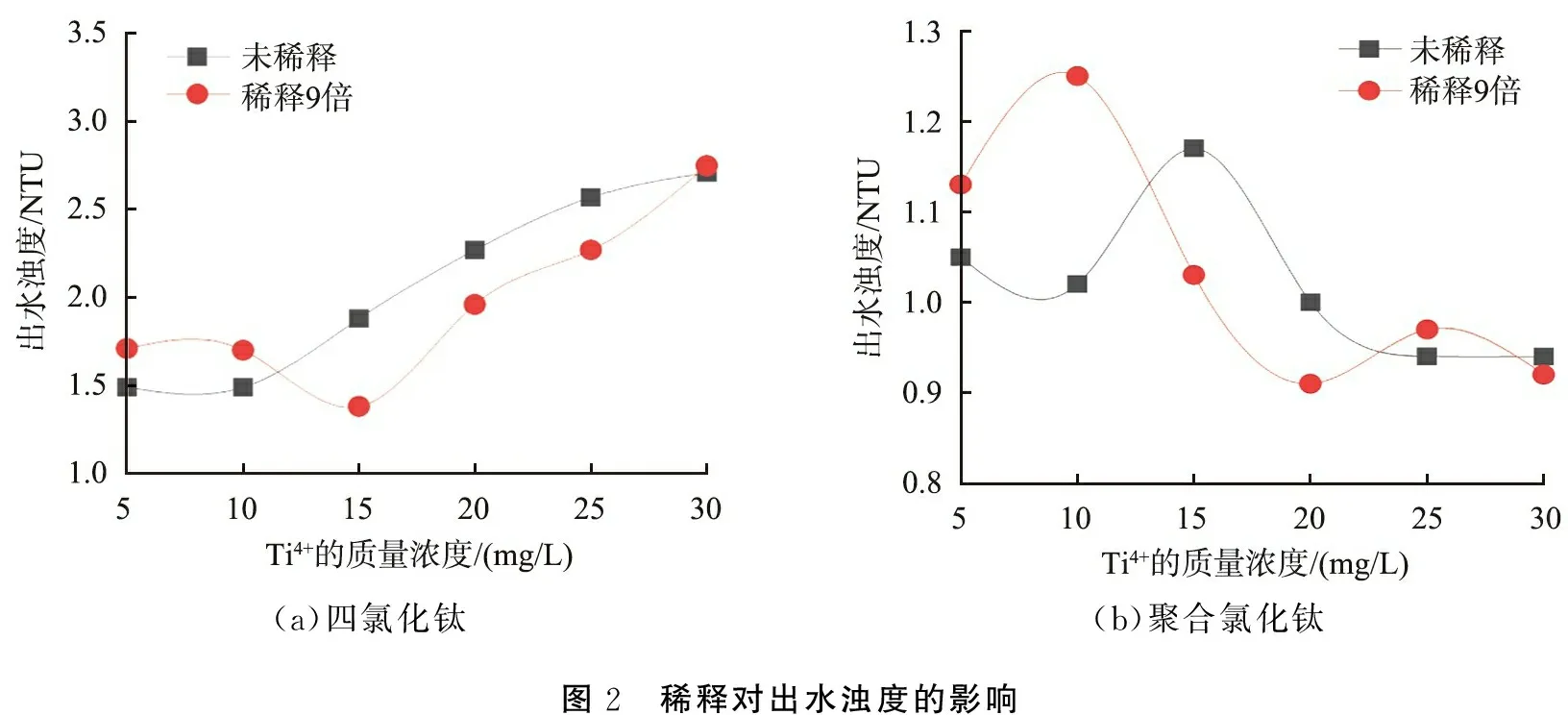
實驗結果表明,稀釋能促使TiCl4發生進一步水解,促進優勢絮凝形態的產生,但PTC不同于TiCl4,在其加入到實驗水樣中之前,絮凝形態已經形成,此時稀釋導致水解產物進一步水解,絮凝形態發生改變,原優勢絮凝形態被破壞,從而導致絮凝效能降低,出水濁度變化不大。
2.1.2 混凝機制
絮體Zata電位的變化見圖3。 可以看出: 當TiCl4的投加量增大時, 絮體Zata電位也隨之增大且由負值變為正值(見圖3(a)), 表明TiCl4的混凝機制以吸附電中和為主。 在所研究的PTC投加量范圍(5~30 mg/L)內, 絮體Zata電位為(-6.27±1.18)mV, 變化并不明顯(見圖3(b)),說明PTC的混凝機理以網捕卷掃為主。
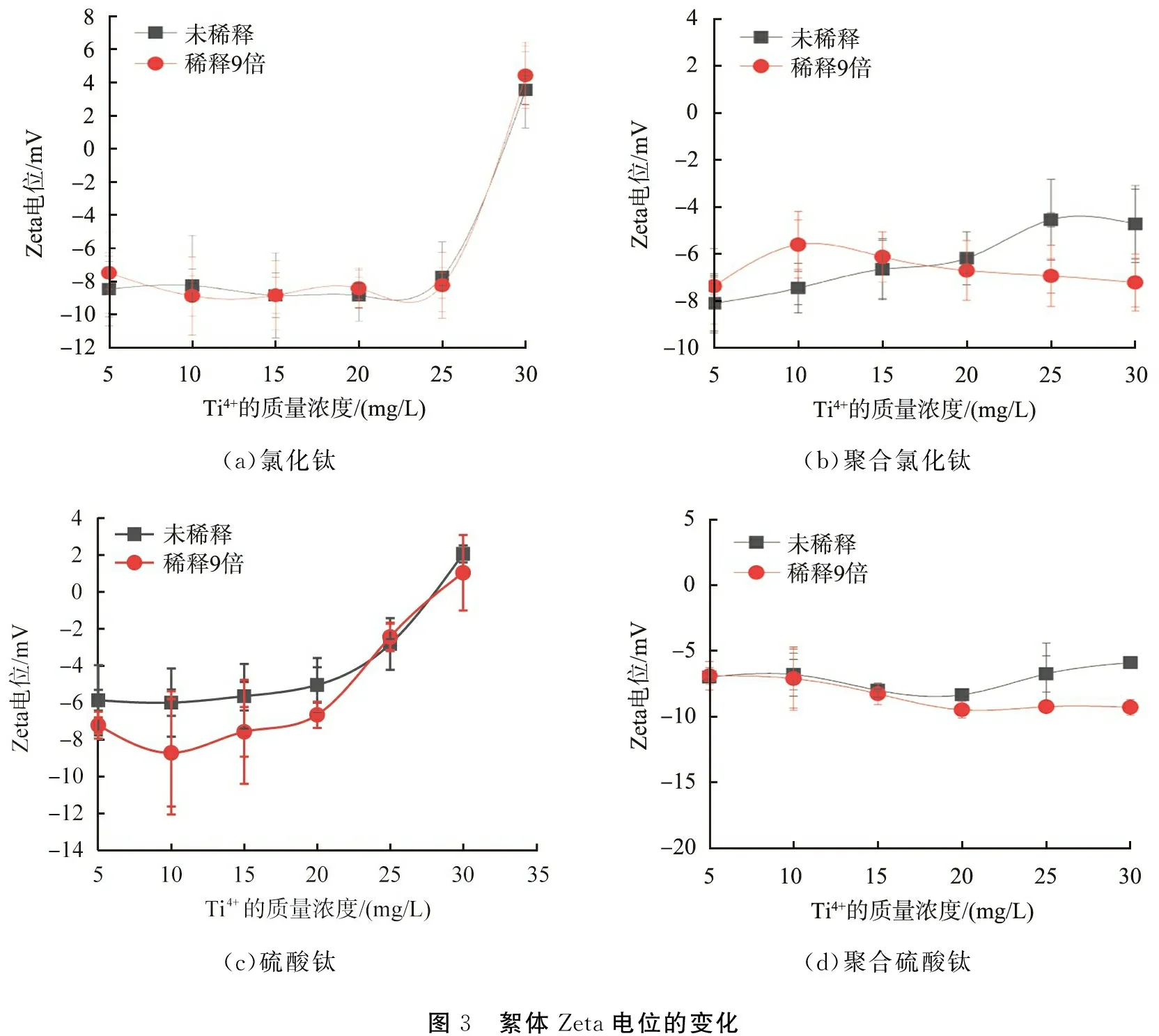
稀釋對Ti(SO4)2絮體Zeta電位的影響并不大,并且隨著投加量的增大,絮體Zeta電位呈現增大趨勢(見圖3(c)),表明在所研究的投加量范圍(5~30 mg/L)內,其混凝機制以吸附電中和為主。與Ti(SO4)2相比,PTS絮體的Zata電位隨投加量的變化不明顯(見圖3(d)),在投加量為5~30 mg/L時,絮體Zata電位為(-7.12±1.21) mV,表明在此投加量范圍內,其混凝機制以網捕卷掃為主。
2.2 熟化對混凝劑絮凝效能的影響
圖4所示為熟化對混凝劑有機物去除率的影響。 由圖4(a)可以看出: 隨著熟化時間的延長, TiCl4對有機物的去除率呈先增大后減小的趨勢, 說明在較短的時間內, TiCl4發生自水解產生優勢絮凝形態, 促進絮凝效能的發揮。 當熟化時間延長時, TiCl4繼續水解, 破壞了原有的優勢絮凝形態, 使絮凝效能下降。
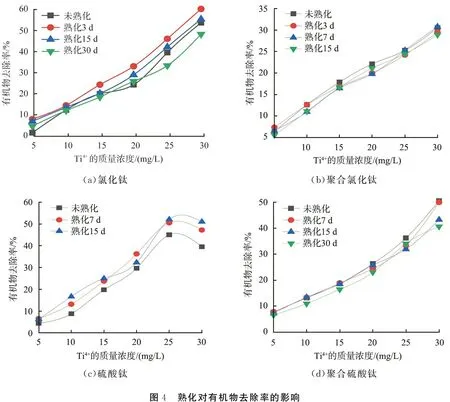
由圖4(b)可以看出, 與TiCl4相比, PTC的熟化時間范圍(0~30 d)內, 絮凝效能受影響的程度較小, 說明PTC在制備過程中形成了較穩定的絮凝形態并可以長久穩定, 因此熟化對其絮凝效果影響較小。
經過一定的熟化時間后, Ti(SO4)2對有機物的去除率升高, 當投加量為10 mg/L時, 熟化15 d的Ti(SO4)2對有機物去除率提高了6%左右(見圖4(c)), 而對于PTS, 在熟化30 d后, 當投加量為30 mg/L時, 對有機物去除率下降了10%左右(圖見4(d))。 上述結果說明: 經歷一定的熟化時間后,Ti(SO4)2逐漸發生水解, 水解產物有利于促進絮凝效能的發揮; PTS不同于Ti(SO4)2, 在加入到實驗水樣中之前絮凝形態已經形成, 但隨著熟化時間的延長, 水解產物發生了變化, 新的水解產物并非優勢絮凝形態, 絮凝效果弱于熟化前的, 導致有機物去除能力降低。
3 結論
本文中研究了稀釋和熟化對鈦鹽絮凝效能和混凝機制的影響,得到如下結論:
1)稀釋可促使TiCl4和PTS水解產生優勢絮凝形態;熟化可促進TiCl4和Ti(SO4)2水解產生優勢絮凝形態,提高它們的絮凝效能。
2)在所研究的熟化時間范圍(0~30 d)內,PTC的絮凝效能受影響較小,說明其具有較強的穩定性。PTS的絮凝效能隨著熟化時間的延長有一定程度的下降。
3)在所研究的混凝劑投加量范圍(5~30 mg/L)內,TiCl4和Ti(SO4)2的混凝機制以吸附電中和為主,PTC和PTS的混凝機制以網捕卷掃為主。

