血清成纖維細胞生長因子23對兒童低血磷性佝僂病的診斷價值研究
董沙沙 車若琛 鄭必霞 張愛華 王春莉 白咪 陳穎
(1.南京醫科大學附屬兒童醫院腎內科,江蘇南京 210000;2.南京醫科大學附屬兒童醫院兒科學重點實驗室,江蘇南京 210000)
遺傳性低血磷性佝僂病/骨軟化癥是一組罕見的由鈣磷代謝紊亂引起的骨礦化異常性疾病,兒童主要表現為下肢畸形、身材矮小、牙釉質發育不全等[1]。根據其病因不同,可分為多種類型,最常見的是由X連鎖磷酸調節中性肽酶同源物基因(phosphate-regulating gene with homologies to endopeptidases on the X chromosome,PHEX基因)突變引起的X 連鎖顯性低血磷性佝僂病(X-linked dominant hypophosphatemic rickets,XLH或XLHR),發病率為1∶20 000~1∶25 000,占遺傳性低血磷性佝僂病的80%以上。PHEX基因定位于染色體Xp22.1,其編碼的蛋白質可下調成纖維細胞生長因子23 (fibroblast growth factor 23,FGF23) 表達。FGF23 可降低腎近曲小管刷狀緣膜上的鈉-磷協同轉運蛋白Ⅱa、Ⅱc 數量,從而增加腎臟的磷排泄[2],也可通過抑制CYP27B1基因編碼的1α-羥化酶表達,刺激CYP24A1基因表達編碼24-羥化酶,減少1,25-二羥維生素D3,間接抑制腸道吸收磷,是XLH 的作用靶點。FGF23 活性形式為完整成纖維細胞生長因子23(intact fibroblast growth factor 23,iFGF23),當其N 端信號肽被去除,Arg179 和Ser180之間的蛋白水解裂解將產生2個非活性片段(N-FGF23、C-FGF23)[3],其中iFGF23的生物學功能最為活躍,能有效反映FGF23 與磷酸鹽負荷的關系。目前國內外尚未統一FGF23正常濃度范圍,而測量試劑盒種類多樣,其中日本Kainos 公司試劑盒一致性及穩定性較好[4]。
低血磷性佝僂病需結合臨床表現、實驗室檢查、影像學及基因檢測明確診斷,但基因檢測周期長、成本高,不利于低血磷性佝僂病的早期發現。我國低血磷性佝僂病患兒生存狀況調查分析顯示,患兒首次就醫未確診比例高達72.57%,60%以上經歷過誤診,根據我中心研究數據,低血磷性佝僂病患兒平均確診時長為42 個月,平均需去3家醫院才能確診[5]。早期診斷和治療可改善骨骼礦化代謝,避免嚴重下肢畸形與生長遲緩[6]。靈敏度高、特異度強的生物標志物是低血磷性佝僂病早診斷、早治療的關鍵。另一方面,布羅索尤單抗(burosumab)是FGF23 的單克隆抗體,可改善腎小管磷酸鹽重吸收、血清磷水平和線性生長[7-8],已被列為低血磷性佝僂病的一線治療用藥,但尚缺乏特異性的監測指標。目前,FGF23濃度研究主要集中于歐美及日本成人慢性腎臟病、腫瘤性骨軟化癥患者[9-10],故本課題組擬通過橫斷面研究探討正常及患病兒童FGF23 濃度,分析其診斷價值,并探究其相關因素,為低血磷性佝僂病患兒的診斷提供依據。
1 資料與方法
1.1 研究對象
以我院2016 年1 月—2021 年6 月期間收治的28 例低血磷性佝僂病患兒為佝僂病組,男性20 例(71%),女性8 例(29%);0~<5 歲7 例(25%),5~<10 歲11 例(39%),10~<18 歲10 例(36%);XLH患兒24例(86%),臨床診斷為低血磷性佝僂病但基因檢測陰性者4 例(14%)。身高(長)測量用于評估患兒生長情況,并使用國際兒童和青少年在線輔助計算器將身高轉化為Z評分[11]。
納入標準:(1)0~<18歲經基因檢測或臨床符合低血磷性佝僂病診斷標準[12]的患兒;(2)入組前停服磷酸鹽制劑及維生素D至少2周;(3)無其他伴隨疾病,入組家屬對本次研究知情同意。排除標準:(1)入組前使用腎毒性藥物;(2)患有肝性、腎性、內分泌功能障礙疾病。
以隨機抽樣方法隨機抽取2021 年6—7 月就診于南京醫科大學附屬兒童醫院兒童保健科的40 例健康體檢兒童為健康對照組,男性32 例(80%),女性8例(20%)。納入標準:(1)0~<18歲健康兒童;(2)近2 個月無服用磷酸鹽、維生素D 制劑;(3)檢驗其肝腎功能、電解質、尿鈣、尿磷均正常;(4)家族中無相關遺傳性、慢性及其他異常疾病史。
本研究經南京醫科大學附屬兒童醫院倫理委員會批準(202103041-1)。
1.2 基因檢測
22例(79%)患兒基因檢測采用二代測序,由北京邁基諾基因科技股份有限公司完成;6 例(21%)患兒采用PHEX基因靶向檢測。4例基因檢測陰性者有3 例采用PHEX基因靶向檢測,1 例為二代測序。
1.3 實驗室檢查
隔夜空腹至少8 h以上取血,由我院檢驗科測定生化指標、甲狀旁腺素(parathyroid hormone,PTH)、25-羥維生素D[25-hydroxyvitamin D,25(OH)D]、尿磷、尿肌酐。生化指標分析包括:血磷、血鈣、血鉀、血鈉、血氯、血鎂、血肌酐、總蛋白、 堿性磷酸酶(alkaline phosphatase,ALP),根據Walton等[13]的列線圖計算腎小球濾過率校正的腎臟磷最大重吸收率即腎小管最大磷吸收/腎小球濾過率(renal tubules absorbed maximum phosphorus/glomerular filtration rate,TmP/GFR)。
檢測FGF23 濃度:全血樣本采集當日離心分離血清,所有血清樣本均存儲于-80℃低溫凍存,避免反復凍融。采用雙抗夾心酶聯免疫吸附法進行iFGF23 測定,試劑盒購于Kainos 公司,該試劑盒iFGF23 測定范圍為3~800 ng/L。測定步驟:準備試劑及標準品,所有待測患兒血清提前一晚置于4℃冰箱解凍;取50 μL緩沖液加入每個微孔中;取50 μL FGF23標準品稀釋液或待測血清分別加入相應微孔,覆鋁膜以避光,置于搖床上室溫孵育2 h;移去覆膜,洗板4 次,每次每孔加入300 μL洗液,最后完全移除洗液;每微孔中加入100 μL HRP標記的FGF23抗體,覆膜,室溫搖床孵育1 h;移去覆膜,洗板4 次,最后完全移除洗液;取100 μL 底物加入每孔,覆膜,置于鋁箔避光室溫孵育30 min;移除鋁箔和覆膜,每孔立即加入100 μL 反應終止液,覆膜輕搖1 min;用酶標儀在10 min 內讀取450 nm(第二波長取600 nm)的吸光度,計算各孔iFGF23 濃度。結果由標準品的濃度和光密度值繪出的標準曲線圖及直線回歸方程得出。
1.4 資料收集
收集兩組兒童的資料,包括:(1)年齡、性別、身高(長);(2)血清FGF23、電解質(鉀、鈉、氯、鈣、磷、鎂)、ALP、25(OH)D、血肌酐、血總蛋白、尿肌酐、尿磷等結果,其中血肌酐、尿肌酐、尿磷用于計算TmP/GFR。兒童不同年齡段血磷及ALP 正常范圍參照2021 年我國國家衛生健康委員會頒布的兒童臨床常用生化檢驗項目參考區間[14]。
1.5 統計學分析
采用SPSS 26.0 對數據進行統計學分析。作圖采用GraphPad Prism 9.0.1軟件。正態分布的計量資料用均值±標準差(±s)表示,組間比較采用兩樣本t檢驗;非正態分布的計量資料用中位數(四分位數間距)[M(P25,P75)]表示,組間比較采用Mann-WhitneyU檢驗。計數資料以例數和百分率(%)表示,組間比較采用卡方檢驗。偏態分布或等級變量的相關性分析采用Spearman秩相關。采用受試者操作特征曲線分析FGF23 對兒童低血磷性佝僂病的診斷價值。P<0.05 表示差異有統計學意義。
2 結果
2.1 兩組兒童臨床資料比較
佝僂病組共28 例,18 例(64%)系家族遺傳性病例,其中16 例來自母親,2 例來自父親;10例(36%)系散發病例。24例PHEX基因突變患兒中,共檢出18 個不同的基因突變分布(圖1),其中截短突變14 例(58%),非截短突變10 例(42%)。佝僂病組與健康對照組的性別、年齡、血鉀、血鈉、血氯比較差異無統計學意義(P>0.05)。佝僂病組血清FGF23、ALP 水平高于健康對照組(P<0.01),血磷、血鈣、血鎂、血總蛋白低于健康對照組(P<0.05)。見表1。
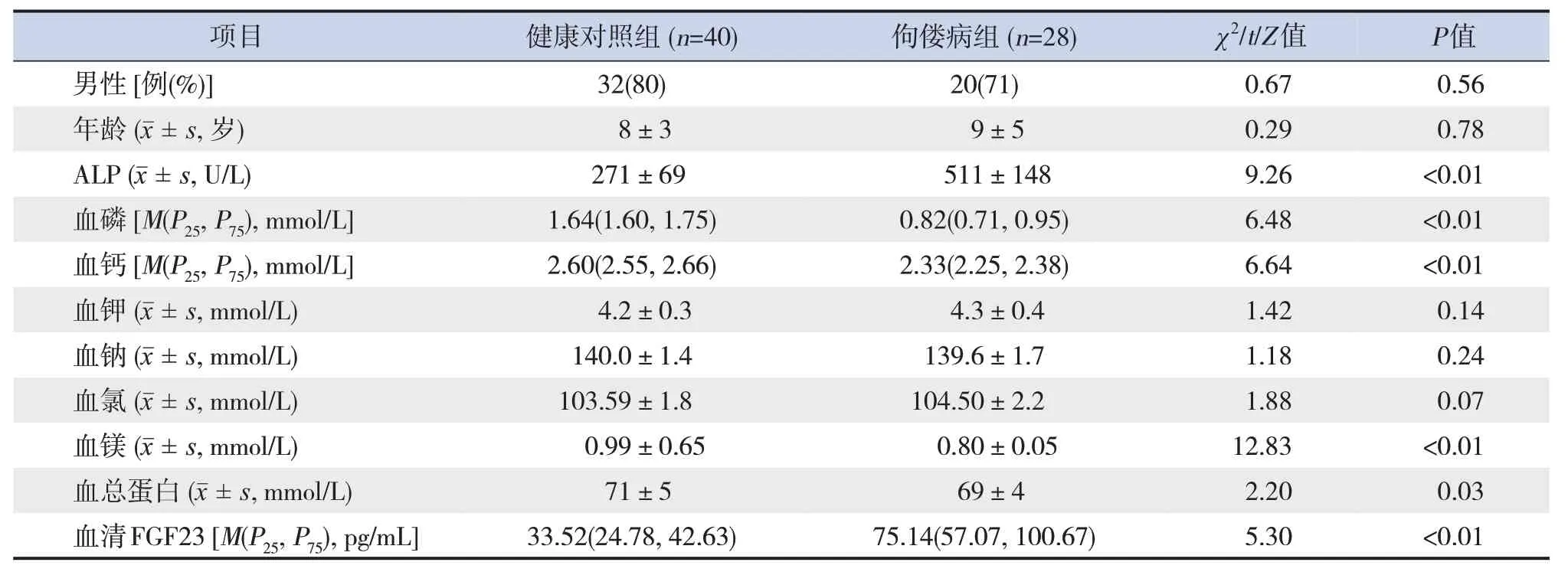
表1 兩組兒童臨床資料比較
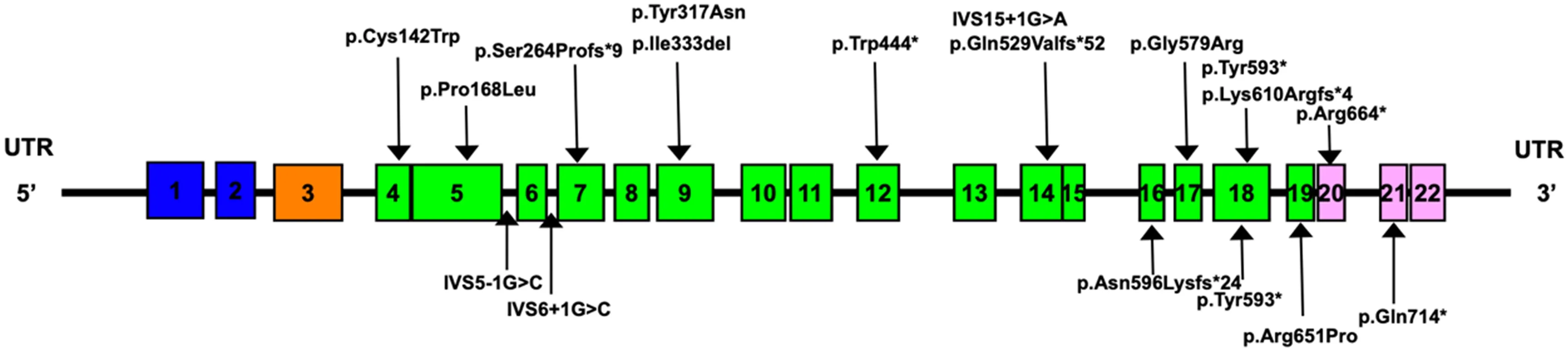
圖1 PHEX基因外顯子結構 圖中方框為外顯子結構,箭頭所指為本研究中確定的18個突變位點堿基位置。
2.2 佝僂病組患兒血清 FGF23與臨床指標的關系
Spearman 秩相關分析顯示,低血磷性佝僂病患兒血清FGF23 濃度與TmP/GFR 呈顯著負相關(rs=-0.64,P<0.01),與ALP、25(OH)D 呈正相關(分別rs=0.38、0.39,均P=0.04),見圖2。年齡(rs=-0.04,P=0.84)、身高Z 評分(rs=-0.25,P=0.20)、性別(rs=-0.12,P=0.23)、PTH(rs=-0.04,P=0.87)與血清FGF23濃度無顯著相關性。
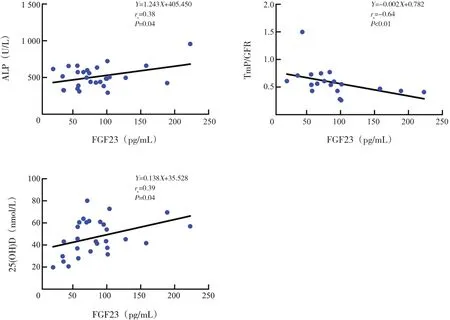
圖2 低血磷性佝僂病患兒血清FGF23與ALP、25(OH)D、TmP/GFR的相關性分析圖
2.3 繪制血清FGF23對診斷低血磷性佝僂病的受試者操作特征曲線
受試者操作特征曲線分析結果顯示,FGF23診斷低血磷性佝僂病的曲線下面積為0.874(95%CI:0.782~0.965),約登指數為0.746,靈敏度為0.821,特異度為0.925,陽性預測值為0.885,陰性預測值為 0.881, 最佳截斷值為 55.77 pg/mL (P<0.01),見圖3。
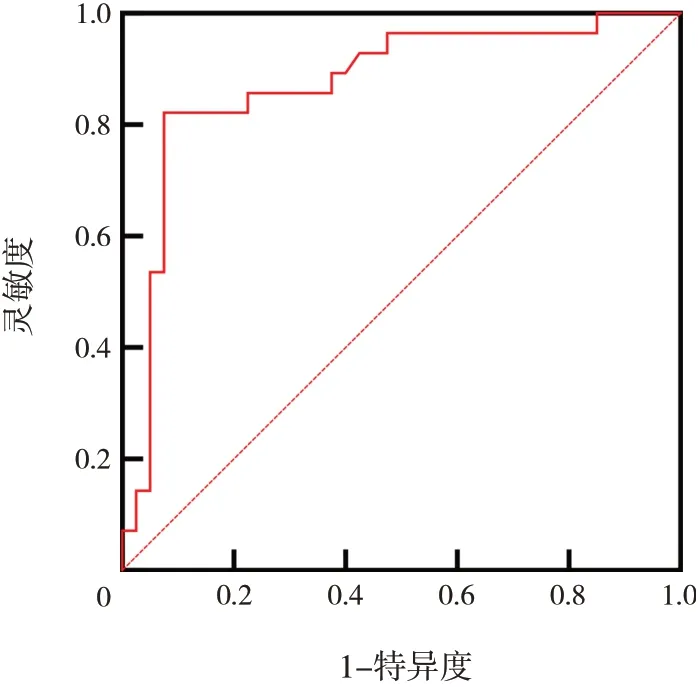
圖3 FGF23診斷低血磷性佝僂病的受試者操作特征曲線
3 討論
本研究利用日本Kainos 公司試劑盒對兩組兒童進行iFGF23 水平檢測,結果顯示,佝僂病組血清FGF23濃度高于健康對照組,與Endo等[15]研究結果一致。一項納入227 例兒童的橫斷面研究中,血清FGF23 濃度為(44±37)pg/mL,但該研究中半數兒童為腎功能異常者,不能代表正常兒童的水平[16]。Jonsson 等[17]報道26 例兒童[(10.9±5.5)歲]FGF23 濃度為(69±36)mL/RU。本研究中健康對照組兒童血清FGF23 濃度為33.52(24.78,42.63)pg/mL,與Smith 等[10]測量健康人群FGF23 濃度為11.7~48.6 pg/mL 大致相似(年齡25~62 歲,晨起空腹8:00—10:00)。本研究相關性分析結果顯示XLH患兒FGF23濃度并無性別差異,與Ichikawa 等[18]的關于小鼠體外FGF23 與性別劑量效應的研究結果一致,具體機制尚不清楚,可能與X染色體隨機失活、等位基因表達差異有關。
本研究發現健康對照組和佝僂病組FGF23、血鎂、總蛋白、血磷、血鈣水平差異有統計學意義。低血磷性佝僂病患兒由于內環境穩態被打破,除鈣磷代謝異常外可能伴有其他電解質紊亂。Hamano[19]在低鎂與骨密度的相關性研究中發現,低鎂可能是導致營養不良患兒骨密度改變的重要因素,所以對于蛋白質營養不良的低血磷性佝僂病患兒,尤其是合并低鎂血癥者,早期加鎂治療可能對改善骨骼礦化具有重要意義。
診斷方面,本研究顯示FGF23 診斷低血磷性佝僂病的曲線下面積為0.874,最佳截斷值為55.77 pg/mL,與FGF23 預測腫瘤性骨軟化癥的靈敏度(86%)[20]相似,提示FGF23作為診斷低血磷性佝僂病生物標志物的效能較高。Ito 等[21]分析FGF23 診斷FGF23 相關/不相關低血磷性佝僂病的靈敏度和特異度分別為100%和81.8%,這有力地支持了FGF23 具有作為新的臨床診斷標志物的潛能。但目前不同FGF23 試劑盒的診斷截斷值尚不完全確定,未來有必要繼續積累更多的FGF23 臨床檢測數據,以確定中國兒童的正常參考范圍。
本研究發現血清FGF23 濃度與ALP 呈正相關,低血磷性佝僂病患兒由于生長板軟骨細胞終末分化和礦化所需磷酸鹽供應不足,成骨細胞活躍,故ALP 增高明顯。TmP/GFR 是穩定狀態下測量腎臟重吸收磷的最佳方法,可有效代表腎磷閾,低血磷性佝僂病患兒TmP/GFR 顯著降低。本研究中血清FGF23 濃度與TmP/GFR 呈負相關, 與Yamamoto等[22]的研究結果一致。由于布羅索尤單抗通過直接結合FGF23 抑制其生物活性,提高腎臟重吸收磷,改善TmP/GFR 以維持血磷在正常范圍內,故FGF23 或許可成為監測布羅索尤單抗療效的有效指標。既往認為,FGF23濃度過高可引起1,25-二羥維生素D3生成不足[23],從而減少鈣磷吸收,但本研究顯示二者呈正相關,原因可能與本研究中患兒非初診,曾長期服用大劑量骨化三醇有關,而活性維生素D的半衰期長達2~3周,停藥2周后患兒體內可能仍殘留部分外源性活性維生素D。本研究表明FGF23 濃度與年齡、身高Z 評分無顯著相關性。一項包含29例(成人14例,兒童15例)的回顧性研究中,FGF23濃度與身高標準差分數、發病年齡均無相關性[24],可能與患兒身高受遺傳、治療時間、營養狀況等多因素影響相關。
總之,FGF23是腸、腎、骨之間聯系、調節的紐帶,其血清濃度不僅與多種輔助診斷的生化標志物相關,是低血磷性佝僂病的潛在診斷靶標,同時也有可能成為評估布羅索尤單抗療效的指標。
本研究尚存在以下局限性:(1)XLH 為罕見病,本研究樣本量小且為單中心研究,仍需進一步的前瞻性研究證實血清FGF23 濃度對疾病發生發展的獨立預測價值;(2)未能評估FGF23 濃度對低血磷性佝僂病不同年齡段、不同類型低血磷性佝僂病的診斷價值,以及不同檢測方法的差異;(3)影響FGF23 因素較多,未來可行多重線性回歸分析,減小其他混雜因素帶來的偏倚。鑒于這些局限性,我們的結果需要在更大的樣本和更廣泛的年齡范圍中進行前瞻性、多中心研究。
利益沖突聲明:所有作者聲明不存在利益沖突。

