芒柄花素對妊娠期糖尿病大鼠氧化應激損傷的影響
田亞靜,楊雪,汪靜,葛文杰,何玉玲
妊娠期糖尿病(gestational diabetes mellitus,GDM)是妊娠期發生的一種代謝異常性疾病,可導致流產、巨大兒、早產等不良結局[1-2]。GDM 患者體內產生過量的活性氧(reactive oxygen species,ROS),引發的強烈氧化應激是造成胎盤損傷與不良妊娠結局的主要原因,抗氧化藥物可緩解氧化應激反應[3-4]。 核因子E2 相關因子2(nuclear factor erythroid-2 related factor 2,Nrf2)在維持氧化還原穩態中起重要作用,激活Nrf2 可抑制高血糖誘導的氧化應激和炎癥反應[5],還可上調抗氧化基因血紅素單加氧酶-1(hemeoxygenase-1,HO-1)/磷酸酰胺腺嘌呤二核苷酸醌氧化還原酶-1(NADPH quinine oxidoreductase-1,NQO1)表達水平,有效減輕哮喘小鼠炎癥和氧化應激損傷[6]。通過激活Nrf2/HO-1 可改善GDM 小鼠葡萄糖不耐受,抑制體內氧化應激,最終改善生殖結局[7]。因此,筆者推測Nrf2/HO-1/NQO1是防治GDM的重要作用靶點。芒柄花素又稱刺芒柄花素,是一種異黃酮類化合物,為天然抗氧化劑。研究顯示,芒柄花素能用于多種心腦血管疾病的治療,還可激活Nrf2/HO-1信號通路,進而降低糖尿病腎病大鼠血糖、血脂,抑制其腎組織氧化應激損傷[8-9]。本研究以不同劑量芒柄花素處理GDM模型大鼠,旨在探討芒柄花素是否可通過激活Nrf2/HO-1/NQO1信號通路來減輕GDM大鼠氧化應激損傷。
1 材料與方法
1.1 主要材料
SPF 級SD 大鼠130 只,雌雄各半,7 周齡左右,體質量200~260 g,購自廣州賽業百沐生物科技有限公司,動物生產許可證號:SCXK(粵)2020-0055。在屏障環境中分籠飼養,4只/籠,飼養嚴格參照《中華人民共和國實驗動物管理條例》進行。鏈脲佐菌素(純度≥98%)、Nrf2 抑制劑ML385(純度≥98%)、芒柄花素(純度≥99%)均購自北京索萊寶科技有限公司;丙二醛(malondialdehyde,MDA)測定試劑盒、谷胱甘肽(glutathione,GSH)測定試劑盒、總抗氧化能力(total antioxidant capacity,TAC)檢測試劑盒均購自南京建成生物工程研究所;兔源抗大鼠β-actin 一抗、兔源抗大鼠Nrf2 一抗、超氧化物歧化酶(superoxide dismutase,SOD)活性檢測試劑盒、兔源抗大鼠HO-1 一抗、辣根過氧化物酶(horseradish peroxidase,HRP)偶聯羊抗兔二抗、兔源抗大鼠NQO1一抗均購自英國Abcam 公司。全自動生化分析儀(型號PM4)購自天津微納芯科技有限公司;透射電子顯微鏡(型號Talos L120C)購自北京歐波同光學技術有限公司;酶標儀(型號YT-MB96A)購自山東云唐智能科技有限公司;雙膠迷你垂直電泳槽(型號VE-180)、轉印電泳槽(型號VE-186)購自南京普陽科學儀器研究所等。
1.2 研究方法
1.2.1 GDM模型建立及分組
參照文獻[10]建立GDM 大鼠模型:選擇空腹血糖(fasting serum glucose,FSG)值正常的SD 大鼠,雌雄比為1∶1合籠過夜,次日檢查陰道栓得到孕鼠56只(記為孕0 d),隨機抽取47 只于其腹腔內注射45 mg/kg 的鏈脲佐菌素,孕3 d 測量FSG,≥16.7 mmol/L 表示GDM 造模成功。共成功造模45只,按隨機數字表法分為模型組、芒柄花素低劑量(50 mg/kg)組[11]、芒柄花素高劑量(100 mg/kg)組[11]、ML385(20 mg/kg)組[12]、芒柄花素高劑量+ML385組,每組9只;另取9只正常妊娠大鼠作為對照組。芒柄花素和ML385均以生理鹽水溶解至所需濃度,分別采取腹腔注射和灌胃給藥,對照組給予等劑量生理鹽水,各組均于孕3 d給藥,1次/d,持續至孕19 d。
1.2.2 大鼠體質量及糖脂代謝指標測定
孕20 d時以乙醚麻醉大鼠(提前禁食禁水12 h),測量其體質量后采集尾靜脈血,放入全自動生化分析儀中檢測FSG、總膽固醇(TC)、三酰甘油(TG)水平。
1.2.3 胚胎存活率、胎鼠體質量及胎盤形態觀察
糖脂代謝測定結束后處死各組大鼠,取1.5 mL 尾靜脈血,于4 ℃、3 000 r/min 離心10 min 取上清液,-80 ℃保存備用。縱向切開腹腔及子宮,從子宮中取出胎鼠和胎盤,對胎鼠進行計數并稱質量,得出其平均體質量,計數存活胚胎數和總胚胎數(即總著床點數),計算胚胎存活率=存活胚胎數/總胚胎數×100%。肉眼觀察各組胎盤的顏色、外觀后剪取約0.8 g 胎盤組織保存在液氮備用,剩余胎盤組織浸入含0.05 mol/L蔗糖的鈣藻酸鹽緩沖液中固定,1 h后浸沒入2.5%戊二醛中于4 ℃下繼續固定24 h,使用透射電子顯微鏡觀察胎盤超微結構并采集圖像。
1.2.4 血清及胎盤組織MDA、GSH、SOD和TAC水平檢測
取1.2.3 中保存在液氮中的胎盤組織,加入高強度RIPA裂解液勻漿,4 ℃、3 000 r/min 離心20 min 取上清液,以BCA法測定蛋白總濃度后每組取300 μL。取1.2.3 中保存在-80 ℃中的血清于冰水浴中解凍后每組取300μL,按照試劑盒說明書分別檢測血清及胎盤組織中MDA、GSH、SOD 和TAC水平。
1.2.5 Western blot法檢測胎盤組織Nrf2/HO-1/NQO1通路蛋白相對表達水平
自1.2.4 中各組剩余的胎盤組織蛋白樣品液中取50 μg總蛋白上樣,跑電泳、轉膜、5%脫脂奶粉室溫封閉2.5 h后,剪下檢測蛋白條帶分別孵育兔源抗大鼠β-actin、Nrf2、HO-1、NQO1一抗(稀釋比均為1∶2 000),4 ℃過夜后TBST振蕩洗膜3 次,室溫孵育HRP 偶聯羊抗兔二抗(1∶1 000),2 h 后TBST振蕩洗膜3次,通過增強化學發光法顯色并采集蛋白條帶圖像,使用Image J軟件分析定量各組蛋白相對表達水平。
1.3 統計學方法
采用GraphPad Prism 8.0.1 軟件進行數據分析。符合正態分布的計量數據以±s表示,多組間比較采用單因素方差分析,組間多重比較用SNK-q檢驗。P<0.05 為差異有統計學意義。
2 結果
2.1 各組大鼠體質量及糖脂代謝水平比較
與對照組比較,模型組體質量及FSG、TG、TC水平升高(P<0.05)。與模型組比較,芒柄花素低劑量組、芒柄花素高劑量組大鼠體質量及FSG、TG、TC水平均降低(P<0.05),而ML385 組大鼠體質量及FSG、TG、TC 水平升高(P<0.05)。與芒柄花素低劑量組比較,芒柄花素高劑量組體質量及FSG、TG、TC水平降低(P<0.05)。與ML385組比較,芒柄花素高劑量+ML385組大鼠體質量及FSG、TG、TC水平降低(P<0.05)。見表1。
Tab.1 Comparison of body weight,blood glucose and blood lipid levels of rats between the six groups表1 各組大鼠體質量及血糖、血脂水平比較(n=9,±s)

Tab.1 Comparison of body weight,blood glucose and blood lipid levels of rats between the six groups表1 各組大鼠體質量及血糖、血脂水平比較(n=9,±s)
**P<0.01;a與對照組比較,b與模型組比較,c與芒柄花素低劑量組比較,d與ML385組比較,P<0.05;表2—5同。
組別對照組模型組芒柄花素低劑量組芒柄花素高劑量組ML385組芒柄花素高劑量+ML385組F母體體質量/g 306.85±6.20 356.34±7.14a 332.68±5.25b 310.02±4.39bc 372.69±7.81b 351.73±6.92d 154.591**FSG/(mmol/L)3.54±0.38 17.42±3.13a 10.83±2.34b 4.02±0.54bc 26.79±3.48b 15.21±2.95d 115.158**TG/(mmol/L)0.75±0.08 1.48±0.14a 1.13±0.10b 0.81±0.09bc 1.95±0.19b 1.43±0.12d 117.919**TC/(mmol/L)2.70±0.24 5.15±0.56a 3.89±0.40b 2.78±0.29bc 6.26±0.48b 5.08±0.41d 108.771**
2.2 各組胚胎存活率及胎鼠體質量比較
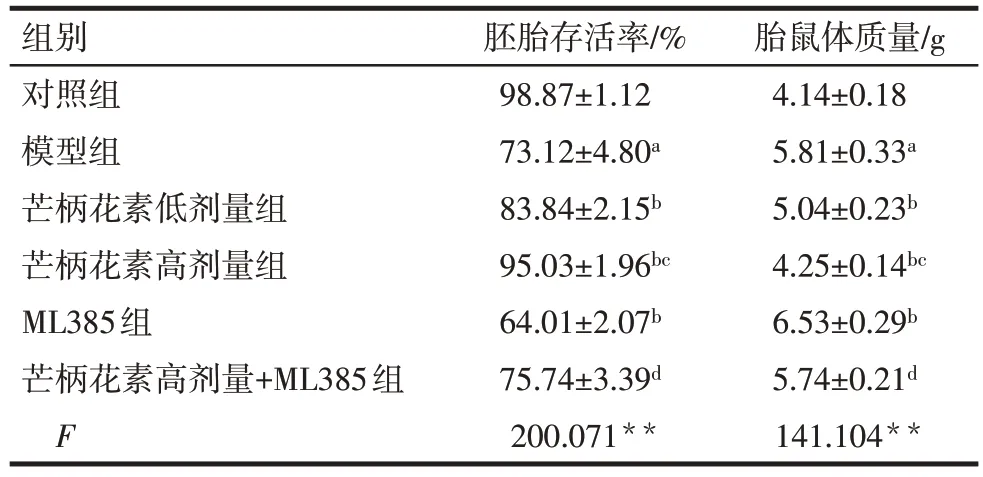
與對照組比較,模型組大鼠胚胎存活率降低,胎鼠體質量升高(P<0.05)。與模型組比較,芒柄花素低劑量組、芒柄花素高劑量組大鼠胚胎存活率均升高,胎鼠體質量均降低(P<0.05),而ML385 組大鼠胚胎存活率降低,胎鼠體質量升高(P<0.05)。與芒柄花素低劑量組比較,芒柄花素高劑量組大鼠胚胎存活率升高,胎鼠體質量降低(P<0.05)。與ML385組比較,芒柄花素高劑量+ML385組大鼠胚胎存活率升高,胎鼠體質量降低(P<0.05)。見表2。
Tab.2 Embryo survival rate and fetal weight of rats in each group表2 各組大鼠胚胎存活率及胎鼠體質量(n=9,±s)
Tab.2 Embryo survival rate and fetal weight of rats in each group表2 各組大鼠胚胎存活率及胎鼠體質量(n=9,±s)
組別對照組模型組芒柄花素低劑量組芒柄花素高劑量組ML385組芒柄花素高劑量+ML385組F胚胎存活率/%98.87±1.12 73.12±4.80a 83.84±2.15b 95.03±1.96bc 64.01±2.07b 75.74±3.39d 200.071**胎鼠體質量/g 4.14±0.18 5.81±0.33a 5.04±0.23b 4.25±0.14bc 6.53±0.29b 5.74±0.21d 141.104**
2.3 各組大鼠胎盤形態比較
對照組大鼠胎盤超微結構正常,無損傷表現。模型組大鼠胎盤超微結構發生損傷:滋養層細胞出現空泡且微絨毛密度降低,與血管內皮細胞之間連接松散。與模型組比較,芒柄花素低劑量組、芒柄花素高劑量組大鼠胎盤超微結構損傷表現均減輕,芒柄花素高劑量組大鼠胎盤超微結構損傷表現相比芒柄花素低劑量組進一步減輕;ML385 組大鼠胎盤超微結構損傷表現加重。與ML385 組比較,芒柄花素高劑量+ML385組大鼠胎盤超微結構損傷表現減輕。見圖1。
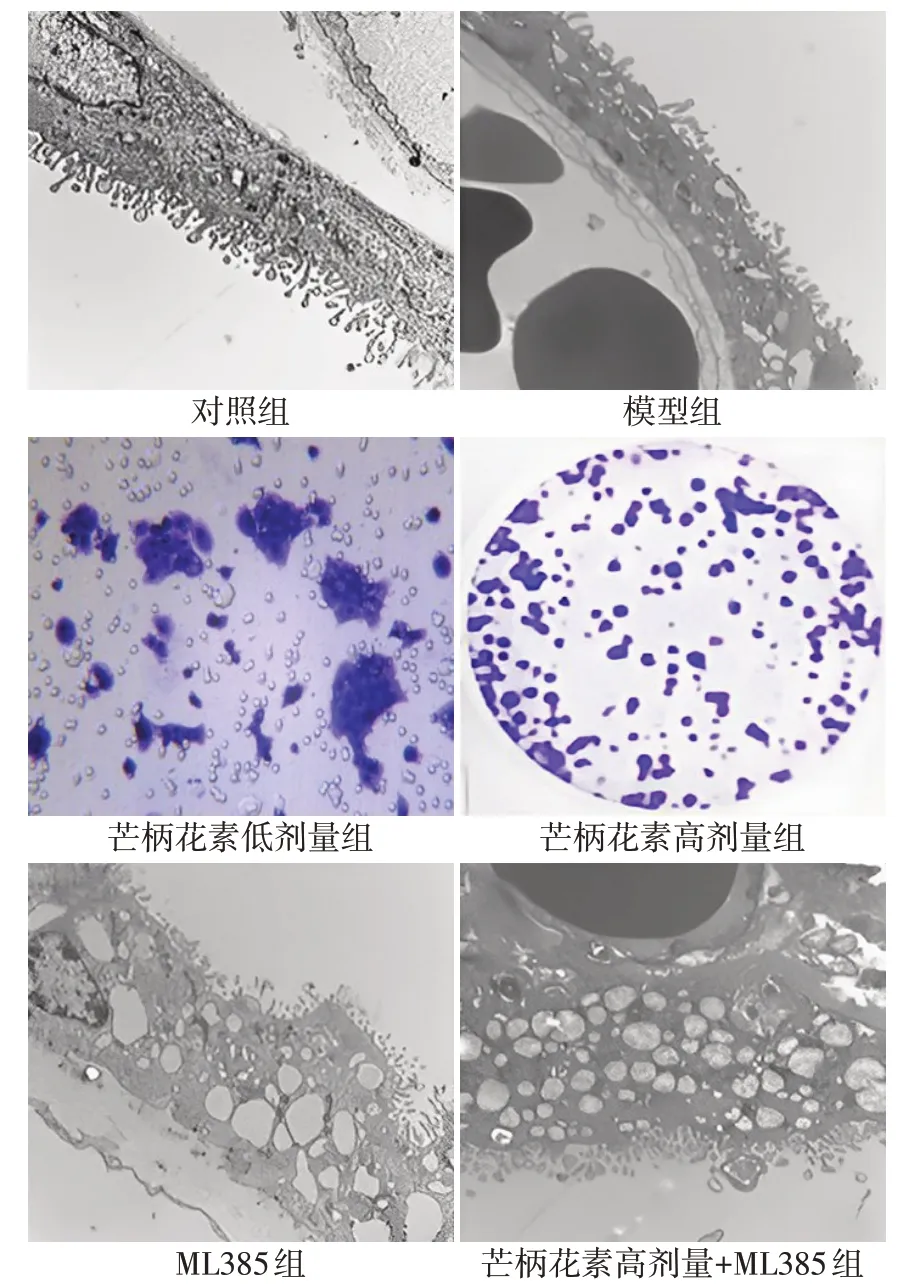
Fig.1 Ultrastructure of placental tissue of rats in each group observed by transmission electron microscope(×25 000)圖1 透射電鏡觀察各組大鼠胎盤組織超微結構(×25 000)
2.4 各組血清及胎盤組織氧化應激指標比較
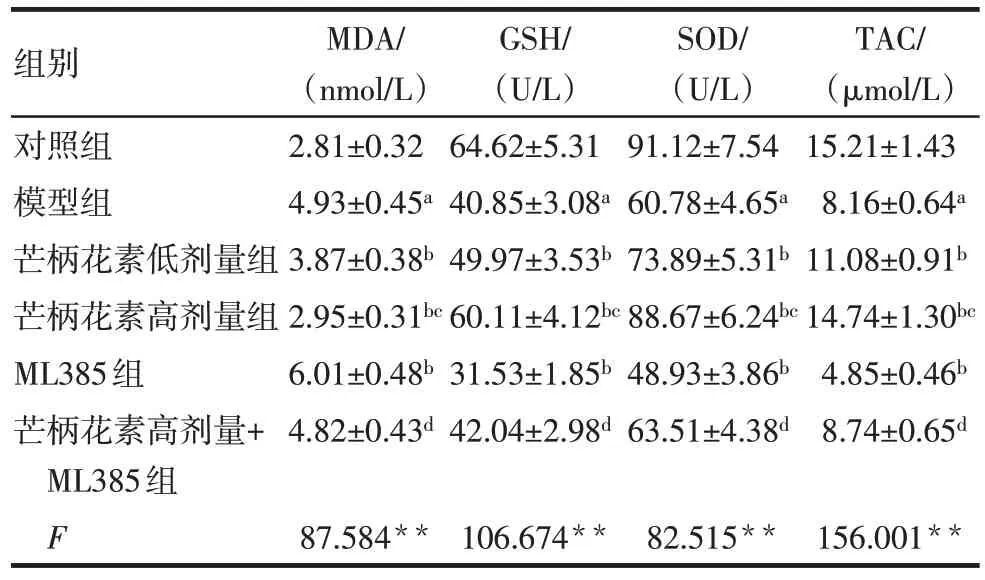
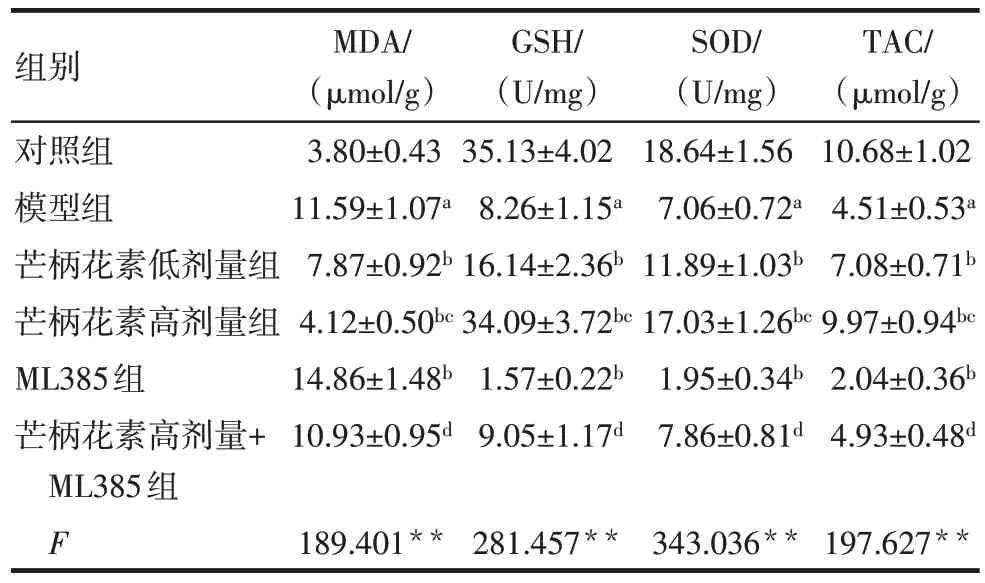
與對照組比較,模型組大鼠血清及胎盤組織MDA 水平升高,GSH、SOD 和TAC 水平降低(P<0.05)。與模型組比較,芒柄花素低劑量組、芒柄花素高劑量組大鼠血清及胎盤組織MDA水平均降低,GSH、SOD 和TAC 水平均升高(P<0.05),而ML385組大鼠血清及胎盤組織MDA 水平升高,GSH、SOD和TAC 水平降低(P<0.05)。與芒柄花素低劑量組比較,芒柄花素高劑量組大鼠血清及胎盤組織MDA水平降低,GSH、SOD 和TAC 水平升高(P<0.05)。與ML385 組比較,芒柄花素高劑量+ML385 組大鼠血清及胎盤組織MDA 水平降低,GSH、SOD 和TAC水平升高(P<0.05)。見表3、4。
Tab.3 Serum levels of MDA,GSH,SOD and TAC in rats of each group表3 各組大鼠血清氧化應激指標MDA、GSH、SOD和TAC水平(n=9,±s)
Tab.3 Serum levels of MDA,GSH,SOD and TAC in rats of each group表3 各組大鼠血清氧化應激指標MDA、GSH、SOD和TAC水平(n=9,±s)
組別對照組模型組芒柄花素低劑量組芒柄花素高劑量組ML385組芒柄花素高劑量+ML385組F MDA/(nmol/L)2.81±0.32 4.93±0.45a 3.87±0.38b 2.95±0.31bc 6.01±0.48b 4.82±0.43d 87.584**GSH/(U/L)64.62±5.31 40.85±3.08a 49.97±3.53b 60.11±4.12bc 31.53±1.85b 42.04±2.98d 106.674**SOD/(U/L)91.12±7.54 60.78±4.65a 73.89±5.31b 88.67±6.24bc 48.93±3.86b 63.51±4.38d 82.515**TAC/(μmol/L)15.21±1.43 8.16±0.64a 11.08±0.91b 14.74±1.30bc 4.85±0.46b 8.74±0.65d 156.001**
Tab.4 Levels of MDA,GSH,SOD and TAC in placental tissue of rats in each group表4 各組大鼠胎盤組織氧化應激指標MDA、GSH、SOD和TAC水平(n=9,±s)
Tab.4 Levels of MDA,GSH,SOD and TAC in placental tissue of rats in each group表4 各組大鼠胎盤組織氧化應激指標MDA、GSH、SOD和TAC水平(n=9,±s)
組別對照組模型組芒柄花素低劑量組芒柄花素高劑量組ML385組芒柄花素高劑量+ML385組F MDA/(μmol/g)3.80±0.43 11.59±1.07a 7.87±0.92b 4.12±0.50bc 14.86±1.48b 10.93±0.95d 189.401**GSH/(U/mg)35.13±4.02 8.26±1.15a 16.14±2.36b 34.09±3.72bc 1.57±0.22b 9.05±1.17d 281.457**SOD/(U/mg)18.64±1.56 7.06±0.72a 11.89±1.03b 17.03±1.26bc 1.95±0.34b 7.86±0.81d 343.036**TAC/(μmol/g)10.68±1.02 4.51±0.53a 7.08±0.71b 9.97±0.94bc 2.04±0.36b 4.93±0.48d 197.627**
2.5 各組胎盤組織Nrf2/HO-1/NQO1信號通路蛋白表達水平比較
與對照組比較,模型組大鼠胎盤組織Nrf2、HO-1、NQO1蛋白表達降低(P<0.05)。與模型組比較,芒柄花素低劑量組、芒柄花素高劑量組大鼠胎盤組織Nrf2、HO-1、NQO1 蛋白表達均升高(P<0.05),而ML385組大鼠胎盤組織Nrf2、HO-1、NQO1蛋白表達降低(P<0.05)。與芒柄花素低劑量組比較,芒柄花素高劑量組大鼠胎盤組織Nrf2、HO-1、NQO1蛋白表達升高(P<0.05)。與ML385組比較,芒柄花素高劑量+ML385 組大鼠胎盤組織Nrf2、HO-1、NQO1 蛋白表達升高(P<0.05)。見圖2、表5。
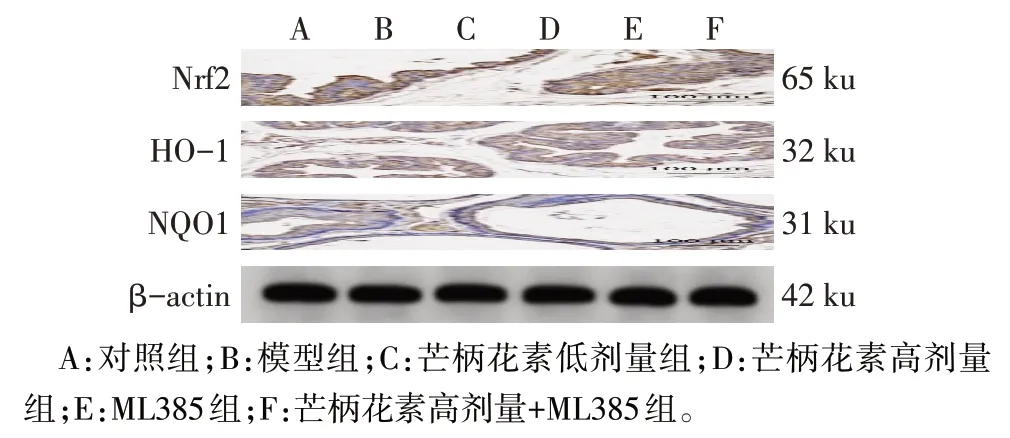
Fig.2 Expression of Nrf2/HO-1/NQO1 pathway protein in placental tissue of rats in each group detected by Western blot assay圖2 各組大鼠胎盤組織Nrf2/HO-1/NQO1通路蛋白表達
Tab.5 Relative expression level of Nrf2/HO-1/NQO1 pathway protein in placental tissue of rats in each group表5 各組大鼠胎盤組織Nrf2/HO-1/NQO1通路蛋白相對表達水平(n=9,±s)
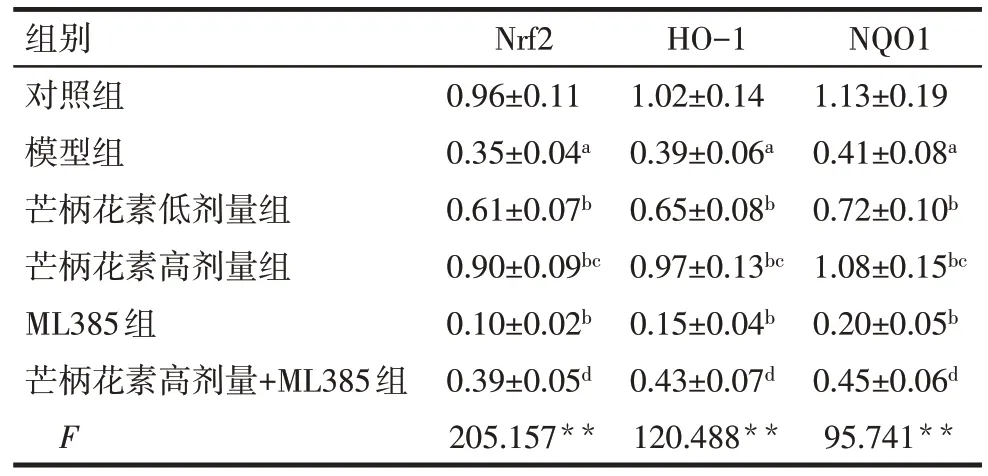
Tab.5 Relative expression level of Nrf2/HO-1/NQO1 pathway protein in placental tissue of rats in each group表5 各組大鼠胎盤組織Nrf2/HO-1/NQO1通路蛋白相對表達水平(n=9,±s)
組別對照組模型組芒柄花素低劑量組芒柄花素高劑量組ML385組芒柄花素高劑量+ML385組F Nrf2 0.96±0.11 0.35±0.04a 0.61±0.07b 0.90±0.09bc 0.10±0.02b 0.39±0.05d 205.157**HO-1 1.02±0.14 0.39±0.06a 0.65±0.08b 0.97±0.13bc 0.15±0.04b 0.43±0.07d 120.488**NQO1 1.13±0.19 0.41±0.08a 0.72±0.10b 1.08±0.15bc 0.20±0.05b 0.45±0.06d 95.741**
3 討論
目前,口服降糖藥和胰島素注射是GDM主要治療方案,但長期應用對母嬰均可造成一定危害[13-14]。本研究采用腹腔注射鏈脲佐菌素的方法誘導建立GDM模型,結果顯示造模大鼠體質量、FSG、TG、TC、胎鼠體質量較對照組升高,抗氧化活力降低,致使大鼠胎盤萎縮且超微結構發生損傷,胚胎存活率明顯降低,表明鏈脲佐菌素可導致孕鼠糖脂代謝紊亂,引發高強度氧化應激,損害胎盤結構及胎鼠正常發育,導致不良妊娠結局。
GDM發病機制復雜,其中ROS過量產生及抗氧化能力下降是重要的發病機制之一,拮抗患者體內氧化應激損傷是防治GDM 的有效手段[3-4,15-16]。芒柄花素是一種天然抗氧化劑,能通過提升機體抗氧化活力而對組織器官發揮保護作用[8]。它可通過減輕氧化應激而改善膿毒癥誘導的大鼠急性腎功能損傷[17],還可緩解糖尿病小鼠氧化應激損傷,改善其認知功能[18],因而預測芒柄花素可能用于防治GDM。本研究結果顯示,與模型組比較,芒柄花素低劑量和高劑量組大鼠血清及胎盤組織GSH、SOD、TAC水平升高,胚胎存活率升高,母體體質量、FSG、TG、TC、胎鼠體質量、血清及胎盤組織MDA 水平降低,表明芒柄花素可改善糖脂代謝,降低GDM大鼠血糖及血脂水平,提升其抗氧化活力,抑制氧化應激反應,減輕大鼠胎盤結構損傷,促使胎鼠存活,提示芒柄花素能減輕GDM 大鼠氧化應激損傷,芒柄花素在GDM的防治中有很好的發展前景。
Nrf2/HO-1/NQO1是機體內重要的抗氧化信號,可通過調控氧化應激反應來參與缺血性腦卒中、GDM 等疾病的發生、發展過程,激活該通路可抑制氧糖剝奪/復氧誘導的海馬神經元ROS 和過氧化產物MDA 生成,提升抗氧化酶活性,通過抑制氧化應激發揮神經保護作用[19]。恢復GDM小鼠Nrf2/HO-1信號活性可減輕其體內氧化應激,改善GDM癥狀及不良妊娠結局[20]。張馨允等[9]研究表明,芒柄花素可激活Nrf2/HO-1 信號,減輕糖尿病腎病大鼠腎臟氧化應激損傷。本研究結果顯示,與模型組比較,ML385組大鼠血清及胎盤組織GSH、SOD、TAC水平下降,胎盤組織Nrf2、HO-1、NQO1 蛋白表達及胚胎存活率降低,母體體質量、FSG、TG、TC、胎鼠體質量、血清及胎盤組織MDA 水平升高,表明抑制Nrf2表達可增強GDM大鼠體內氧化應激反應,加重胎盤結構損傷及不良妊娠結局。與ML385 組比較,芒柄花素高劑量+ML385 組大鼠血清及胎盤組織GSH、SOD、TAC 水平升高,胎盤組織Nrf2、HO-1、NQO1蛋白表達及胚胎存活率升高,母體體質量、FSG、TG、TC、胎鼠體質量、血清及胎盤組織MDA水平降低,說明芒柄花素可逆轉ML385的作用,提示芒柄花素減輕GDM大鼠氧化應激損傷是通過激活Nrf2信號實現。
綜上所述,芒柄花素可改善GDM 大鼠糖脂代謝,降低其血糖血脂,增強抗氧化活性,抑制大鼠體內氧化應激,減輕其胎盤損傷,提高胎鼠發育存活率,改善不良妊娠結局,激活Nrf2/HO-1/NQO1 信號通路可能是其藥理機制之一。本文證實了芒柄花素對GDM 的防治作用,為其臨床應用提供了理論依據,但其具體的藥理機制還不夠深入,Nrf2信號下游分子調控機制不清楚,還需更多實驗進行深入探討。

