甜瓜抗鏈格孢侵染病程相關蛋白及苯丙烷代謝酶的變化
劉 陽,白羽嘉 ,張鄭嘯,楚晨俐,王甜甜,馮作山
(1.新疆農業大學食品科學與藥學學院,烏魯木齊 830052;2.新疆果品采后科學技術重點實驗室,烏魯木齊 830052)
0 引 言
【研究意義】甜瓜為葫蘆科黃瓜屬植物,是新疆優質的特色果品,其主要以新疆的吐魯番、哈密、喀什等地為主要生產區,受到國內外消費者喜愛,每年大量出口到歐美等發達地區[1]。但甜瓜易感染病原微生物導致其不易儲存,其中黑斑病是一種甜瓜易感的真菌病害之一,而鏈格孢是引起此病害的病原菌[2],甜瓜感染黑斑病早期時發病部位出現水漬并呈濕腐狀,進一步的癥狀為感染部位果皮組織變軟開始腐爛,病程后期甜瓜果實表面出現菌絲,菌絲產黑色孢子及分生孢子梗,果實表皮可見黑色霉斑[3-5]。每年甜瓜因感染黑斑病對瓜農造成巨大損失,嚴重制約新疆甜瓜產業協調發展[6]。因此研究甜瓜內源抗病性,病原微生物侵染甜瓜時產生病程相關蛋白及苯丙烷代謝酶的差異,為甜瓜果實的貯運和保鮮提供了理論依據。【前人研究進展】甜瓜果實受到病原微生物侵染會激發果實產生相關抗病蛋白和苯丙烷代謝酶,是甜瓜果實自發抵御病原微生物侵染保護自身的主要途徑[7-8]。而病程相關蛋白是果實防衛體系的一個重要組成部分[9-10]。真菌的細胞壁骨架由幾丁質和纖維素構成,真菌侵染甜瓜后,果實細胞會產生甜瓜幾丁質酶(Chitinase,CHT)和β-1,3-葡聚糖酶(β-1,3-Glucan,GLU)等病程相關蛋白來分解真菌細胞壁骨架,進而實現植物細胞抵御病原微生物的侵襲[11-14]。而病程相關蛋白的活性和植物的抗病性呈正相關,因此通過測定病程相關蛋白的活性可以判斷植物的抗病性強弱[15-17]。果實貯藏中,苯丙烷代謝途徑產生的抗菌物質在抗病過程中具有重要作用[18-19]。【本研究切入點】抗病性的強弱可通過苯丙烷代謝相關酶的活性直觀地反映[20-22]。目前相關的研究,大多是關于低溫貯藏的甜瓜病程相關蛋白及苯丙烷代謝酶活變化規律[5,6],而常溫貯藏下的酶活性變化更能直觀的反映采后甜瓜在自然環境下應對病原微生物侵染時的內在抗病性,內源性抗病機制也體現得更直觀,需測定常溫貯藏下的染病甜瓜病程相關蛋白和苯丙烷代謝相關酶的活性,研究甜瓜的內在抗病性。【擬解決的關鍵問題】材料為伽師瓜和86-1甜瓜,通過損傷接種鏈格孢菌,研究常溫貯藏時兩種甜瓜外果皮、內果皮及果肉組織病程相關蛋白及苯丙烷代謝酶的變化規律,對比果皮和果肉的抗病性差異,了解抗病害的內在機制,完善采后甜瓜病害的知識體系,為甜瓜采后貯藏保鮮技術的突破創新構建良好的科學基礎。
1 材料與方法
1.1 材 料
1.1.1 甜 瓜
伽師瓜、86-1甜瓜:均來自新疆伽師縣,果實發育良好、未發病、無損傷、成熟度一致。伽師瓜質量(4.0±0.5) kg,86-1甜瓜質量(3.5±0.5) kg。
鏈格孢菌(Alternariaalternata):伽師瓜上分離(自然發病),馬鈴薯葡萄糖瓊脂培養基(potato dextrose agar,PDA)28℃培養,4℃保藏。
1.1.2 試 劑
ATP、CoA、PMSF、PVP、p-香豆酸、DTT、L-苯丙氨酸、亮抑酶肽、EDTA、β-巰基乙醇,生工生物工程(上海)股份有限公司;葡萄糖-6-磷酸二鈉、幾丁質、昆布多糖、Tris,美國西格瑪奧德里奇公司;氫氧化鈉、無水乙醇、無水乙酸鈉、五水合四硼酸鉀、無水亞硫酸鈉、硫酸鎂、3,5-二硝基水楊酸、丙酮、冰乙酸、結晶酚、酒石酸鉀鈉、L-抗壞血酸、濃鹽酸、氯化鎂、丙三醇、硼砂、硼酸,天津市福晨化學試劑;PDA培養基,北京奧博星生物技術有限責任公司。
1.1.3 儀器與設備
無菌操作臺(NBCJ-B型)、恒溫霉菌培養箱(MHP-250型):上海鴻都科技有限公司;立式壓力蒸汽滅菌器(LDZX-50KBS型):上海申安醫療器械廠;顯微鏡(XSP-2C型):上海蔡康光學儀器有限公司;電子天平(FA2104N型):上海民橋精密儀器有限公司;pH計(FE20型):梅特勒-托利多儀器有限公司;高速分散器(XHF-DY型):寧波新芝生物科技有限公司;高速冷凍離心機(TGL-16G型):上海安亭科學儀器廠;紫外-可見分光光度計(TU-1810PC型):北京普析通用公司。
1.2 方 法
1.2.1 甜瓜預處理
外表皮的清潔:自來水沖洗,后用2%H2O2浸泡30 s,再次自來水沖洗3次。晾干貯于室內陰涼干燥處。
1.2.2 采后甜瓜損傷接種鏈格孢
損傷接種:甜瓜果實沿赤道穿透打孔,每孔直徑3.5 mm、深度5 mm,每孔等距(相距7 cm),實驗組:鏈格孢制備孢子懸浮液,每孔接20 μL,制備濃度1.0×106spores/mL[23](含0.01%吐溫-20,按照體積分數計算);對照組接入無菌水,每孔接20 μL。
室溫貯藏(25~28℃,空氣相對濕度35%~40%)。
1.2.3 取 樣
甜瓜損傷接種鏈格孢,分別于接種后的第0、2、4、6、8、10、12、14、16 d取樣,共取樣9次,每次隨機選擇試驗組與對照組各9個甜瓜。取病斑周圍5 mm處組織[外果皮厚度(1.0±0.3) mm、內果皮厚度(5.0±0.3) mm,果肉厚度(10.0±0.3) mm]。
1.2.4 測定指標
1.2.4.1 病斑直徑
沿接種鏈格孢部位,將甜瓜果實縱向剖開,測定病斑及過敏反應組織,每次測定9個果實,計算平均值,即為病斑直徑。
1.2.4.2 酶活性
CHT的活性測定參照曹建康[24]的方法,以每秒每克鮮重樣品中酶分解膠狀幾丁質產生1×10-9molN-乙酰糖胺為一個幾丁質酶活性單位(U),活性以U/(g·FW)表示。
GLU活性的測定參照曹建康[24]的方法,以每秒每克鮮重樣品中酶分解昆布多糖產生1×10-9mol葡萄糖為一個β-1,3-葡聚糖酶活性單位(U),活性以U/(g·FW)表示。
PAL活性的測定參照曹建康[24]的方法并稍作修改,取2.0 g冷凍果肉組織,加入4 mL提取液(100 mmol/L硼酸緩沖液,含PVP0.04 g/mL、EDTA0.58 mg/mL、0.35 μL/mLβ-巰基乙醇),高速分散器打碎,4℃12 000 ×g離心30 min,上清液即粗酶液。試管中加入6 mL硼酸緩沖液(100 mmol/L),1 mL苯丙氨酸溶液(20 mmol/L),30℃保溫30 min,加入1mL粗酶液,290 nm處測定吸光度,活性以U/(g·FW)表示。
C4H活性的測定參照曹建康[24]方法,活性以U/(g·FW)表示。
4CL活性的測定參照曹建康[24]的方法并稍作修改,取1.0 g冷凍果肉組織,加入5 mL提取液(0.2 mol/LTris-HCL緩沖液,含甘油250 mL/L、DTT15.425 g/L),高速分散器打碎,4℃12 000×g離心20 min,上清液即粗酶液。試管中加入0.45 mL P-香豆酸溶液(5 μmol/mL)、1.35 mL硫酸鎂溶液(15 μmol/L)、0.45 mL輔酶A(1 μmol/mL)、0.45 mL ATP溶液(0uol/mL),1 mL粗酶液,4℃保溫10 min。333 nm處測定吸光度活,活性以U/(g·FW)表示。
1.3 數據處理
數據分析處理:IBM SPSS Statistics 23.0,繪圖:Origin2018,采用Duncan法進行差異顯著性分析(P<0.05,差異顯著)。
2 結果與分析
2.1 甜瓜品種及甜瓜不同部位的抗病性比較
研究表明,接種鏈格孢后,86-1甜瓜于第2 d出現病斑,伽師瓜于第4 d出現病斑,86-1甜瓜病斑出現時間早于伽師瓜。接種鏈格孢后在貯藏期間兩類甜瓜病斑直徑呈不斷擴大的趨勢。在貯藏期間,伽師瓜的病斑直徑始終小于86-1甜瓜。侵染第16 d時,86-1甜瓜果肉組織的病斑直徑是3.30 cm,伽師瓜果肉組織是2.40 cm,伽師瓜是86-1甜瓜的1.38倍;86-1甜瓜果皮組織病斑直徑是3.10 cm,伽師瓜果皮組織病斑直徑是2.00 cm,86-1甜瓜是伽師瓜的1.55倍,差異顯著(P<0.05),兩種甜瓜的果肉病斑增長速度大于果皮。伽師瓜病斑直徑增長速度小于86-1甜瓜。伽師瓜抗病性優于86-1甜瓜。圖1,圖2
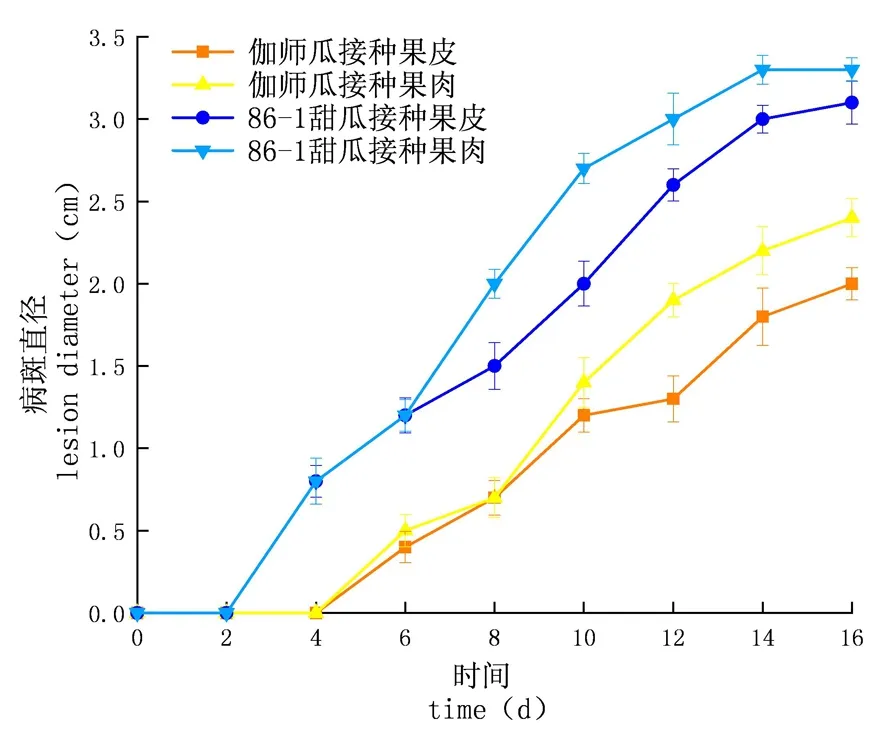
圖1 鏈格孢侵染后甜瓜病斑直徑的變化

圖2 不同天數甜瓜病斑
2.2 鏈格孢侵染不同種類甜瓜果實后CHT活性變化
研究表明,在貯藏期內,CHT的活性先升高后下降,侵染初期上升較慢至中期急速上升達到頂峰后下降,實驗組酶活性及增長速率均大于對照組;外果皮CHT活性大于內果皮大于果肉,差異顯著(P<0.05);伽師瓜和86-1甜瓜的外果皮實驗組分別在8 d和10 d達到酶活高峰,伽師瓜比86-1甜瓜先到達酶活高峰,伽師瓜酶活是49.53 U,86-1甜瓜的酶活是46.40 U,伽師瓜酶活是86-1甜瓜的1.07倍;伽師瓜和86-1甜瓜的內果皮試驗組分別在10 d和8 d達到酶活高峰,伽師瓜酶活是42.71 U,86-1甜瓜的酶活是34.47 U,伽師瓜酶活是86-1甜瓜的1.24倍;伽師瓜與86-1甜瓜果肉試驗組分別在8 d與10 d達到酶活高峰,伽師瓜酶活是40.31 U,86-1甜瓜的酶活是32.87 U,伽師瓜酶活是86-1甜瓜的1.23倍。圖3~5
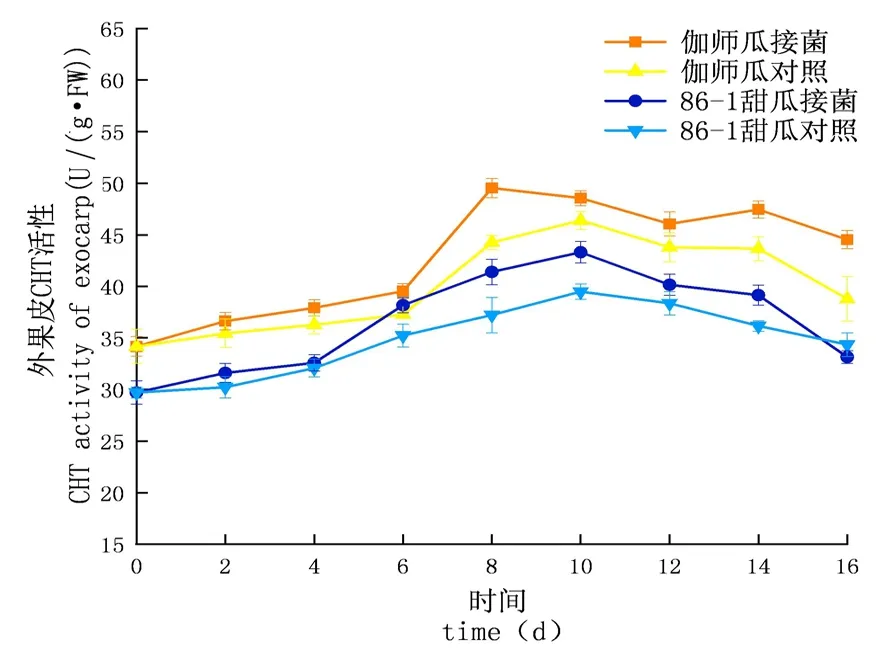
圖3 鏈格孢侵染后甜瓜外果皮CHT變化
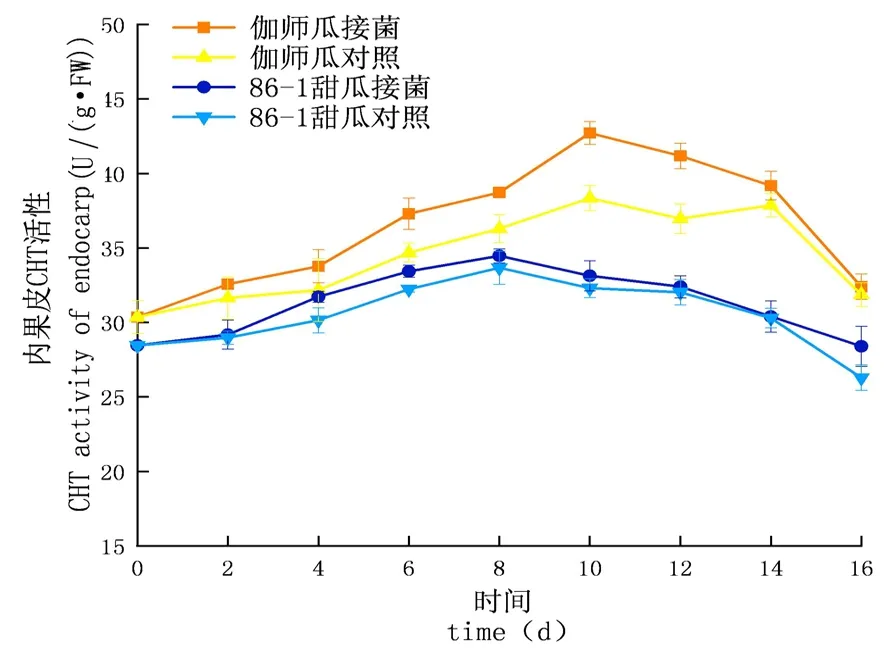
圖4 鏈格孢侵染后甜瓜內果皮CHT變化
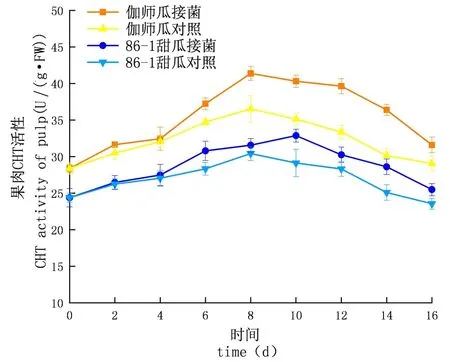
圖5 鏈格孢侵染后甜瓜果肉CHT變化
2.3 鏈格孢侵染不同種類甜瓜果實GLU活性變化
研究表明,鏈格孢侵染甜瓜后,在貯藏期內,GLU的活性先升高后下降,侵染初期上升較慢至中期急速上升達到頂峰后下降,試驗組酶活性及增長速率均大于對照組;外果皮試驗組伽師瓜和86-1甜瓜在分別8和10 d達到酶活性高峰,伽師瓜酶活是35.53 U,86-1甜瓜的酶活是27.36 U,伽師瓜酶活性是86-1甜瓜的1.30倍;內果皮試驗組伽師瓜和86-1甜瓜在8和10 d達到酶活性高峰,伽師瓜酶活是34.63 U,86-1甜瓜的酶活是28.13 U,伽師瓜酶活是86-1甜瓜的1.38倍;果肉試驗組伽師瓜和86-1甜瓜在8 d和10 d達到酶活性高峰,伽師瓜酶活是31.38 U,86-1甜瓜的酶活是20.54 U,伽師瓜酶活是86-1甜瓜的1.53倍;GLU活性外果皮大于內果皮大于果肉,差異顯著(P<0.05)。甜瓜接種鏈格孢后,GLU與CHT的活性變化趨勢相同,兩種酶在抵抗鏈格孢的過程中起到協同作用,甜瓜遭受鏈格孢侵染后,病程相關蛋白含量顯著升高,伽師瓜果實的病程相關蛋白相較于86-1甜瓜,始終維持在較高水平(P<0.05)。圖6~8

圖6 鏈格孢侵染后甜瓜外果皮GLU變化
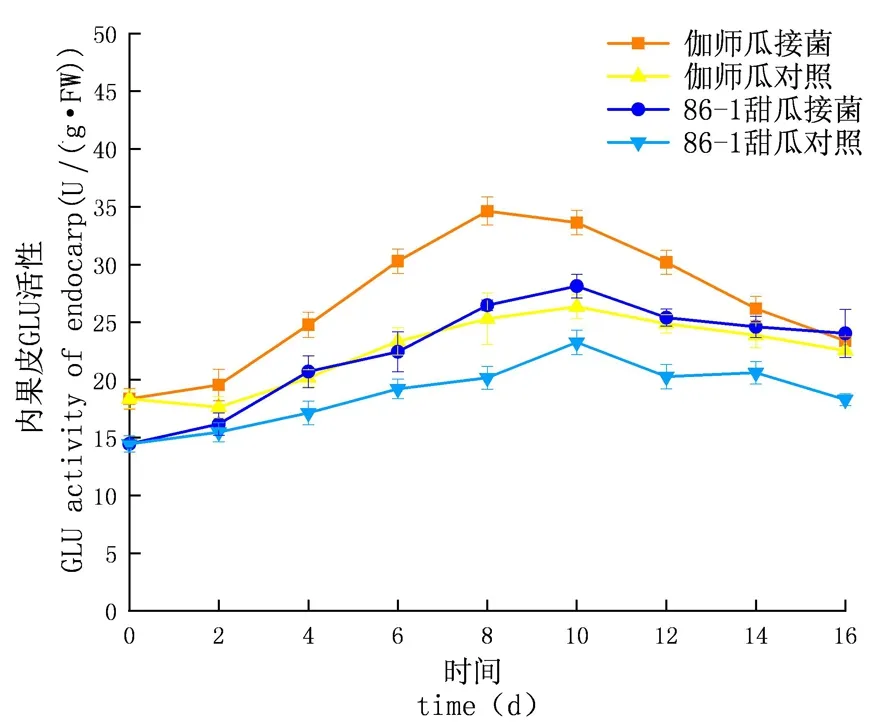
圖7 鏈格孢侵染后甜瓜內果皮GLU變化

圖8 鏈格孢侵染后甜瓜果肉GLU變化
2.4 鏈格孢侵染不同種類甜瓜果實后PAL活性變化
研究表明,鏈格孢侵染甜瓜后,在貯藏期間,PAL的活性先升高后下降,PAL酶活性試驗組大于對照組,增長速率試驗組大于對照組,PAL酶活性外果皮大于內果皮大于果肉,差異顯著(P<0.05);外果皮試驗組伽師瓜和86-1甜瓜分別在8和10 d達到酶活高峰,伽師瓜酶活是44.55 U,86-1甜瓜的酶活是35.39 U,伽師瓜酶活是86-1甜瓜的1.26倍;內果皮試驗組伽師瓜和86-1甜瓜分別在8和10 d達到酶活高峰,伽師瓜酶活是41.63 U,86-1甜瓜的酶活是34.13 U,伽師瓜酶活是86-1甜瓜的1.22倍;果肉試驗組伽師瓜和86-1甜瓜在8 d達到酶活性高峰,伽師瓜酶活是39.75 U,86-1甜瓜的酶活是30.54 U,伽師瓜酶活是86-1甜瓜的1.30倍。甜瓜損傷接種鏈格孢后果實PAL呈先升高后下降的趨勢,甜瓜果實體內PAL活性因鏈格孢侵染而升高。圖9~11
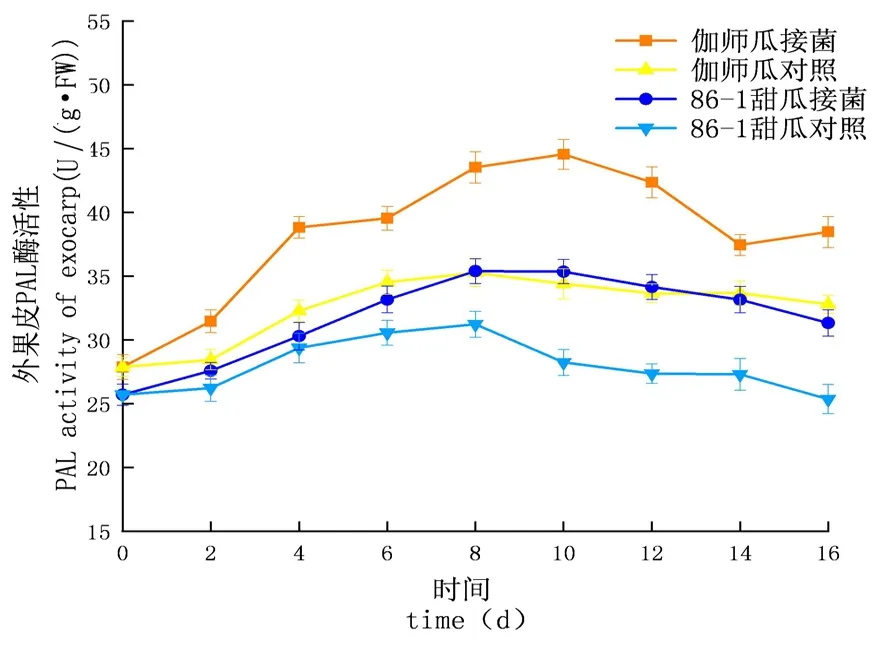
圖9 鏈格孢侵染后甜瓜外果皮PAL變化

圖10 鏈格孢侵染后甜瓜內果皮PAL變化
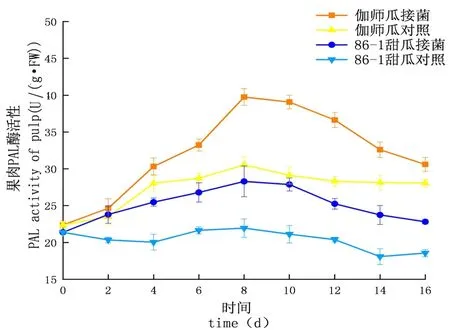
圖11 鏈格孢侵染后甜瓜果肉PAL變化
2.5 鏈格孢侵染不同種類甜瓜果實后C4H活性變化
研究表明,鏈格孢侵染后,甜瓜在貯藏期間,C4H活性先升高后下降,C4H酶活性外果皮大于內果皮大于果肉,差異顯著(P<0.05),試驗組酶活性大于對照組且試驗組的增長速率大于對照組;外果皮試驗組伽師瓜和86-1甜瓜分別在8和10 d到達酶活性高峰,伽師瓜酶活是42.53 U,86-1甜瓜的酶活是35.36 U,伽師瓜酶活是86-1甜瓜的1.20倍;內果皮試驗組伽師瓜和86-1甜瓜分別在8和10 d到達酶活高峰,伽師瓜酶活是40.62 U,86-1甜瓜的酶活是35.13 U,伽師瓜酶活性是86-1甜瓜的1.16倍;果肉試驗組伽師瓜和86-1甜瓜分別在8和10 d到達酶活高峰,伽師瓜酶活是36.38 U,86-1甜瓜的酶活是30.29 U,伽師瓜酶活性是86-1甜瓜的1.20倍。圖12~14

圖12 鏈格孢侵染后甜瓜外果皮C4H變化

圖13 鏈格孢侵染后甜瓜內果皮C4H變化

圖14 鏈格孢侵染后甜瓜果肉C4H變化
2.6 鏈格孢侵染不同種類甜瓜果實后4CL活性變化
研究表明,鏈格孢侵染甜瓜后,在貯藏期內,4CL的活性先升高再下降,C4H酶活性外果皮大于內果皮大于果肉,差異顯著(P<0.05),試驗組酶活性大于對照組且試驗組的增長速率大于對照組;外果皮試驗組伽師瓜和86-1甜瓜分別在8和10 d到達酶活高峰,伽師瓜酶活是49.53 U,86-1甜瓜的酶活是46.40 U,伽師瓜酶活性是86-1甜瓜的1.29倍;內果皮試驗組伽師瓜和,86-1甜瓜分別在8 d和10 d到達酶活高峰,伽師瓜酶活是49.53 U,86-1甜瓜的酶活是46.40 U,伽師瓜酶活性是86-1甜瓜的1.26倍;果肉試驗組伽師瓜和86-1甜瓜分別在8和10 d到達酶活高峰,伽師瓜酶活是31.37 U,86-1甜瓜的酶活是26.69 U,果肉酶活性伽師瓜是86-1甜瓜的1.18倍。苯丙烷代謝的PAL、C4H和4CL 3種酶,在甜瓜應對鏈格孢侵染的過程中明顯增多,與86-1甜瓜相比,伽師瓜更早地啟動了苯丙烷代謝機制,伽師瓜苯丙烷代謝相關酶的活性大于86-1甜瓜。圖15~17

圖15 鏈格孢侵染后甜瓜外果皮4CL變化
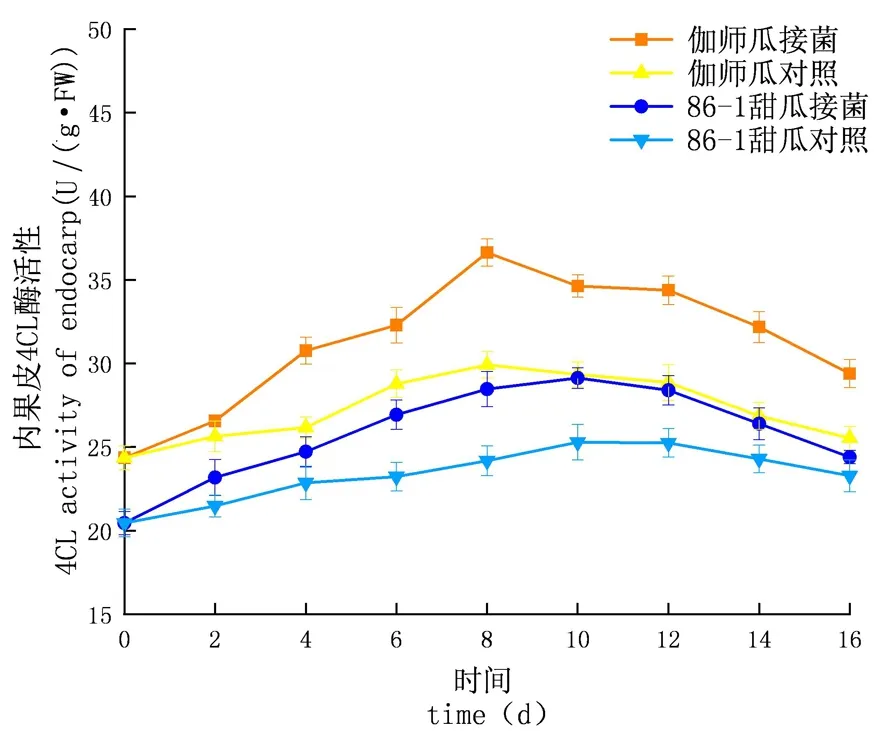
圖16 鏈格孢侵染后甜瓜內果皮4CL變化
3 討 論
李夢等[25]的研究表明接種鏈格孢后,7℃貯藏時,伽師瓜和86-1甜瓜的果肉病斑直徑大于果皮,86-1甜瓜的病斑直徑大于伽師瓜,與本研究結果一致,由此推論貯藏溫度對甜瓜病斑直徑的增長無明顯影響。王瑾等[5]的研究結果低溫貯藏時對照組的CHT活性先升高后降低的趨勢不明顯,而研究顯示常溫貯藏時對照組的CHT活性先升高后降低的趨勢較為明顯。瑪爾哈巴等[9]研究了甜瓜損傷接種鏈格孢后低溫貯藏時病程相關蛋白的變化規律,與研究甜瓜損傷接種鏈格孢后常溫貯藏時的研究結果一致,低溫和常溫貯藏時,甜瓜抵抗鏈格孢侵染時病程相關蛋白含量均呈現先升高后下降的趨勢。PAL的升高證實了鏈格孢的侵染可以誘導植物產生多種抗性,也增強了植物抵抗病原物的能力[13-22],研究測定鏈格孢侵染后的甜瓜果實PAL的酶活性趨勢與張培嶺[26]的研究結果一致。
蔣超男等[20]的研究結果表明,從寡雄腐霉中提取的具有信號傳導作用的寡雄蛋白可以誘導馬鈴薯的C4H活性顯著升高,C4H活性在寡熊蛋白誘導后呈現先升高后下降的趨勢,與研究甜瓜被鏈格孢侵染后C4H的變化趨勢一致,植物在受到真菌的侵染時會升高C4H活性來抵抗病原菌對其的破壞。張培嶺等[28]的研究結果表明,甜瓜損傷接種鏈格孢后低溫貯藏,果實4CL活性變化為先升高后下降,與實驗研究結果一致,由此可見甜瓜果實在受到鏈格孢侵染后通過提高苯丙烷代謝相關酶的活性來抵抗鏈格孢的侵染,且溫度對4CL的活性變化趨勢無明顯影響。
研究結果顯示,不同種類甜瓜遭受鏈格孢侵染后,病程相關蛋白含量顯著升高(P<0.05),其中伽師瓜在受鏈格孢侵染后病程相關蛋白在0~4 d迅速上升,相較于86-1甜瓜,其始終維持在較高水平(P<0.05),與病斑直徑顯著小于86-1甜瓜的試驗結果一致,可見病程相關蛋白在甜瓜抗鏈格孢侵染的過程中起到了積極的作用。研究表明,苯丙烷代謝的PAL、C4H和4CL 3種酶,在甜瓜應對鏈格孢侵染的過程中明顯增多(P<0.05),與86-1甜瓜相比,伽師瓜更早地啟動了苯丙烷代謝機制,伽師瓜苯丙烷代謝相關酶的活性大于86-1甜瓜,印證了苯丙烷代謝在果實應對病原物的過程中起到了積極的應對作用。甜瓜不同組織應對鏈格孢侵染時,產生酶的速率也有所不同,鏈格孢侵染后,兩種甜瓜外果皮產生抗病酶的速率最快,抗病酶活性迅速升高,內果皮次之,果肉產生抗病酶速率最慢,甜瓜抗病酶活性外果皮大于內果皮大于果肉。
目前鏈格孢侵染甜瓜相關研究的貯藏溫度大都為低溫,研究在前人的基礎上,探究常溫貯藏時不同甜瓜的病程相關蛋白和苯丙烷代謝相關酶的活性差異,對比損傷接種鏈格孢后甜瓜果實在低溫貯藏時的研究[5,6,9,26],發現貯藏溫度對甜瓜果實病程相關蛋白和苯丙烷代謝酶的變化趨勢無明顯影響,酶活呈現先升高后下降的趨勢,不論是低溫或常溫貯藏,甜瓜均產生大量病程相關蛋白和苯丙烷代謝相關酶來抵御病原菌侵染。
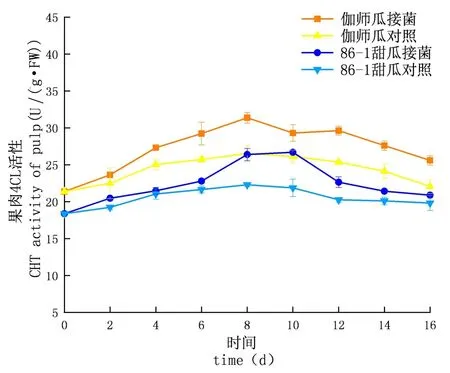
圖17 鏈格孢侵染后甜瓜果肉4CL變化
4 結 論
4.1鏈格孢侵染后貯藏16 d時,86-1甜瓜的果皮與果肉的病斑直徑分別是3.10和3.30 cm;伽師瓜的果皮與果肉的病斑直徑分別是2.0和2.4 cm;86-1甜瓜的果皮與果肉的病斑直徑分別是伽師瓜的1.55倍和1.38倍。在貯藏期內,伽師瓜病斑直徑始終小于86-1甜瓜,果皮病斑直徑始終小于果肉病斑直徑。
4.2甜瓜病程相關蛋白和苯丙烷代謝酶的活性與甜瓜的抗病性密切相關,兩種甜瓜果實的病程相關蛋白和苯丙烷代謝酶在貯藏前期迅速升高,到達頂峰后逐漸下降,伽師瓜CHT、GLU、PAL、C4H、4CL 5種酶的活性均高于86-1甜瓜,伽師瓜酶活性升高速率大于86-1甜瓜。甜瓜不同組織的病程相關蛋白和苯丙烷代謝酶的活性也有所差異,外果皮的酶活性強于內果皮強于果肉,且在酶活生成速率上外果皮大于內果皮大于果肉,伽師瓜抗病性強于86-1甜瓜,果皮抗病性強于果肉。

