食品添加劑L-香芹酮的吸入遺傳毒性評價
嚴大為 李睿 陸誠瑋 高嶧涵

摘 要:目的:了解食品添加劑L-香芹酮對霧化劑參比煙液氣溶膠遺傳毒性的影響。方法:在霧化劑參比煙液中加入300 mg·L-1的L-香芹酮,選取氣-液(瓊脂)界面的全煙氣暴露方式,暴露時間為30 min,通過Ames試驗、染色體畸變試驗和體外微核試驗等遺傳組合試驗,對添加L-香芹酮后的霧化劑參比煙液氣溶膠的遺傳毒性進行評估。結果:與霧化劑參比煙液氣溶膠相比,添加L-香芹酮后的霧化劑參比煙液氣溶膠的5種菌株的細菌突變菌落數降低幅度為0%~39.6%(不含活化系統S9),而TA97a和TA102菌株的菌落數增加56.0%和2.4%,TA98、TA100和TA1535菌株的菌落數分別降低50%、27.9%和50%(含活化系統S9);染色體畸變率降低0.6%;微核率降低1.55‰;但與陰性對照組相比,添加L-香芹酮后的霧化劑參比煙液氣溶膠組的細菌回復突變試驗、染色體畸變試驗和微核試驗等遺傳組合試驗的3項指標均符合陰性判斷標準。結論:在本試驗條件下,添加300 mg·L-1的L-香芹酮對霧化劑參比煙液氣溶膠的遺傳毒性影響較小。
關鍵詞:霧化劑;參比煙液;L-香芹酮;氣-液界面;遺傳毒性
Genotoxicity Evaluation of Food Additive L-carvone
YAN Dawei1, LI Rui2, LU Chengwei1, GAO Yihan1*
(1.Department of Basic Research, Shanghai New Tobacco Product Research Institute Co., Ltd., Shanghai 201315, China; 2.Department of Pharmacology and Toxicology, Shanghai Institute for Food and Drug Control, Shanghai 201203, China)
Abstract: Objective: To understand the effect of food additive L-carvone on the genetic toxicity of reference liquid aerosol. Method: Add 300 mg·L-1of L-carvone to the reference smoke liquid, select the full smoke exposure method at the air-liquid (agar) interface, set the exposure time to 30 min, and pass the Ames test, chromosome aberration test and in vitro micronucleus test to evaluate the genetic toxicity of the reference smoke liquid aerosol after adding L-carvone. Result: Compared with the reference smoke liquid aerosol, under the treatment of the reference smoke liquid aerosol containing L-carvone, the bacteria mutant colonies of the 5 strains varied from 0% to 39.6% (-S9) and the number of colonies of TA97a and TA102 increased by 56.0% and 2.4%, while the number of colonies of TA98, TA100 and TA1535 decreased by 50%, 27.9% and 50%, respectively (+ S9). The variation range of chromosome aberration rate is 0.6%. The variation range of micronucleus rate is 1.55‰. However, compared with the negative control group, the three indexes of the genetic combination test of L-carvone added reference smoke liquid aerosol met the negative judgment. Conclusion: Under the test conditions, adding 300 mg·L-1 of L-carvone has little effect on the genetic toxicity of the reference e-cigarette liquid aerosol.
Keywords: atomization agent; reference smoke liquid; L-carvone; air-liquid interface; genetic toxicity
L-香芹酮是留蘭香油的主要成分,含量占比在50%~60%,具有很濃郁的留蘭香香氣,其在食品香精、牙膏、硬糖、口香糖和各種飲料中有著廣泛的應用[1-2]。近年來,隨著霧化平臺的興起,L-香芹酮等香精香料的使用方式可改變為霧化吸入的方式攝取。L-香芹酮雖是食品級添加劑,一定劑量內經口攝入較為安全,但其吸入途徑的安全性卻鮮有報道,尤其是關于L-香芹酮吸入途徑的遺傳毒性。
有報道稱消費者在電子煙煙液中違規添加四氫大麻酚等物質,引起多起健康事件,添加劑的吸入安全性已引起廣泛關注[3]。同時,有研究表明不同的電子煙煙液氣溶膠的細胞毒性具有較大差異,且與電子煙煙液中的添加劑密切相關[4-7]。雖然THORNE等[8]開展了電子煙煙液氣溶膠的Ames試驗,結果顯示受試菌株未發生基因回復突變。MANOJ等[9]也未觀察到在與卷煙等同的特定劑量下電子煙煙液氣溶膠會引起細胞毒性和遺傳毒性的情況。同時,AZZOPARDI等[10]也證明電子煙煙液氣溶膠的細胞毒性相對傳統卷煙氣溶膠的細胞毒性較小,但對單一添加劑的吸入途徑的遺傳組合毒性評價還未見報道,尤其是添加后對煙液氣溶膠整體的遺傳毒性影響。因此,本文擬采用氣-液(瓊脂)界面暴露的方式,選取TA97a、TA98、TA100、TA102和TA1535菌株和中國倉鼠肺細胞(CHL細胞)等受試體系,根據Ames試驗、染色體畸變試驗、體外微核試驗等遺傳毒性檢測方法,本著風險最大化原則,選取美國香精和提取物制造商協會公認在烘焙食品中安全無毒使用L-香芹酮濃度的3倍(300 mg·L-1)[11],對含有L-香芹酮霧化劑參比煙液氣溶膠的遺傳毒性進行初步評估,并與霧化劑參比煙液氣溶膠進行比較,為L-香芹酮添加劑的合理安全使用提供參考和支持。
1 材料與方法
1.1 材料、試劑和儀器
TA97a、TA98、TA100、TA102和TA1535菌株,來源于美國Moltox公司;中國倉鼠肺細胞,來源于中國科學研究院細胞庫;A549人肺腺癌細胞,來源于復旦大學藥學院。
瓊脂粉(212304A級),美國BD公司;氯化鈉(≥99.5%),海凌峰化學試劑有限公司;組氨酸(99%),北京百靈威科技有限公司;生物素(99%),北京百靈威科技有限公司;營養肉湯(CM1168B),英國OXOID公司;RPMI 1640細胞培養基(Lot2200921),美國Gibco公司;胎牛血清(Dbc0520),美國Hyclone公司;磷酸緩沖液(Lot2028925),美國Gibco公司;0.25%(w/v)胰酶-EDTA(0.25%),美國Gibco公司;絲裂霉素(99.7%),中國食品藥品檢定研究院;冰醋酸(≥99.5%),上海凌峰化學試劑有限公司;甲醇(≥99.5%),上海凌峰化學試劑有限公司;細胞培養皿(100 mm×20 mm),美國Corning公司;Tran swell培養板(12/24 mm),美國Costar公司;DMEM細胞培養基(Lot2120818),美國Gibco公司;無水乙醇(≥99.7%),國藥集團化學試劑有限公司;DMSO(99.9%),美國Sigma公司;霧化劑參比煙液;上海新型煙草制品研究院有限公司配制;含300 mg·L-1 L-香芹酮的霧化劑參比煙液;上海新型煙草制品研究院有限公司配制。
X200AF吸煙機,上海帕夫曼自動化儀器有限公司;Mini Tank煙具,香港Mask King公司;LA2-6AX生物安全柜,新加坡ESCO公司;ECLIPSE TS100倒置相差顯微鏡,日本Nikon公司;BD240恒溫培養箱,德國Binder公司;G-560E漩渦混合器,美國Scientific Industries公司;CKX41顯微鏡,日本Olympus公司;HERA CELL VIOS 160i CO2培養箱,美國Thermo Scientific公司;移液器(5 mL、1 mL和200 μL),德國Eppendorf公司;5810R離心機,德國Eppendorf公司;Vi-cell XR細胞活力分析儀,美國Beckman Coulter公司;U570超低溫冰箱,加拿大New Brunswick公司;3K30離心機,美國Sigma公司;氣-液界面暴露皿,英國BAT公司自制。
1.2 試驗方法
1.2.1 細菌和細胞培養
取營養肉湯培養基5 mL,加入無菌試管中,將冷凍保存的TA97a、TA98、TA100、TA102和TA1535菌株培養物接種于營養肉湯培養基內,37 ℃下振蕩(100次/min)培養10 h。
CHL細胞培養基為含有10%(V/V)胎牛血清的RPMI 1640培養基,培養條件為37 ℃、5%濃度的CO2加濕培養。
1.2.2 氣溶膠產生方式和暴露方式
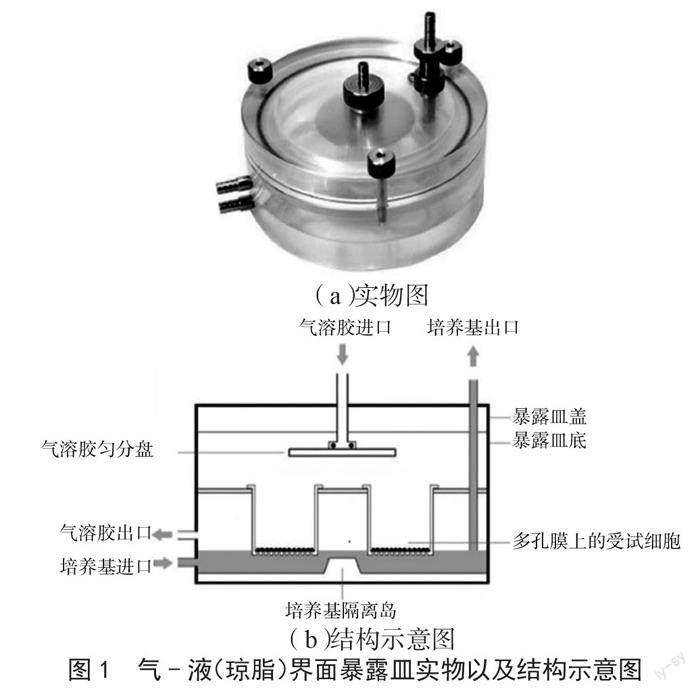
將參比煙液(或含300 mg·L-1 L-香芹酮的參比煙液)裝入Mask King電子煙煙具,煙具充電激活后,接入吸煙機。按照一定的抽吸模式(抽吸間隔30 s,抽吸流量55 mL,抽吸時間3 s,電子煙功率11.3 W)進行抽吸,在吸煙機和電子煙煙具間采用軟管接入氣-液界面暴露皿(圖1),待細胞接種至Trans well培養板(或細菌接種至瓊脂培養皿,然后將培養皿直接放入暴露小室)后,即可產生氣-液(瓊脂)界面暴露染毒,染毒時間為30 min(60口抽吸耗時,煙具單次充電最大抽吸口數),暴露的氣溶膠濃度為電子煙煙液的全煙氣[12]。
1.2.3 遺傳毒性檢測方法
(1)Ames試驗方法。Ames試驗中,將含
0.5 mmol·L-1組氨酸和0.5 mmol·L-1生物素溶液的頂層瓊脂培養基按照0.4 mL/管分裝于60個試管中(共分為陰性對照組、陽性對照組、參比煙液組和含L-香芹酮參比煙液組,每組測試5個菌株,每個菌株
3個平行),45 ℃水浴中保溫,每管依次加入試驗菌株增菌液0.2 mL,PBS或者S9混合液(需代謝活化時)1.0 mL,陽性對照組加入陽性物質溶液(敵可松、疊氮鈉、甲磺酸甲酯或2-氨基芴),充分混勻,取80 μL迅速傾入底層瓊脂平板上,轉動平板,使之分布均勻,置于培養箱,待平皿干燥后受試物組進行全煙氣暴露。陰性對照組不作處理、陽性對照組給予各菌株的陽性對照品。暴露結束后置37 ℃培養箱內倒置培養72 h后觀察結果。若陽性對照組的回復突變數是陰性對照組的3倍或3倍以上,則視為菌株陽性結果,如不符合,則視為陰性結果。
(2)染色體畸變試驗方法。染色體畸變試驗中,將CHL細胞接種在24 mm的trans well小室的頂側,接種密度為2×105 cells/孔,1.5 mL/孔,底側加入1.3 mL含有10%(V/V)胎牛血清的RPMI 1640培養液的培養基。細胞在37 ℃,5% CO2下培養24 h。陰性對照組不作處理;陽性對照組給予絲裂霉素(終濃度為0.2 μg·mL-1);處理組進行全煙氣暴露。在細胞收獲前4 h,每皿加入15 μL濃度為20 μg·mL-1的秋水仙素,使秋水仙素的終濃度為0.2 μg·mL-1。秋水仙素處理4 h后,棄去培養液,加入0.5 mL 0.25%胰酶-EDTA消化細胞。待消化結束后,加入一定量的完全培養液終止消化,終體積為10 mL。取約
0.5 mL細胞懸液計數活細胞數。取剩下的細胞懸液離心后經0.075 mol·L-1氯化鉀低滲、固定、滴片,干燥后Giemsa染色,干燥后封片待閱。記錄染色體結構畸變細胞數和畸變類型,畸變類型包括斷裂、缺失、交換、環狀、三輻體、四輻體和粉碎等。裂隙和染色體數目畸變(多倍體和內復制)單獨記錄,不計入畸變率中。若細胞的染色體畸變率與陰性對照組存在顯著性差異,則視為陽性結果,若不符合,則視為陰性結果。
(3)體外微核試驗方法。體外微核試驗中,將CHL細胞接種在12 mm的trans well小室的頂側,接種密度為1.5×105 cells/孔,0.5 mL/孔,底側加入
1 mL培養基。細胞在37 ℃,5% CO2下培養24 h。陰性對照組不作處理;陽性對照組給予絲裂霉素(終濃度為0.1 μg·mL-1);處理組進行全煙氣暴露,暴露結束后繼續培養24 h,然后棄去培養液,加
0.2 mL的0.25%胰酶-EDTA消化細胞。待消化結束后,加入一定量的完全培養液終止消化,終體積為10 mL。取約0.5 mL細胞懸液計數活細胞數。取剩下的細胞懸液離心后經0.075 mol·L-1的氯化鉀低滲、甲醇∶冰醋酸(3∶1)固定、滴片,干燥后Giemsa染色,干燥后封片,后在光學顯微鏡(100×10倍)下觀察并計數500個細胞,分別計數其中單核、雙核、三核、四核細胞的數量,每個劑量組計數1 000個雙核細胞中出現微核的數量,并計算微核率。若細胞的微核率與陰性對照組存在顯著性差異,則視為陽性結果,若不符合,則視為陰性結果。
1.2.4 數據統計
Ames試驗中,培養結束后,顯微鏡下觀察培養皿中菌斑的生長情況,同時計數每皿的菌落數,結果以均數±標準差表示。染色體畸變試驗中,畸變率=出現結構畸變染色體細胞/觀察細胞數×100%,采用卡方檢驗進行統計分析。體外微核試驗中,微核率=(含有微核的雙核細胞數)/至少1 000個雙核細胞總數×1 000,采用卡方檢驗進行統計分析。
2 結果與分析
2.1 Ames試驗結果
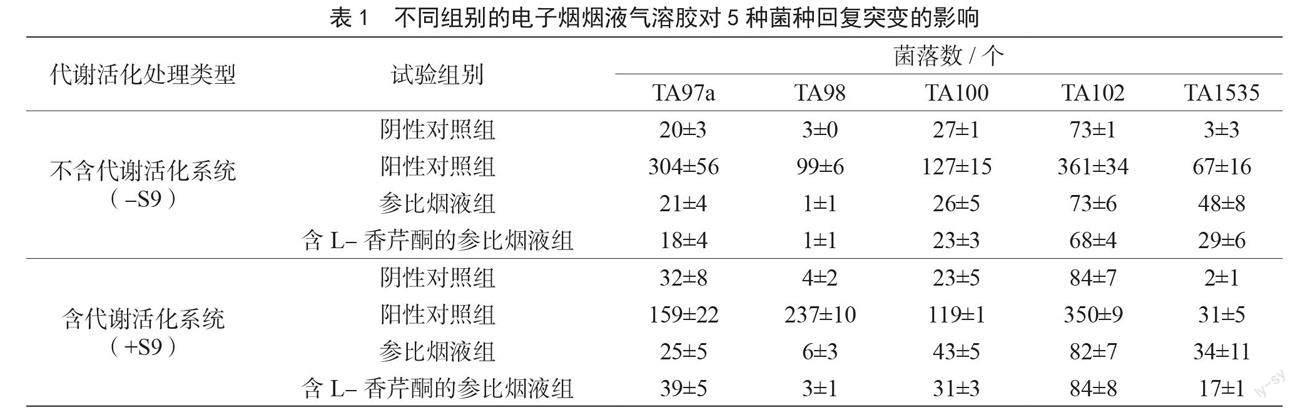
由表1可知,與陰性對照組相比,在有無代謝活化系統的情況下,陽性對照組所有菌株的菌落數均至少是陰性對照組的培養皿中的菌落數的3倍,試驗系統有效,可檢測出有致突變物質。暴露參比煙液氣溶膠和含L-香芹酮的參比煙液氣溶膠后,在有無代謝活化系統的情況下,菌株TA97a、TA98、TA100、TA102和TA1535背景菌斑均正常,培養皿中TA97a、TA98、TA100和TA102菌株的菌落數均未達到各自空白對照組培養皿中菌落數的3倍或者3倍以上,只有菌株TA1535菌落數超過空白對照組菌落數的3倍以上,結果為可疑陽性。與參比煙液組相比,在不含活化系統S9情況下,含L-香芹酮的參比煙液組的5種菌株的細菌突變菌落數降低幅度為0%~39.6%,而含活化系統S9的情況下,TA97a和TA102菌株的菌落數增加56.0%和2.4%,TA98、TA100和TA1535菌株的菌落數分別降低50%、27.9%和50%,L-香芹酮的添加改變了參比煙液的細菌突變菌落數,但增加或降低的變化幅度均在60%以下。
2.2 染色體畸變試驗結果
由表2可知,與陰性對照組比較,陽性對照組(絲裂霉素處理)的染色體畸變細胞率明顯升高,畸變率具有極顯著的統計學差異(P<0.01),證明本實驗系統有效。但與陰性對照組比較,參比煙液氣溶膠組和含L-香芹酮參比煙液氣溶膠組染色體畸變率分別為2.3%和1.7%,無顯著性差異。同時與參比煙液氣溶膠組相比,加入L-香芹酮后霧化劑參比煙液氣溶膠的染色體畸變率降低0.6%。
2.3 體外微核試驗結果
由表3可知,與陰性對照組比較,陽性對照組(絲裂霉素處理)的總微核率明顯升高,具有極顯著差異(P<0.01),證明本實驗系統有效。與陰性對照組比較,參比煙液氣溶膠組和含L-香芹酮的參比煙液氣溶膠組微核率分別為10.55‰和9.00‰,差異不明顯。與參比煙液氣溶膠組相比,加入L-香芹酮后霧化劑參比煙液氣溶膠微核率降低1.55‰。
3 討論
細菌回復突變試驗作為致突變物的早期篩選和前期研究階段手段,主要利用營養缺陷型菌株,在選擇培養基上經外源性物質處理后,觀察菌株的回復突變情況,用來判斷致突變能力,是科研機構和政府公認的測定新化學物質和新藥潛在致突變性的檢測方法[13]。對于電子煙遺傳毒性的評價,將電子煙氣溶膠整體看作外源性混合物,可以通過細菌回復突變試驗檢測電子煙氣溶膠引起的堿基水平上的致突變作用[14]。同時,由于電子煙的特殊使用方式,AZZOPARDI等[15]認為氣-液界面暴露的方式進行遺傳毒性檢測較為科學,可用于檢測吸入制品的安全性評價。霧化體中的單一添加劑的安全性,不僅要考慮物質本身的遺傳毒性,還應考慮單一添加劑與其他物質的交互作用。
關于L-香芹酮的經口毒性,PROGRAM等[16]在對B6C3F1小鼠每周給藥5 d,劑量為375 mg·kg-1或750 mg·kg-1,連續2年進行重復灌胃染毒,未發現L-香芹酮對B6C3F1小鼠具有致癌活性。但吸入途徑的遺傳毒性還未見報道。因此,本次研究基于上述考慮,采用了氣-液(瓊脂)界面的暴露方式,測試添加L-香芹酮后對參比煙液氣溶膠整體遺傳毒性的影響。
電子煙氣溶膠的遺傳毒性已有較多文獻報道,THORNE等[17]研究發現在長達112.5 min的未稀釋電子煙氣溶膠暴露后,菌株均未發現致突變現象,認為電子煙氣溶膠致細菌回復突變能力較弱。這與本實驗中參比煙液氣溶膠未引起TA97a、TA98、TA100和TA102等4種菌株回復突變的結果較為類似,但本試驗中TA1535菌株在有、無代謝活化系統的情況下,霧化劑參比煙液氣溶膠和含L-香芹酮的參比煙液氣溶膠均發生了致突變效應,這可能是由于參比煙液氣溶膠殺死了大部分TA1535細菌,使殘存的細菌得以利用培養基中微量的組氨酸和生物素生長成肉眼可見的菌落,但這并非是回復突變菌落,而是由煙液氣溶膠毒性導致的假陽性結果[18]。同時,與陰性對照組相比,添加L-香芹酮后也未引起致突變菌落數目的明顯增加,說明L-香芹酮不具有增加參比煙液氣溶膠的潛在致突變能力。
在染色體畸變試驗和微核試驗中,與參比煙液組相比,未發現添加L-香芹酮后的煙液氣溶膠引起染色體畸變率和微核率的上升,不存在導致細胞染色體畸變和微核突變潛在能力。與陰性對照組相比,參比煙液氣溶膠引起的染色體畸變或微核形成率上升不明顯,這與MANOJ等[19]和GANAPATHY等[20]的研究結果較為一致。因此,添加L-香芹酮的參比煙液氣溶膠對染色體復制和細胞分裂過程的影響較小,未見明顯的遺傳毒性效應。根據遺傳組合試驗判斷規則[21],添加300 mg·L-1的L-香芹酮不會增加參比煙液氣溶膠的遺傳毒性。
霧化氣溶膠的遺傳毒性一直是關注的熱點,現在針對氣溶膠的遺傳毒性大多數采用氣-液界面暴露方式[22],但關于霧化添加劑的遺傳毒性的評價還很欠缺。有文獻單獨考察了單一添加劑的遺傳毒性[16],但霧化氣溶膠的成分較為復雜,檢測遺傳毒性時應考慮添加劑之間的相互作用。本文采取參比煙液氣溶膠作為本底,考察了單一添加劑L-香芹酮添加后整體煙液的遺傳毒性,為霧化添加劑的遺傳毒性評價提供了一個新的思路。本試驗還存在一些缺陷,如僅考慮了L-香芹酮的3倍使用劑量的遺傳毒性,暴露時間受霧化設備的限制也僅設置了
30 min,可進一步研究高劑量或者長時間暴露條件下的L-香芹酮的遺傳毒性。
4 結論
本試驗條件下,采取氣-液(瓊脂)界面暴露,加入300 mg·L-1的L-香芹酮暴露30 min后,未改變霧化劑參比煙液氣溶膠的遺傳毒性。可見L-香芹酮在限定劑量下其吸入途徑的遺傳毒性風險較小。
參考文獻
[1]馬晨,劉興利,趙志剛,等.香芹酮香料合成方法的改進[J].西南民族大學學報自然科學版,2003,29(3):
308-310.
[2]康欽.(+)-香芹酮和(-)-香芹酮對成年大鼠膠狀質神經元谷氨酸能自發性興奮傳遞的作用[D].南昌:南昌大學,2013.
[3]AMY F,CHERYL H,JAMES C,et al.Evidence, alarm, and the debate over e-cigarettes[J].Science,2019,366:1318-1320.
[4]BAHL V,LIN S,XU N,et al.Comparison of electronic cigarette refill fluid cytotoxicity using embryonic and adult models[J].Reproductive Toxicology,2012,34(4):529-537.
[5]BEHAR R Z,DAVIS B,WANG Y,et al.Identification of toxicants in cinnamon-flavored electronic cigarette refill fluids[J].Toxicology in Vitro,2014,28(2):198-208.
[6]CHEN H,HAN S L,ZHANG S,et al.In vitro cytotoxicity evaluation of electronic cigarette liquids and their main chemical components[J].Tobacco Science & Technology,2019,52(2):72-78.
[7]BEHAR R Z,DAVIS B,WANG Y,et al.Identification of toxicants in cinnamon-flavored electronic cigarette refill fluids[J].Toxicology in Vitro,2014,28(2):198-208.
[8]THORNE D,CROOKS I,HOLLINGS M,et al.The mutagenic assessment of an electronic-cigarette and reference cigarette smoke using the Ames assay in strains TA98 and TA100[J].Mutation Research/genetic Toxicology & Environmental Mutagenesis,2016,8(12):29-38.
[9]MANOJ M,LEVERETTE R D,COOPER B T,
et al.Comparative in vitro toxicity profile of electronic and tobacco cigarettes, smokeless tobacco and nicotine replacement therapy products: e-liquids, extracts and collected aerosols[J].International Journal of Environmental Research & Public Health,2014,11(11):11325-11347.
[10]AZZOPARDI D,PATEL K,JAUNKY T,
et al.Electronic cigarette aerosol induces significantly less cytotoxicity than tobacco smoke[J].Toxicology Mechanisms and Methods,2016,26(6):477-491.
[11]The Flavor and Extract Manufacturers Association of the United States.GRAS flavoring substances 26[EB/OL].(2012-01-01)[2023-04-06].https://www.femaflavor.org/sites/default/files/26.%20GRAS%20Substances%20%284728-4778%29.pdf.
[12]SCOTT K,SAUL J,CROOKS I,et al.The resolving power of in vitro genotoxicity assays for cigarette smoke particulate matter[J].Toxicology in Vitro,2013,27(4):1312-1319.
[13]趙閣,王昇,余晶晶,等.新型煙草制品生物標志物研究進展[J].煙草科技,2014(9):84-89.
[14]KADIMISETTY K,MALLA S,RUSLING J F.Automated 3-d printed arrays to evaluate genotoxic chemistry:E-cigarettes and water samples[J].ACS Sensors,2017,2(5):670-678.
[15]AZZOPARDI D,HASWELL L E,FOSS-SMITH G,
et al.Evaluation of an air-liquid interface cell culture model for studies on the inflammatory and cytotoxic responses to tobacco smoke aerosols[J].Toxicology in Vitro,2015,29(7):1720-1728.
[16]PROGRAM N T.NTP toxicology and carcinogenesis studies of d-carvone (CAS No. 2244-16-8) in B6C3F1 mice (gavage studies)[J].National Toxicology Program Technical Report,1990,381:111-113.
[17]THORNE D,HOLLINGS M,SEYMOUR A,
et al.Extreme testing of undiluted e-cigarette aerosol in vitro using an Ames air-agar-interface technique[J].Mutation Research,2018,828(4):46-54.
[18]陳穎,姜娟,楊陽,等.Ames試驗假陽性的判斷方法[J].生物技術通訊,2014,25(2):242-244.
[19]MANOJ M,LEVERETTE R D,COOPER B T,
et al.Comparativein vitrotoxicity profile of electronic and tobacco cigarettes, smokeless tobacco and nicotine replacement therapy products: e-liquids, extracts and collected aerosols[J].International Journal of Environmental Research & Public Health,2014,11(11):11325-11347.
[20]GANAPATHY V,MANYANGA J,BRAME L,
et al.Electronic cigarette aerosols suppress cellular antioxidant defenses and induce significant oxidative DNA damage[J].Plos One,2017,18(5):1-20.
[21]KLAASSEN CURTIS D.PhD.Casarett and doulls essentials of toxicology [M].New York:McGraw-Hill Education/Medical,2015.
[22]WEBER S,HEBESTREIT M,WILMS T,et al.Comet assay and air–liquid interface exposure system: a new combination to evaluate genotoxic effects of cigarette whole smoke in human lung cell lines[J].Toxicology in Vitro,2013,27(6):1987-1991.

