長非編碼RNA HOXD-As2通路抑制直腸癌細胞增殖、轉移作用機制研究
葉鵬程, 楊鈞淞, 唐 錦, 譚 淼, 吳東津, 魏壽江
川北醫學院附屬醫院 胃腸外一科,四川 南充 637000
在世界癌癥發病率與病死率排名中,直腸癌分別位于第3位與第4位[1]。每年有超過100萬的直腸癌新病例,約70萬患者死于直腸癌[2]。直腸癌的發生、發展涉及多種因素,包括癌基因的激活與抑癌基因的失活[3]。腫瘤抑制基因的突變對于非侵襲性疾病向侵襲性疾病的轉變至關重要。侵襲性直腸癌中的突變頻率與惡性腫瘤程度相關[4-5]。長非編碼RNA(long noncoding RNA,LncRNA)是一類長度>200 bp的RNA,沒有編碼蛋白質的能力[6]。與microRNA及其他小的非編碼RNA不同,LncRNA可以通過轉錄和翻譯來調控下游的目標基因[7]。LncRNA HOXD-As2位于2號染色體上,為homeobox D基因的反義鏈[8]。本研究旨在探討LncRNA HOXD-As2通路抑制直腸癌細胞增殖、轉移的潛在機制。現報道如下。
1 材料與方法
1.1 實驗材料及設備 直腸癌細胞HCT116購自廣州群賢科技有限公司(貨號:CH1101)。HT29細胞購自廣州悅行生物科技有限公司(貨號:T1028)。Trizol試劑購自上海玻爾化學試劑有限公司(貨號:B645504)。HOXD8抗體購自廣州市魯誠生物科技有限公司。上皮性鈣粘蛋白(E-Cadherin)抗體購自沈陽萬類生物科技有限公司(貨號:WLH4321)。神經性鈣粘蛋白(N-Cadherin)抗體購自廣州碩恒生物科技有限公司(貨號:sc-59987)。基質金屬蛋白酶9 (matrix metalloproteinase 9,MMP-9)抗體購自廣州文奇生物科技有限公司(貨號:ab38898)。蛋白激酶B(protein kinase B,AKT)抗體購自昆明皇寶商貿有限公司(貨號:AA326)。雷帕霉素機械靶蛋白(mechanistic target of rapamycin,mTOR)抗體購自北京依珊匯通科技有限公司(貨號:mTOR001)。磷脂酰肌醇-3-激酶(phosphoinositide-3 kinase,PI3K)抗體購自北京沃格東方科技有限公司(貨號:PI3K001)。磷酸化磷脂酰肌醇-3-激酶(phosphorylated phosphatidylinositol 3-kinase,p-PI3K)抗體購自廣州永諾生物科技有限公司(貨號:YNKT099)。磷酸化蛋白激酶B(phosphorylated protein kinase B,p-AKT)抗體購自北京伊諾凱科技有限公司(貨號:05-1003)。磷酸化雷帕霉素機械靶蛋白(phosphorylated mechanistic target of rapamycin,p-mTOR)抗體購自廣州沃亙生物科技有限公司(貨號:OGCP-04-54)。
1.2 研究方法
1.2.1 細胞培養與分組 直腸癌細胞HCT116或HT29在DMEM培養基中培養,加入10%胎牛血清,37℃培養箱。檢測前2 d,將HOXD8與LncRNA HOXD-As2過表達質粒通過Lipofectamine 2000轉染至HCT116或HT29細胞中。其中,轉染陰性設為對照組,轉染LncRNA HOXD-As2過表達質粒設為HOXD-As2組;轉染空載體Vector設為Vector組,轉染HOXD8過表達質粒設為HOXD8組。
1.2.2 RNA抽取與實時熒光定量聚合酶鏈式反應 采用Trizol試劑從直腸癌細胞HCT116或HT29中分離RNA,用反轉錄系統合成cDNA。采用Power SYBR Green PCR Master Mix檢測HOXD8的mRNA表達,以GAPDH作為內源對照。
1.2.3 熒光素酶報告實驗 含有HOXA-AS2推定靶點的HOXD8野生體(HOXD8-WT)序列片段被合成并插入pmirGLO載體中。使用QuikChange Ⅱ位點定向誘變試劑盒產生HOXD8突變體(HOXD8-MT),突變位點為HOXA-AS2的結合位點。將含有HOXD8-WT的載體、HOXD8-MT的載體、HOXA-AS2過表達載體以及對照載體轉染至直腸癌細胞HCT116或HT29。轉染后48 h,使用雙熒光素酶報告系統檢測Renilla熒光素酶和螢火蟲熒光素酶的活性。相對熒光素酶的活性被標準化為Renilla熒光素酶的活性。
1.2.4 細胞活力與細胞增殖水平檢測 處理過的直腸癌細胞HCT116或HT29置于96孔板中24、48、72或96 h,采用0.5 mg/ml四氮唑鹽溶液培養3 h,然后用0.01 mmol/L氯化氫緩沖液后用細胞組織快速裂解液裂解細胞,用酶標儀測量450 nm處吸光度。將有指定轉染的直腸癌細胞HCT116或HT29置于6孔板中,每3 d更換1次培養基。2周后,采用0.4%結晶紫對甲醛固定的細胞進行染色,然后在光學顯微鏡下進行計數。
1.2.5 細胞侵襲和細胞遷移水平的檢測 將指定轉染的直腸癌細胞HCT116或HT29置于6孔板中,并通過吸管劃傷。24 h后,清除碎片,在顯微鏡下拍攝傷口寬度,并通過Image J軟件計算。在涂有Matrigel的Transwell試驗室的上腔填充100 μl無胎牛血清DMEM中的直腸癌細胞HCT116或HT29懸浮液。將含有15%胎牛血清的DMEM(600 μl)放入下腔。48 h后,用0.1%水晶紫對下腔室中的甲醛固定細胞進行染色,并在顯微鏡下進行計數。
1.2.6 免疫印跡 直腸癌細胞HCT116或HT29在細胞組織快速裂解液裂解和提取緩沖液中進行裂解。酸性蛋白試劑盒被用來測定細胞裂解液中的蛋白濃度。使用十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳分離細胞裂解液,然后將蛋白質樣品電轉到聚偏二氟乙烯膜上。采用5%牛血清白蛋白溶液阻斷膜,然后采用一級抗體過夜。采用相應的辣根過氧化物酶標記的二抗(1∶5 000)孵育后,用增強化學發光法檢測膜上條帶的免疫活性。通過Image J軟件以β-actin為內參計算條帶灰度值。
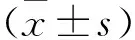
2 結果
2.1 對照組與HOXD-As2組熒光素酶活性及相應的mRNA、蛋白表達比較 與對照組相比,HOXD-As2組熒光素酶活性下降,而mRNA、蛋白相對表達情況增加,差異均有統計學意義(P<0.05)。見表1。
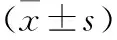
表1 對照組與HOXD-As2組熒光素酶活性及mRNA、蛋白相對表達情況比較
2.2 LncRNA HOXD-As2對直腸癌細胞增殖及轉移影響 與對照組相比,HOXD-As2組直腸癌細胞HCT116、HT29細胞活力、細胞增殖、細胞侵襲、細胞遷移水平及N-cadherin、MMP-9蛋白表達均下降,E-cadherin蛋白表達增加,差異均有統計學意義(P<0.05)。見圖1。
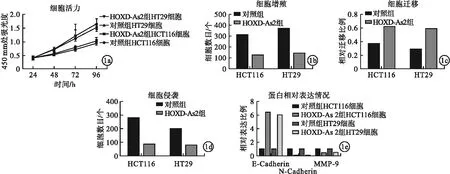
圖1 LncRNA HOXD-As2對直腸癌細胞增殖及轉移影響(a.不同時間點HCT116與HT29細胞活力水平;b.LncRNA HOXD-As2對細胞增殖水平影響;c.LncRNA HOXD-As2對細胞侵襲水平影響;d.LncRNA HOXD-As2對細胞遷移水平影響;e.LncRNA HOXD-As2對細胞E-cadherin、N-cadherin與MMP-9蛋白相對表達情況影響)
2.3 LncRNA HOXD-As2靶向HOXD8對直腸癌細胞增殖及轉移影響 與對照組相比,HOXD-As2組直腸癌細胞HCT116、HT29中HOXD8的mRNA與蛋白表達水平均顯著上升,差異均有統計學意義(P<0.05)。與Vector組相比,HOXD8組直腸癌細胞HCT116、HT29細胞活力、細胞增殖、細胞侵襲、細胞遷移水平及N-cadherin、MMP-9蛋白表達均顯著下降,E-cadherin蛋白表達增加,差異均有統計學意義(P<0.05)。見圖2。
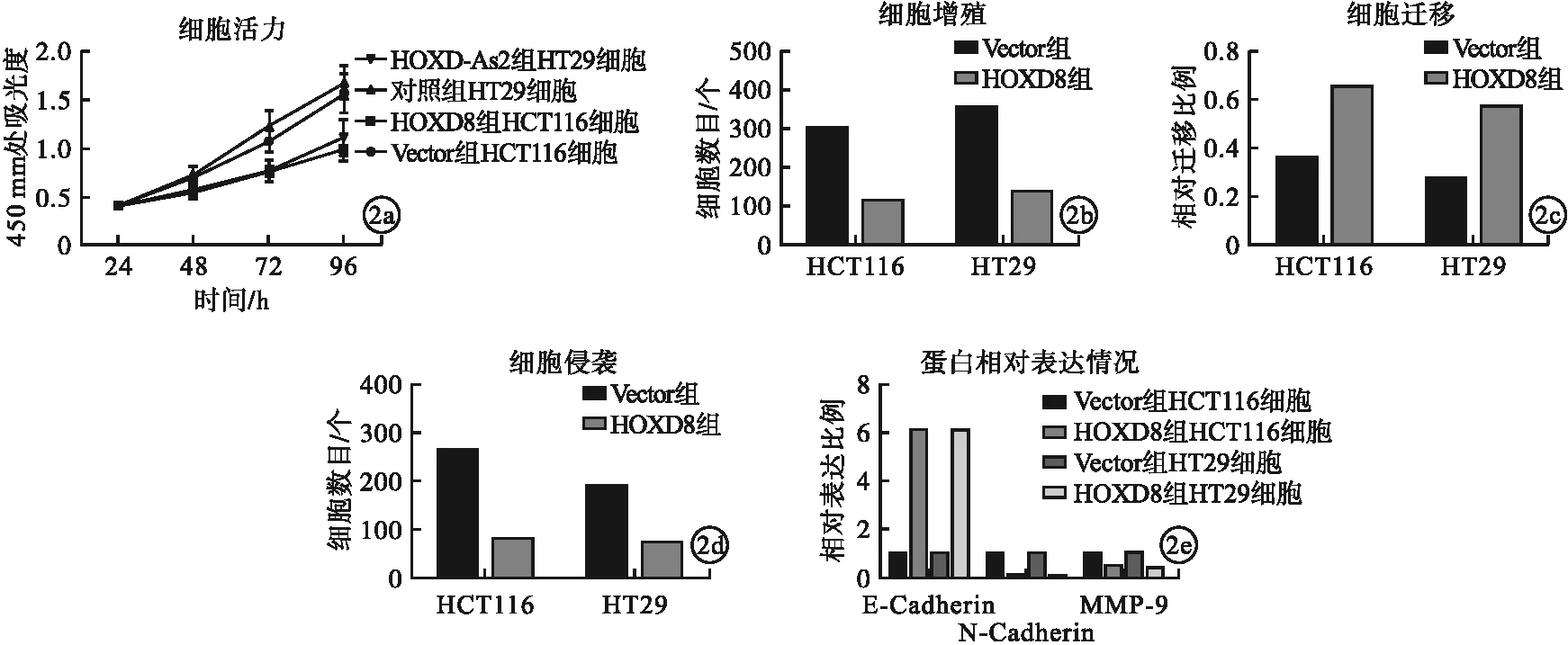
圖2 LncRNA HOXD-As2靶向HOXD8對直腸癌細胞增殖及轉移影響(a.不同時間點LncRNA HOXD-As2靶向HOXD8對細胞活力水平;b.LncRNA HOXD-As2靶向HOXD8對細胞增殖水平;c.LncRNA HOXD-As2靶向HOXD8對細胞侵襲水平;d.LncRNA HOXD-As2靶向HOXD8對細胞遷移水平;e.LncRNA HOXD-As2靶向HOXD8對細胞E-cadherin、N-cadherin和MMP-9蛋白相對表達情況)
2.4 LncRNA HOXD-As 對直腸癌細胞增殖及轉移機制影響 HOXD-As2組直腸癌細胞HCT116、HT29中p-AKT/AKT、p-PI3K/PI3K、p-mTOR/mTOR水平均低于對照組,差異均有統計學意義(P<0.05)。HOXD8組直腸癌細胞HCT116、HT29中p-AKT/AKT、p-PI3K/PI3K、p-mTOR/mTOR水平均低于Vector組,差異均有統計學意義(P<0.05)。見圖3。

圖3 LncRNA HOXD-As對直腸癌細胞增殖及轉移機制影響(a.過表達LncRNA HOXD-As2對 細胞p-AKT/AKT、p-PI3K/PI3K、p-mTOR/mTOR相對表達水平影響;b.過表達HOXD8對細胞p-AKT/AKT、p-PI3K/PI3K、p-mTOR/mTOR相對表達水平影響)
3 討論
腫瘤作為一種多基因疾病,其主要機制為細胞逃避正常的生長控制進行自主增殖;同時,通過原癌基因的激活或腫瘤抑制基因的突變或缺失而表現出一定的侵襲性[9]。癌癥的發生存在許多調節因素,這些調節因子可以控制癌基因或抑癌基因的表達,發揮促進或抑制腫瘤發展作用。LncRNA作為一類沒有編碼蛋白質的能力的RNA,其在人體中可以通過調控各種細胞因子、促凋亡和抗凋亡基因等信號分子的表達,控制細胞的增殖、分化和凋亡。LncRNA與腫瘤的發生、發展及預后密切相關[10]。HOXD-AS2作為Homeobox D基因的反義鏈,主要定位于人染色體2q31.1,長度為692 bp。有研究報道,LncRNA HOXD-AS2在神經膠質瘤中高表達,并與神經膠質瘤分級和預后不良[11]。Yang等[12]研究發現,LncRNA HOXD-AS1可以通過抑制HOXD3誘導的整聯蛋白β3轉錄激活和MAPK/AKT信號通路來調控大腸癌的生長和轉移,但具體機制并不清楚。
本研究結果發現,與對照組相比,HOXD-As2組直腸癌細胞HCT116、HT29細胞活力、細胞增殖、細胞侵襲、細胞遷移水平及N-cadherin、MMP-9蛋白表達均下降,E-cadherin蛋白表達增加,差異均有統計學意義(P<0.05)。這提示,LncRNA HOXD-As2可能通過調控E-cadherin、N-cadherin和MMP-9蛋白表達參與直腸癌細胞增殖、侵襲及遷移。有研究報道,LncRNA HOXD-AS2的表達下降通過靶向HOXD8促進胃癌進展[13]。在膠質瘤中,LncRNA HOXD-AS2的下調通過抑制腫瘤細胞的增殖及遷移改善膠質瘤患者的預后[14]。Homeobox基因作為發育調節基因,在胚胎發育過程中給予細胞位置信息[15]。有研究報道,HOX基因參與肺癌、乳腺癌、口腔癌、食道癌以及黑色素瘤腫瘤的發展[16-17]。在直腸癌中,與原發組織相比,HOXD8的表達在臨床癌癥組織中特別是在轉移灶中被下調[18]。本研究結果顯示,與Vector組相比,HOXD8組直腸癌細胞HCT116、HT29的細胞活力、細胞增殖、細胞侵襲、細胞遷移水平及N-cadherin、MMP-9蛋白表達均顯著下降,E-cadherin蛋白表達增加,差異均有統計學意義(P<0.05)。這提示,LncRNA HOXD-As2可能通過與靶基因HOXD8相互作用,抑制PI3K/Akt通路影響直腸癌細胞增殖和轉移。這可能是由于PI3K/AKT信號通路作為人體中調控腫瘤生長、轉移的一個關鍵通路,激活PI3K/AKT信號通路可明顯的抑制腫瘤細胞的凋亡[19-20]。
綜上所述,LncRNA HOXD-As2通過與靶基因HOXD8相互作用,上調HOXD8的mRNA與蛋白表達水平,抑制PI3K/Akt通路,降低直腸癌細胞增殖與轉移水平。

