長孢輪枝菌犜犪狇Man MGB探針實時熒光PCR快速檢測方法
段維軍 李雪蓮 呂燕等





關鍵詞 長孢輪枝菌;實時熒光PCR; TaqMan-MGB探針;
檢測
中圖分類號:S 432.44 文獻標識碼:A DOI:10.16688/j.zwbh 2022332
長孢輪枝菌Verticillium longisporum(C.Stark) Karapapa,Bainbr.&Heale,隸屬于真菌界Fungi,子囊菌門Ascomycota,盤菌亞門Pezizomy-cotina,糞殼菌綱Sordariomycetes,肉座菌亞綱Hypocreomycetidae,小叢殼目Glomerellales,不整小球囊菌科Plectosphaerellaceae,輪枝菌屬Verti-cillium[1]。該病菌目前主要分布于歐洲的瑞典[2]、德國[3]、英國[4-5]、比利時[6]、俄羅斯[7],北美洲的美國[8]和加拿大[3],亞洲的日本[9]和中國[10]。該病菌在中國局部分布,是近年新發現的植物病害。
長孢輪枝菌其主要寄主作物是十字花科植物,主要包括油菜Brassica napus、甘藍B.oleracea、花椰菜B.oleracea var. botrytis、卷心菜B.oleraceavar.capitata、抱子甘藍B.oleracea var. gemmif-era、苤藍B.oleracea var. gongylodes、蕪菁B.ra-pa、辣根Armoracia rusticana等[9,11-16]。在有些植物中,長孢輪枝菌與其近似種大麗輪枝菌Verticilli-um dahliae沒有顯著的寄主劃分,例如油菜[2]、辣根[17]、甜菜Beta vulgarjs[18]、擬南芥Arabidopsis thaliana[19-20]和蘿卜Raphanus sativus[21]。致病性測定研究表明,長孢輪枝菌也可侵染非十字花科植物[22],如小麥Triticum aestivum、豌豆Pisum sati-vum和燕麥Avena sativa[23]。
輪枝菌常隨植物商品貿易而廣泛擴散,如大麗輪枝菌[24],長孢輪枝菌不產生氣生孢子,是一種土傳病原菌[14],從該病菌A1/D1株系的廣泛傳播可以看出,人類活動在病害傳播過程中起了重要作用[24]。對病菌進行有效快速檢測是防范其危害的重要技術基礎,可為抗病育種、植物檢疫、防治效果評價等多項工作提供技術手段。目前,針對長孢輪枝菌的主要檢測鑒定方法多為形態學結合DNA序列分析方法等[2-5,7,10,15],費時費力,且靈敏度不高。和常規PCR檢測方法相比,實時熒光PCR檢測方法具有檢測時效快、特異性強、靈敏度高和易于操作等優點。本研究以長孢輪枝菌的actzn序列片段為靶標,建立了基于Taq Man-MGB探針的長孢輪枝菌快速檢測方法,為長孢輪枝菌的檢測提供技術支持。
1材料與方法
1.1供試菌株與引物、探針的設計合成
供試菌株共計46株,分別為:從青海蘿卜上分離鑒定的7株長孢輪枝菌(均為A1/D1株系),從荷蘭微生物菌種保藏中心獲得的2株長孢輪枝菌(CBS 124.64為AID3株系,CBS 110220株系不詳),以及一些其他種屬的植物真菌37株(表1)。以上菌株均保存于本實驗室,采用無菌水保存法保存,備用。
通過分析長孢輪枝菌及其近似種actin基因間的差異,應用Primer Express 3.0軟件設計了特異性引物VLAF1(5′-GTGCCGCGGGCAAA-3′)、VLARl(5′-ACCGACAATGGAAGCTTGAAA-3′)以及探針VLAP1(5′-CTCGACATGATCTTTG-3′),預期產物大小為62bp(圖1)。引物和TaqMan-MGB探針由上海立菲公司合成。
1.2 DNA提取
1.2.1菌絲DNA提取
用滅菌槍頭刮取PDA平板上培養10 d的菌絲體,根據TANBeadPlant DNA Auto Kit操作說明,利用自動化核酸提取儀(ThermoFisher,King-fisher mL型),提取DNA。經超微量分光光度計(ThermoFisher,NanoDrop 2000C型)檢測DNA濃度后,保存于-20℃備用。
1.2.2組織樣品DNA提取
取蘿卜組織約0.1 g,切成細絲狀,提取DNA所用設備及試劑盒同1. 2.1。
1.3引物和探針特異性檢測
采用10μL擴增反應體系:2×TaqMan Uni-versal PCR Master Mix 5μL,正向引物VLAF1(10μmol/L)0.5μL,反向引物VLAR1(10μmol/L)0.5μL,探針VLAP1(10 μmol/L)0.5μL,模板(供試菌株)DNA 1μL,超純水2.5μL。以超純水為空白對照。
反應條件為:95℃10 min;95℃15s,60℃1min,40個循環。
1.4實時熒光PCR體系的優化
1.4.1引物濃度優化
以菌株LV19-5 DNA為模板,正、反向引物濃度分別以0.1μmol/L遞增,分別從0.1μmol/L遞增至1.0μmol/L,1.3體系中其余各成分濃度保持不變,進行實時熒光PCR擴增,反應條件同1.3。
1.4.2探針濃度優化
以菌株LV19-5 DNA為模板,探針濃度以0.1μmol/L遞增,從0.1μmol/L遞增至1.0μmol/L,采用1.4.1優化后的引物濃度,1.3體系中其余各成分濃度保持不變,進行實時熒光PCR反應擴增,反應條件同1.3。
1.5靈敏度檢測
以菌株LV19-5DNA為模板,用滅菌超純水將DNA進行10倍梯度稀釋,每個梯度進行3次重復,開展靈敏度檢測。在10μL反應體系中,DNA含量分別為10ng、1.0ng、100pg、10pg、1.0pg。利用優化后的引物及探針濃度進行實時熒光PCR,反應條件同1.3。
1.6重復性試驗
以菌株LV19-5 DNA為模板進行重復性檢測。用上述相同的條件分別進行3次獨立重復試驗,分析組內、組間差異。計算平均Ct值、標準偏差(standard deviation,SD)和變異系數(coefficient of variation, CV)。
1.7樣品檢測
選取2021年10月從青海采集的蘿卜黑心病感病樣品7份,從寧波菜市場購買的健康蘿卜13份,參照1.2.2方法,取蘿卜肉質組織提取DNA,進行實時熒光PCR檢測,檢驗該方法的實用性。
2結果與分析
2.1特異性檢測
在相同條件下,對表1中參試的9株長孢輪枝菌及其他37株菌進行實時熒光PCR檢測。結果顯示,所選取的來自不同地理來源的9株長孢輪枝菌可擴增產生明顯擴增曲線,無擴增的為其他參試菌及空白對照。說明此實時熒光PCR檢測方法具有較好的種特異性。
2.2實時熒光定量PCR的體系優化
2.2.1引物濃度優化
引物濃度優化試驗結果顯示,在0.1~0.8μmol/L范圍內,Ct值隨著濃度增大而減小,而△Rn值隨著濃度增大而增大。因此,引物的最佳濃度為0.8μmol/L,此時Ct值最小,并且△Rn值達到最大(圖2)。
2.2.2探針濃度優化
在確定最佳引物濃度的基礎上進行探針濃度優化試驗。結果顯示,在0.1~0.8μmol/L范圍內,Ct值隨著濃度增大而減小,而△Rn值隨著濃度增大而增大。因此,探針的最佳濃度為0.8μmol/L,此時Ct值最小,并且△Rn值達到最大(圖3)。
2.2.3優化后的反應體系
通過優化引物和探針濃度,得到優化后的反應體系:2×TaqMan Universal PCR Master Mix5μL,引物VLAR1(10μmol/L)0.8μL,引物VLAF1(10μmol/L)0.8μL,探針VLAP1(10μmol/L)0.8μL,DNA 1μL, ddHO補足10μL。
2.3靈敏度檢測及標準曲線的建立
靈敏度試驗結果表明,本研究所建立的實時熒光PCR最低檢測限是10 pg(圖4)。
通過實時熒光PCR檢測已知濃度梯度的總DNA,發現DNA濃度越高,Ct值越小,3個平行試驗結果顯示,所得標準曲線為y=-3.66x+26.83(R=0.9984),x代表DNA濃度的對數,y代表相應的Ct值(圖5)。
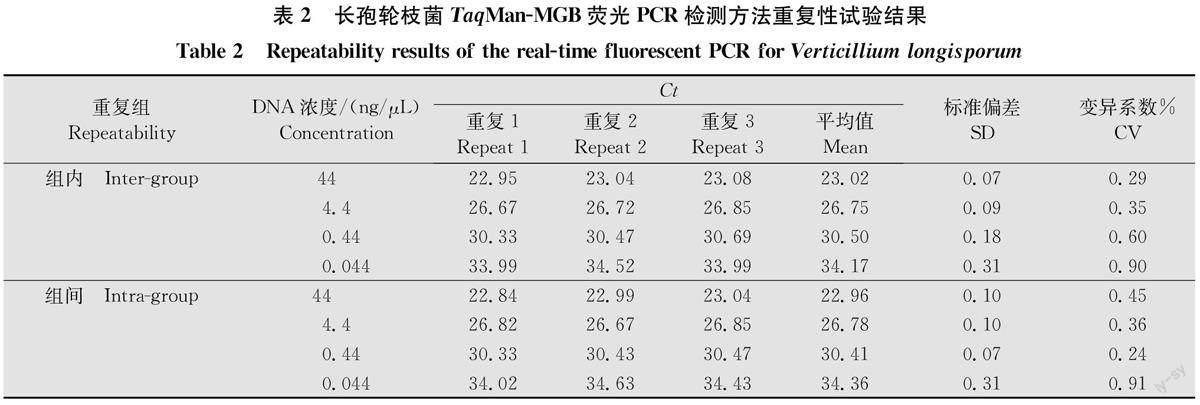
2.4重復性檢測
以菌株LV19-5 DNA的4個濃度(44、4.4、0.44、0.044ng/μL)進行組內、組間重復測定,各3次。通過統計分析可見,組內、組間重復CV值均小于1%,分別為0.29%~0.90%,0.24%~0.91%,說明本研究所建立的針對長孢輪枝菌的Taq Man-MGB熒光PCR檢測方法,具有較好的重復性和穩定性。
2.5實際樣品檢測
對收集的20份樣品進行檢測,其中7份為表現蘿卜黑心病癥狀樣品,13份為健康的蘿卜樣品。以LV19-5菌株的DNA為陽性對照。結果表明,20份樣品中,7份疑似長孢輪枝菌感染的蘿卜樣品DNA擴增后均可產生熒光信號,健康蘿卜未產生熒光信號(圖6)。
3結論與討論
輪枝菌是一類土傳真菌,主要引起植物的維管束病害,可導致嚴重經濟損失。在缺乏寄主情況下,病原菌可通過產生微菌核、休眠菌絲和厚垣孢子等休眠結構在土壤中長期存活,以度過不良環境[25],由于沒有有效的化學藥劑,且缺乏有效的抗病品種,生產中往往難以控制輪枝菌所造成的病害[14,26]。開展嚴格檢疫是防范重要病原菌傳播擴散乃至危害的重要技術手段,而這有賴于準確、特異、靈敏的檢測方法。在對該屬真菌分類學研究尚未查清之前,國內外針對輪枝菌中的重要病原菌如黑白輪枝菌V.albo_atrum[27-29],大麗輪枝菌V.dahliae[29-38],長孢輪枝菌V.longisporum[36]和三體輪枝菌V.tri-corpus[39-40]等已經開展了一些研究,建立了基于PCR、實時熒光PCR等技術的檢測方法。但是,上述檢測方法多建立在輪枝菌分類問題有效解決之前,因此準確性難以得到有效保證。例如黑白輪枝菌,V.albo-atrum sensu lato目前已被劃分為3個不同的物種V.alfalfae、Vnonalfalfae和V.albo-atrum sensu stricton[15,41]。又如,長孢輪枝菌在很長一段時間被認為是大麗輪枝菌的一個變種即大麗輪枝菌長孢變種Verticillium dahliae var.longispo-rum C.Stark,其分生孢子中DNA含量接近大麗輪枝菌的1.75倍[2,42-43],長孢輪枝菌在細胞骨架蛋白(ACT)、翻譯延伸因子(EF)、3-磷酸甘油醛脫氫酶(GPD)、線粒體草酰乙酸轉運蛋白(OX)和色氨酸合酶(TS)等多個基因上具有等位基因,但在核糖體基因內轉錄間隔區(ITS)片段上不具有等位基因[16]。很明顯,在獲得上述科學認知之前,針對輪枝菌不同種類的快速檢測存在很大局限性。
迄今為止,國內外已經開展了一些長孢輪枝菌檢測技術的研究。Yu等[44]采用核糖體小亞基mtSSU rDNA和細胞色素b(cytochrome b)序列分析等方法,將北京地區大白菜黃萎病病原鑒定為長孢輪枝菌,并根據其核糖體ITS序列設計了特異性引物HWl-F/HW1-R,建立了該病菌的快速檢測方法,但特異性研究中未能包括長孢輪枝菌近似種,如V.alfalfae、V.nonal falfae等,因此其特異性難以保證。Banno等[9]根據ITS、mtSSU-rDNA、cyto-chrome b、交配型(mating type)基因序列,結合RAPD研究,將日本群馬縣的甘藍Brassica olera-cea var.capitata黃萎病病原鑒定為長孢輪枝菌。苗增建等[10]采用形態學與ITS序列分析相結合的方式,鑒定出引起青海省蘿卜黑心病的病原為長孢輪枝菌、三體輪枝菌和瓜小織球殼菌Plectos phae-rella cucumerina。呂燕等[45]采用形態學特征觀察結合多基因序列分析,進一步將青海地區蘿卜黑心病病原鑒定為長孢輪枝菌A1/D1株系。此類檢測鑒定方法建立在序列分析基礎之上,耗時較長。In-derbitzin等[46]建立了針對多種輪枝菌的特異性PCR和多重PCR檢測方法,但對于親緣關系較近的種類,如大麗輪枝菌和長孢輪枝菌,無法通過特異性PCR區分,需要采用多重PCR才能加以區分,但該研究未對反應靈敏度進行研究,同時也僅采用分離株提取的DNA進行了驗證,未在實際帶菌樣品中開展檢驗。特異性和靈敏度,是研究快速檢測技術中最重要的考慮因素[47]。本研究在以ITS為靶標設計引物和探針過程中發現,長孢輪枝菌及其近似種ITS片段高度相似,難以設計出合適的引物和探針,因此改用actin片段作為靶標。為了設計出能夠有效區分長孢輪枝菌的引物和探針,借鑒了輪枝菌屬最新分類成果,在引物探針設計階段對長孢輪枝菌及其近似種的多個基因序列進行了比對,最終篩選出變異區段較大且位于共同親本A1的actin片段為靶標設計引物探針,該靶標存在于長孢輪枝菌3種不同株系中,且同源性較高,保證了特異性。同時,為了驗證其特異性,我們在特異性試驗中收集了長孢輪枝菌近似種V.alfae、V.nonalfalfae、V.albo-atrum、V.dahliae和V.tricorpus作為參試菌株,同時也包括了原劃分在輪枝菌屬中的Gibellu-lopsis nigrescens等菌株進行特異性驗證。另外,供試長孢輪枝菌中包括了長孢輪枝菌模式分離物CBS124.64。特異性試驗結果表明,本文所建立的實時熒光PCR方法對不同寄主來源或株系的長孢輪枝菌菌株均可檢出,其他近似種或供試菌均不能檢出,具有較好的種間特異性和種內一致性。
大多數已知的真菌雜交種報道與植物病原體相關,由于全球貿易等人類活動影響,造成以前地理隔離的物種之間相互接觸并雜交,從而產生毒力增強和寄主范圍擴大的新病原[48-49]。長孢輪枝菌起源于3次不同時間的進化。長孢輪枝菌有1個共同的親本A1和3個不同的親本D1、D2和D3,其中A1和D1親本可能來源于未知的輪枝菌種類,而D2和D3親本則可能源自大麗輪枝菌[16]。長孢輪枝菌不同株系間分離物存在致病性差異,如A1/D1和A1/D3株系常見于多種十字花科植物上。A1/D1株系主要報道于油菜上,在油菜上致病力最強[50]。目前分布在法國、德國、瑞典、加拿大、美國和日本等國家,但是在油菜以外的寄主植物上也有相關發生報道[25,45,51-52]。而A1/D2株系則僅見于辣根上[16,53]。本研究所設計的檢測靶標位于長孢輪枝菌A1親本分支actin序列上,由于長孢輪枝菌3種不同株系均含有Al親本序列,因此,本研究所建立方法能夠檢測目前已經報道的長孢輪枝菌全部3個株系。在今后的研究工作中,可進一步針對長孢輪枝菌不同株系特征序列設計檢測方法,以實現針對特定株系的快速檢測。
Taq Man實時熒光PCR是在普通PCR的基礎上,增加1條熒光標記的特異性探針,在完全封閉條件下通過熒光信號的強弱來實時監測PCR擴增產物量的變化,具有特異性強、靈敏度高、操作簡單和不易污染等優點[54-55]。截至目前,國內外已有大量采用實時熒光PCR技術檢測植物病原真菌的相關研究與報道[33-34,36,38,47,55-57],其靈敏度通常在1 pg左右。本研究中檢測靈敏度為10pg,與以往針對其他病菌actin片段為靶標的檢測靈敏度相似[55],可能是由于本檢測靶標位置在A1親本的actin片段上,而該片段在長孢輪枝菌DNA中拷貝數較低故含量較低所致。DNA檢測靶標片段對于靈敏度有較大影響,通常基于ITS片段的引物探針靈敏度更高,例如向日葵黑莖病菌Plenodomus lindquistii靈敏度可達0.1 pg[47],杜鵑花枯萎病菌Ovulinia azaleae可達0.25 pg[56],這可能是ITS片段在上述病菌DNA中拷貝數較多,因此相對含量較高所致。應用此方法,可成功從疑似受長孢輪枝菌侵染的蘿卜樣品中檢測鑒定長孢輪枝菌。本檢測技術也可進一步用于其他疑似受該菌侵染樣品的檢測,如土壤、種子和植株等受侵染樣品。
利用TaqMan-MGB探針,本研究首次建立了長孢輪枝菌實時熒光PCR快速檢測方法,通過優化反應體系,確定了最佳引物終濃度和探針終濃度,均為0.8μmol/L;通過靈敏度試驗,確定了最低檢測限量為10μL反應體系中總DNA含量10 pg。該方法重復性好、穩定性高,檢測過程完全閉管,無PCR后續處理需求,減少了PCR產物的污染,簡化了檢測步驟,節約了時間,具有良好的應用前景。

