淋巴細胞亞群檢測在血液腫瘤中應用的專家共識*
中國醫藥質量管理協會醫學檢驗質量管理專業委員會
血液腫瘤是起源于造血系統的惡性腫瘤,具有高度異質性。2022版《造血與淋巴組織腫瘤WHO分類》根據腫瘤細胞的來源,將血液腫瘤主要分為髓系增殖和腫瘤、髓系/淋系腫瘤和其他譜系未定白血病、組織細胞/樹突狀細胞腫瘤、B淋巴細胞增殖性疾病和腫瘤、T淋巴細胞增殖性疾病和腫瘤、NK細胞腫瘤、淋巴組織間質源性腫瘤、遺傳性腫瘤綜合征8個大類。血液腫瘤的發生、發展和轉歸與其患者機體的免疫功能,尤其是細胞免疫功能密切相關[1-2]。隨著疾病的發生發展,免疫微環境也隨之發生相應變化,進而引起外周血中各種免疫細胞的改變。淋巴細胞是構成人體免疫系統的主要細胞,根據標記物和功能的不同,可以分為許多群體。臨床上常用流式細胞術(FCM)對外周血中的不同群體的淋巴細胞進行鑒別和計數,包括CD3+T淋巴細胞、CD3+CD4+輔助/誘導T淋巴細胞、CD3+CD8+抑制/殺傷T淋巴細胞、CD3-CD19+B淋巴細胞、CD3-(CD16+CD56)+NK淋巴細胞,簡稱為TBNK,以及CD3+CD4+CD25+CD127low/-調節性T細胞(Treg)[3]等。本共識中將TBNK和Treg統稱為淋巴細胞亞群。血液腫瘤作為造血干細胞異常的惡性腫瘤,疾病的多種因素會影響免疫細胞的產生、增殖及分化,使外周血的淋巴細胞數量與功能產生異常[4],導致免疫功能失調[5-6],因此對血液腫瘤患者進行規范的淋巴細胞亞群檢測十分必要。
為了規范淋巴細胞亞群檢測中的實驗方案、技術操作,使更多相關領域的臨床、科研和實驗室技術人員認識到淋巴細胞亞群檢測在血液腫瘤患者診斷、預后評估、治療指導中的作用及注意事項,進一步促進其在血液腫瘤中的應用,中國醫藥質量管理協會醫學檢驗質量管理專委會結合文獻學習和多家醫療機構的臨床工作實踐制定了本專家共識。
1 淋巴細胞亞群檢測在血液腫瘤中的意義
1.1血液腫瘤的發生、進展、預后與免疫功能的關系 正常情況下,免疫系統對腫瘤細胞有監視和清除作用,維持機體內環境的穩定。免疫功能異常可能會導致細胞免疫和體液免疫失調,從而為腫瘤的發生和發展提供條件[7-9];在病原體感染時免疫系統也會受到影響,當免疫功能下降時,腫瘤發生的風險增加[10-11]。文獻報道急性白血病、B細胞淋巴瘤等患者常見外周血T細胞數量及CD4+/CD8+比值下降,并伴免疫功能紊亂[12-13]。Treg的主要功能是抑制自身免疫應答,維持免疫平衡,避免過度的炎癥反應和自身免疫性疾病的發生,在免疫系統中發揮重要的負向調控作用。在血液腫瘤中,Treg一方面可以通過抑制對腫瘤細胞的免疫反應來促進腫瘤生長;另一方面也可通過抑制炎癥和防止可能導致腫瘤發展的自身免疫反應而發揮保護作用。研究發現,多種類型的血液腫瘤患者Treg數量呈現上升趨勢,可能會導致腫瘤免疫逃逸的發生[14-15]。此外,一些淋巴細胞產生的細胞因子,如白細胞介素6、腫瘤壞死因子α等,在血液腫瘤患者中異常表達,進一步說明了機體免疫功能異常和血液腫瘤之間關系密切[16-18]。近年來,一些新型的免疫治療策略也在血液腫瘤的診療中發揮日益重要的作用,例如采用免疫檢查點抑制劑、嵌合抗原受體T細胞(CAR-T)治療、雙重特異性抗體治療等[19-22],這些治療手段主要是通過增強免疫細胞對腫瘤細胞的殺傷作用,來達到治療目的。
1.2淋巴細胞亞群檢測在血液腫瘤中的臨床意義 淋巴細胞亞群檢測在血液腫瘤中的臨床應用主要包括以下方面。(1)部分血液腫瘤的篩查。血液腫瘤包括多種類型,其中一些類型可表現為特定淋巴細胞亞群的增殖和分化異常,通過淋巴細胞亞群檢測可以對這些類型的血液腫瘤進行初篩。如急性淋巴細胞白血病(ALL)、慢性淋巴細胞增殖性疾病(CLPD)等[23]。(2)腫瘤復發、轉移預警及預后評估。Treg在多種血液腫瘤中比例增加,可以通過抑制免疫細胞殺傷作用來幫助腫瘤細胞逃脫免疫監視,并且與惡性程度、轉移傾向、復發率等預后指標密切相關[24-26]。(3)合并感染風險預警。(4)造血干細胞移植治療患者的免疫重建評估與移植物抗宿主病(GVHD)預防。Treg可以作為急性和慢性GVHD的生物標志物[27-29]。(5)CAR-T治療患者的規范化管理和評估。(6)靶向藥物、免疫抑制劑和化療藥物的治療指導,療效監測[30-31]。
2 淋巴細胞亞群檢測的主要方法和結果報告
2.1外周血淋巴細胞亞群檢測的主要方法 淋巴細胞亞群主要通過FCM進行檢測。根據中華人民共和國衛生行業標準(WS/T 360-2011)《流式細胞術檢測外周血淋巴細胞亞群指南》[32],FCM檢測淋巴細胞亞群時,可以采用雙平臺法或單平臺法。首選乙二胺四乙酸二鉀(EDTA-K2)抗凝真空管進行外周靜脈血標本采集,并在24 h內進行檢測。送檢時間超過30 h應該采用肝素鈉或枸櫞酸鈉抗凝,可在室溫下穩定保存至48 h,若用雙平臺法,應采用淋巴細胞亞群檢測同一標本進行白細胞計數和分類,應該選擇 EDTA-K2作為抗凝劑。若送檢時間超過48 h,應該使用流式細胞檢測專用的樣本保存液或樣本保存管,可穩定保存至14 d。TBNK檢測推薦的單抗為CD45、CD3、CD4、CD8、CD19、CD16、CD56,Treg檢測的單抗為CD4、CD25、CD3、CD127。CD3+T細胞標記為CD3+,CD4+T細胞標記為CD3+CD4+,CD8+T細胞標記為 CD3+CD8+,B細胞標記為CD3-CD19+,NK細胞標記為CD3-(CD16+CD56)+,Treg細胞的標記為CD3+CD4+CD25+FoxP3+或CD3+CD4+CD25+CD127low/-。T細胞表面CD127的低表達與T細胞質內FoxP3的高表達具有良好的相關性[33-35],且以CD127為標記的檢測方法明顯優于以細胞質內FoxP3為標記的檢測方法[36-38],因此也可以使用CD127替代FoxP3進行Treg細胞的分析。上機檢測前應采用配套的標準微球對儀器進行全程質控。推薦每管獲取淋巴細胞數應不小于10 000個,得到的檢測數據可通過調整熒光補償、圈門等將各種不同表型的淋巴細胞亞群區分開[39-41],進而得到各群細胞的相對比例及計算絕對數。推薦同時報告淋巴細胞亞群的百分比和絕對計數結果。
2.2外周血淋巴細胞亞群檢測的結果報告 通常應報告以下內容:CD3+T細胞、CD4+T細胞、CD8+T細胞、B細胞和NK細胞的相對計數(百分比)和絕對計數(絕對值)、CD4+/CD8+比值、Treg細胞占CD4+T細胞的百分比。
2.2.1外周血淋巴細胞亞群檢測的參考區間 近年來已有多篇文獻發布了我國不同地區、年齡、民族健康人群的TBNK、Treg細胞參考區間[42-46]。在2023年2月中華醫學會健康管理學分會發表的《TBNK淋巴細胞檢測在健康管理中的應用專家共識》中公布了一項對我國九省(湖北、河南、廣東、吉林、山東、山西、江蘇、浙江、四川)20~60歲健康成人TBNK淋巴細胞參考區間的研究結果[45,47],可供參考,見表1。
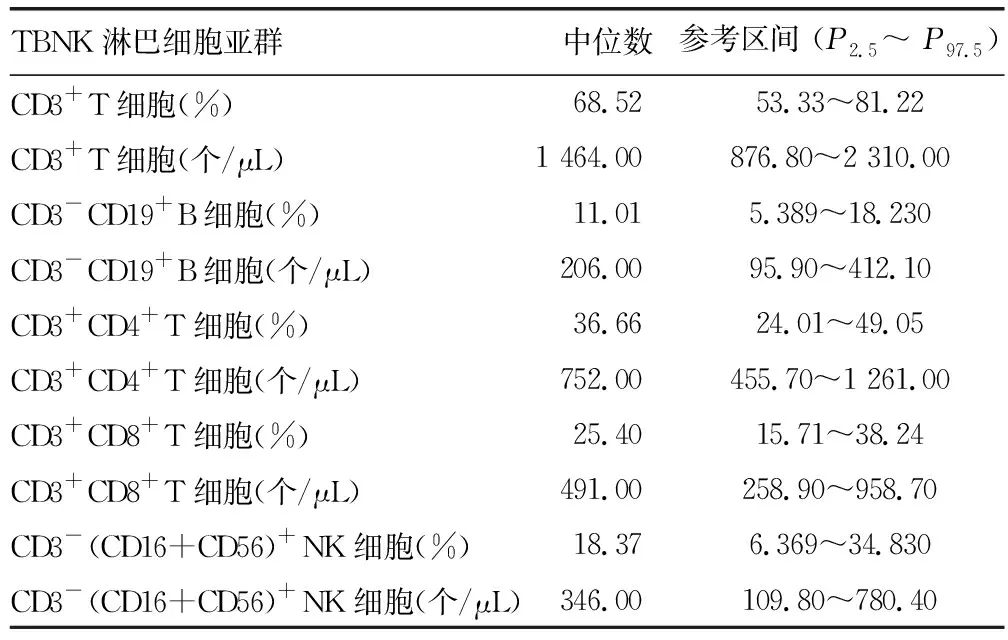
表1 我國九省健康成人TBNK淋巴細胞檢測參考區間
在2017年一項研究中發布了健康成年人外周血Treg細胞參考區間[48],可供參考,見表2。由于Treg在多種疾病的臨床治療與療效觀察方面具有重要探討價值,近年來許多國內實驗室均報告了疾病觀察組與健康對照組中外周血Treg細胞占CD4+T細胞的參考區間,如張寧等[49]報道了健康對照組參考區間為(4.52 ± 0.50)%,陳賽英等[50]報道了健康對照組參考區間為(6.85 ± 1.86)%,XU等[51]報道了健康成人的參考區間為(5.52 ~ 7.70)%,QIU等[52]報道了健康對照組參考區間為(5.70 ± 1.43)%。

表2 健康成年人外周血Treg細胞參考區間(%)
淋巴細胞亞群參考區間的建立受年齡、性別、種族、地域及儀器試劑等眾多因素影響[47],建議有條件的實驗室可以針對本地區、本實驗室檢測體系等建立自己的參考區間及評價體系。調查健康人群淋巴細胞亞群的參考范圍,建立95%置信區間的參考值區間,應滿足每組至少120例健康樣本數量[53]。此外,鑒于人員、儀器、試劑、方法、環境等諸多變化因素,實驗室應對已建立的參考區間定期進行驗證,每次驗證應不少于20例健康樣本,分布在參考區間外的測定值應不超過10%[32,53]。若分布在參考區間外的測定值超過10%,則需要重新驗證或考慮實驗室分析程序、人群差異等其他因素。
2.2.2外周血淋巴細胞亞群檢測報告的審核和發布 進行淋巴細胞亞群檢測的實驗室都應該參加國家衛生健康委員會或省市級臨檢中心組織的室間質評,從而保證本室檢測結果的準確性。在檢測患者樣品前,實驗室人員應確認儀器狀態正常和室內質控在控。在報告結果時,實驗室人員要審核數據采集閾值的設置、抗體的組合方案、與實驗結果相關的所有設門等,以排除樣本異常和實驗操作導致的檢測結果異常。實驗室人員還應根據檢測結果的內部關系初步判斷結果的可靠性。例如,數據應滿足:CD3+%+CD19+%+(CD16+CD56)+% ≈(100±5)%;CD4+%+CD8+% ≈ CD3+% (變化范圍為5%~10%)[32]。若不滿足,則需充分檢查,必要時重復實驗,在排除儀器、樣品、操作等問題后如實報告檢測結果,并需要重點分析該樣本中是否存在異常表型的淋巴細胞,同時用該樣本制作血涂片鏡檢及進一步進行免疫分型對異常細胞進行鑒定,及時與臨床進行溝通。目前,由于國內沒有針對Treg細胞檢測項目的室間質評,因此應進行實驗室間比對。
3 淋巴細胞亞群檢測在血液腫瘤患者中的應用
3.1血液腫瘤的篩查 當出現以下情況:(1)B或NK淋巴細胞顯著增高;(2)CD3+CD4+CD8+T淋巴細胞或CD3+CD4-CD8-T淋巴細胞明顯增高;(3)CD4+/CD8+比值大于10∶1或小于1∶10;(4)CD3+%+CD19+%+(CD16+CD56)+%明顯大于或小于(100±5)%、CD4+%+CD8+%明顯大于或小于CD3+%(變化范圍為5%~10%),在排除標本、儀器、設門、試劑及反應性改變等因素后,需要考慮標本中存在異常淋巴細胞,并結合臨床進行血液腫瘤的篩查。血液腫瘤常見的淋巴細胞亞群改變見圖1,血液腫瘤淋巴細胞亞群篩查與隨訪路徑見圖2。

注:MICM表示形態學、免疫學、細胞遺傳學及分子生物學分型。
3.2血液腫瘤的復發、轉移風險預警及預后評估 當血液腫瘤患者外周血中出現CD4+T和CD8+T細胞減少,CD4+/CD8+比值降低,而Treg細胞明顯增加時,提示腫瘤復發和轉移的風險增加;CD3+T、CD4+T、CD8+T細胞的數量和比例與患者的完全緩解(CR)率、無復發生存期(RFS)和總生存期(OS)呈正相關,而Treg的數量和比例與CR率、RFS和OS呈負相關[54-58]。在急性髓系白血病(AML)患者中,NK細胞數量和比例與CR率、RFS、OS呈正相關[59],NK細胞數量減少的AML和多發性骨髓瘤(MM)可能有更差的預后[60-61]。
3.3血液腫瘤合并感染風險預警 感染是血液腫瘤患者的常見并發癥[62],CD4+T淋巴細胞在免疫防御中發揮關鍵作用。當CD4+T淋巴細胞絕對計數<500個/μL時,血液腫瘤患者機會性感染風險會大幅升高[63]。CD4+T、CD8+T淋巴細胞數量低下的淋巴瘤患者,化療后感染風險明顯升高[64]。初診時Treg細胞比例升高的血液腫瘤患者,其住院期間感染率明顯增加[65]。
3.4造血干細胞移植后免疫重建監測及GVHD預防
3.4.1移植患者免疫重建監測 造血干細胞移植(HSCT)后造血能力持久恢復與免疫系統功能調節密切相關,主要表現為免疫細胞數量的增加和細胞功能狀態的恢復[66-67]。免疫重建受移植物來源、移植物數量與組分、預處理方案、胸腺功能等眾多因素影響,但自體造血干細胞移植和異基因造血干細胞移植(allo-HSCT)患者外周血中TBNK、Treg細胞的重建規律基本相似。NK細胞恢復較快,一般移植后2~3周可恢復。CD3+CD8+T淋巴細胞一般移植后1~3月逐漸恢復,CD3+CD4+T淋巴細胞恢復通常需1年以上。CD3-CD19+B淋巴細胞移植后恢復時間不定,短至3個月,長至1年半以上。Treg細胞在移植早期通常比例非常低,移植晚期逐漸增多。
3.4.2移植患者GVHD預防 GVHD是allo-HSCT患者需要面臨的重要挑戰。發生GVHD的患者,其疾病及移植相關死亡率大幅上升,盡早判斷是否發生排異反應及搶先治療是決定移植成敗的關鍵。高炎癥狀態是GVHD的主要特點[68-69]。具有負調控炎癥反應功能的Treg細胞隨GVHD等級的增加呈下降趨勢,有望成為預測急性GVHD(發生于移植后100 d內)和慢性GVHD(發生于移植100 d后)的特異性指標[70-71]。同時,植移后NK細胞迅速增加會促使炎癥因子的大量分泌,從而促進急性GVHD發生[72-73]。因此allo-HSCT患者在早期植入階段(輸注后2~4周)、移植后早期階段(輸注后1~3月)、移植后晚期階段(輸注后3月以后)都建議行淋巴細胞亞群檢測。
3.5CAR-T治療患者的規范化管理和評估
3.5.1CAR-T細胞增殖監測 CAR-T細胞免疫治療目前已被用于治療復發/難治性的血液腫瘤。定期監測CAR-T治療患者體內的CAR-T細胞水平、腫瘤負荷、免疫功能(主要包括淋巴細胞亞群的比例和數量)和相關不良反應(細胞因子釋放綜合征、神經毒性等),是治療后病情評估的重要手段[74-75]。患者回輸CAR-T細胞后,可通過FCM監測外周血中CAR-T細胞的比例和數量,結果報告中一般包括總CAR-T細胞(占淋巴細胞)、CD4+CAR-T細胞(占T淋巴細胞)和CD8+CAR-T細胞(占T淋巴細胞)的比例和數量。有條件的實驗室還可開展熒光定量聚合酶鏈反應法(qRT-PCR)監測CAR-T細胞增殖水平。多項臨床試驗數據顯示,體內CAR-T細胞增殖水平與療效顯著正相關[76-78]。
3.5.2淋巴細胞亞群監測 淋巴亞群檢測也被推薦與CAR-T細胞監測同時進行[75]。有研究通過檢測患者CAR-T細胞回輸后第15天的外周血淋巴細胞水平,發現低水平的淋巴細胞數(<0.67×109/L)是患者的不良預后因素,顯著影響病情緩解[79]。也有研究發現緩解患者CAR-T細胞回輸2年后的CD4+T淋巴細胞數仍低于0.20×109/L[80]。有研究者提出,具有中央記憶T細胞和干細胞樣記憶T細胞表型的CAR-T細胞,在體內有更強的增殖能力及更持久的抗腫瘤效應[80-81]。對于CAR-T細胞治療的患者,有條件的情況下,可以進行CAR-T細胞的精細亞群分析和長期隨訪。
3.6血液腫瘤患者藥物治療指導
3.6.1CD20單抗 CD20單抗可靶向治療B淋巴細胞型非霍奇金淋巴瘤,單次輸注CD20單抗后3 d內,患者外周血B淋巴細胞可減少90%[82],多數患者這種劑量依賴性B細胞減少狀態將持續2~3個月,一般6個月后患者外周血B淋巴細胞恢復[83-85]。B細胞是否完全清除可用于評估CD20單抗的治療反應和療效[86-88]。若患者在使用CD20單抗治療后,外周血B細胞計數未出現明顯減少或無劑量依賴,提示患者對CD20單抗治療低反應,則可考慮更換治療方案[89]。
3.6.2免疫調節藥物 (1)對于免疫功能嚴重受損的患者(經過放化療治療或合并HIV感染等)[90-91],患者在治療過程中發生嚴重感染的頻率顯著增加。當患者CD4+T細胞絕對計數小于100個/μL時,建議停用免疫抑制藥,使用胸腺五肽[92]等免疫增強劑,待患者免疫功能恢復后在進一步治療。當小于200個/μL時,需注意免疫抑制藥劑量。(2)對于移植及個體化免疫治療患者,當CD4+/CD8+細胞比值出現小于0.2時,建議停用免疫抑制藥,而CD4+/CD8+細胞比值小于0.5時,需謹慎用藥,并密切關注患者免疫功能狀態及感染情況。(3)對于治療期間合并感染的患者,NK細胞或CD8+T細胞絕對值及比例較治療前明顯升高[93],提示可能伴有病毒感染,可為抗病毒藥使用提供參考。
3.7動態監測與隨訪時機的選擇
3.7.1建立基線,動態監測 淋巴細胞亞群檢測結果受疾病狀態、藥物等因素影響,采用健康人群參考區間可能不能有效評估血液腫瘤患者免疫功能,建議建立患者個體化的淋巴細胞亞群檢測結果的基線,并規律、動態的監測其變化趨勢。有條件的單位,可在報告中呈現結果動態變化的趨勢圖。
3.7.2初診時患者的淋巴細胞亞群檢測 血液腫瘤患者常伴有免疫功能失衡,細胞免疫功能往往處于免疫抑制狀態,對腫瘤細胞的識別和殺傷能力下降[94-95]。檢測初診時患者的淋巴細胞亞群,能有效判斷患者免疫功能的初始狀態。
3.7.3放化療、免疫治療及靶向治療患者的淋巴細胞亞群監測與隨訪 放化療、免疫治療及靶向治療期間患者淋巴細胞亞群可呈周期性改變[96],可通過檢測患者每個周期治療前后的淋巴細胞亞群變化,來評估患者治療期間免疫功能恢復情況及腫瘤復發和轉移的風險。建議有條件的情況下,在治療結束后半年內每3個月跟蹤檢測,半年后每6個月進行隨訪。
3.7.4造血干細胞移植患者的淋巴細胞亞群監測與隨訪 建議造血干細胞移植后患者的淋巴細胞亞群檢測時間可在移植后第14天、第21天、1個月、2個月、3個月、6個月、1年、2年隨訪[97-101]。
3.7.5CAR-T治療患者的淋巴細胞亞群監測與隨訪 建議連續監測患者CAR-T細胞回輸前1天、回輸后第4天、第7天、第14天、第28天外周血淋巴細胞亞群變化情況,及治療后2個月、3個月、6個月隨訪。見圖3。

圖3 血液腫瘤淋巴細胞亞群檢測與隨訪路徑圖
4 結 語
隨著流式細胞術的廣泛應用,用于免疫功能評價的淋巴細胞亞群檢測在臨床已廣泛開展,通過TBNK、Treg這些指標,可以評估血液腫瘤患者免疫狀況,為疾病診斷、分型,治療方案的選擇、化療后感染預防,疾病轉歸預測等提供實驗室依據,以及為血液腫瘤患者的個性化治療提供參考。
機體免疫功能受年齡、藥物、感染、營養、生理等眾多因素的影響,存在較大的個體差異。機體免疫功能是動態變化的,同一患者的不同疾病狀態下淋巴細胞亞群檢測結果也可能出現較大的波動。因此,淋巴細胞亞群檢測在參考范圍的建立、報告結果解讀等方面依然存在挑戰。
針對血液腫瘤患者,臨床工作中需要建立患者個體化的淋巴細胞亞群基線水平,動態監測淋巴細胞亞群結果的變化趨勢,并結合多種免疫功能檢測指標,綜合分析患者的免疫狀態,為臨床決策提供更加全面的參考。
淋巴細胞亞群檢測在血液腫瘤中具有重要的臨床意義和廣泛的應用前景,本共識的發布將有助于推動淋巴細胞亞群檢測臨床實踐中的應用,促進血液腫瘤的診斷、治療和預后評估水平的提高,期望能夠為我國血液腫瘤的精準診療做出貢獻。
專家組組長:楊再林(重慶大學附屬腫瘤醫院)、武坤(昆明醫科大學第一附屬醫院)、劉耀(重慶大學附屬腫瘤醫院)
執筆人(按姓氏漢語拼音排列):陳雙(重慶大學附屬腫瘤醫院)、程沈菊(昆明醫科大學第一附屬醫院)、蔣亭亭(重慶大學附屬腫瘤醫院)、李軼勛(昆明醫科大學第一附屬醫院)、劉耀(重慶大學附屬腫瘤醫院)、彭余(重慶大學附屬腫瘤醫院)、武坤(昆明醫科大學第一附屬醫院)、楊再林(重慶大學附屬腫瘤醫院)
專家組成員(按姓氏漢語拼音排列):陳曼(北京陸道培醫院)、陳樸(復旦大學附屬中山醫院)、池沛冬(中山大學腫瘤防治中心)、蔣能剛(四川大學華西醫院)、李力(南部戰區總醫院)、李珍(南方醫科大學南方醫院)、李國盛(山東大學齊魯醫院)、李智偉(新疆維吾爾自治區人民醫院)、劉耀(重慶大學附屬腫瘤醫院)、劉艷榮(北京大學人民醫院)、馬驍(蘇州大學附屬第一醫院)、毛霞(華中科技大學同濟醫學院附屬同濟醫院)、倪萬茂(浙江省人民醫院)、冉隆榮(重慶大學附屬腫瘤醫院)、任方剛(山西醫科大學第二醫院)、王卉(河北燕達陸道培醫院)、王慧君(中國醫學科學院血液病醫院)、王劍飚(上海交通大學附屬瑞金醫院)、翁香琴(上海交通大學附屬瑞金醫院)、吳麗娟(西部戰區總醫院)、吳雨潔(江蘇省人民醫院)、武坤(昆明醫科大學第一附屬醫院)、徐翀(上海市臨床檢驗中心)、楊軍軍(溫州醫科大學檢驗醫學院)、楊順娥(新疆醫科大學附屬腫瘤醫院)、楊再林(重慶大學附屬腫瘤醫院)、岳保紅(鄭州大學第一附屬醫院)、張愛梅(中國科學技術大學附屬第一醫院/安徽省立醫院)、張會來(天津醫科大學腫瘤醫院)、趙明宇(重慶大學附屬腫瘤醫院)、朱杰(大連醫科大學附屬第二醫院)、朱莉(華中科技大學同濟醫學院附屬同濟醫院)、朱明清(蘇州大學附屬第一醫院)、朱明霞(北京大學第三醫院)、鄭金娥(華中科技大學同濟醫學院附屬協和醫院)、周輝(湖南省腫瘤醫院)
利益沖突:所有作者聲明無利益沖突。

