利用氧化還原電勢傳感器測定加碘食鹽中的碘含量
劉雯 丁偉

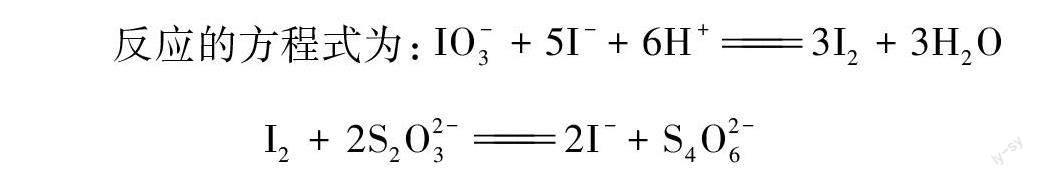
摘要: 基于碘量法原理,采用硫代硫酸鈉標準溶液測定被測物中碘元素的含量。借助氧化還原電勢傳感器和液滴數傳感器獲得滴定曲線圖并確定滴定終點,從而測得加碘食鹽中碘元素的含量。與傳統實驗相比,運用數字化實驗數據進行表征使氧化還原滴定過程可視化,幫助學生深入理解氧化還原滴定的原理,提升學生的化學思維品質。
關鍵詞: ORP傳感器; 氧化還原滴定; 碘鹽; 碘含量測定; 實驗探究
文章編號: 10056629(2023)07006904
中圖分類號: G633.8
文獻標識碼: B
1 問題提出
碘是人體必需的微量元素之一,它是人體合成甲狀腺素的主要原料,對維持人體新陳代謝起著極為重要的作用。人體自身不能合成碘,需要從外界攝入,最常見的方法就是合理攝入加碘食鹽。蘇教版高中化學必修一教材將加碘食鹽中碘元素的定性檢驗安排為課后興趣實驗。其原理是碘在加碘鹽中以IO-3形式存在,在酸性條件下IO-3和I-發生反應,生成碘單質,利用淀粉溶液變藍色將碘元素定性檢驗出來。
碘元素的定量測定有很重要的應用價值。食用鹽中加入一定量的碘酸鉀,是為了滿足人體對碘的需要。但值得注意的是,人體攝入過多的碘也是有害的。《食品安全國家標準食用鹽碘含量》(GB 26878—2011)[1]中規定了加碘食鹽中碘含量的平均水平(以碘元素計)為20~30mg/kg。
數字化實驗是信息技術發展和科學教育研究相結合的產物。與傳統實驗相比,數字化實驗最大的特色就是借助傳感器和信息處理終端進行實驗數據的實時采集與分析,實現了人類感官的延伸[2]。本文運用氧化還原電勢傳感器手持技術展開加碘鹽中碘元素含量測定的研究,作為對教材實驗的擴展和補充。
2 實驗設計
2.1 碘量法
碘量法[3]是以I2的氧化性和I-的還原性為基礎的一種氧化還原方法,可分為直接碘量法和間接碘量法。
2.1.1 直接碘量法(碘滴定法)
當E<E(I2/I-),用I2標準溶液直接滴定還原劑(如Sn2+、 As2O3、 S2-、 SO2-3)的滴定方法稱為直接碘量法,又稱為碘滴定法。該反應原理為:
I2+Red2I-+Ox
該種方法滴定應在酸性或中性介質中進行,因為在堿性條件下I2易發生歧化反應:3I2+6OH-IO-3+5I-+3H2O。但是如果溶液的酸度過高,處于強酸性介質中,I-會發生氧化導致終點拖后。由于I2的氧化性不強,能被其氧化的物質不多,所以直接碘量法應用有限。
2.1.2 間接碘量法(滴定碘法)
直接碘量法只能夠測定還原性的物質,而間接碘量法是利用I-的還原性間接測定氧化性物質(如MnO-4、 Cr2O2-7、 H2O2、 Cu2+等含量)的方法。該法是用Na2S2O3標準溶液滴定析出的I2,所以又稱滴定碘法。該反應原理為:
2I-+OxI2+Red(析碘反應)
I2+2S2O2-32I-+S4O2-6(滴碘反應)
與直接碘量法類似,反應的酸度也需嚴格控制,必須在中性或弱酸性條件下進行。
2.2 實驗原理
2.2.1 氧化還原電勢(ORP)傳感器工作原理
氧化還原電勢(ORP)傳感器能夠測量溶液中氧化劑的氧化能力或還原劑的還原能力。ORP傳感器有兩個組件,其一是鉑金屬,浸在所測溶液中,另一組件為密封的銀/氯化銀凝膠(用作鉑半電池的標準),測量時通過電壓放大器呈現出電勢差,從而確定該溶液氧化性或還原性的強弱[4]。
2.2.2 實驗滴定原理
先在一定量食鹽樣品中加入過量醋酸酸化的碘化鉀溶液,把碘酸鉀中的碘元素還原為碘分子,再用硫代硫酸鈉標準溶液滴定生成的碘分子即可。碘化鉀可以防止碘的揮發,增大碘在水中的溶解度;稀醋酸則為硫代硫酸鈉和碘反應提供弱酸性環境;最后用硫代硫酸鈉標準溶液滴定處理好的樣品溶液。
用硫代硫酸鈉標準溶液滴定加碘鹽樣品溶液時,ORP電極測量的電勢將迅速下降,形成“突躍”。通過滴數傳感器可以得到反應終點時消耗的硫代硫酸鈉標準溶液的體積,根據硫代硫酸鈉標準溶液的濃度和體積,測得加碘鹽中碘元素的含量。
反應的方程式為:IO-3+5I-+6H+3I2+3H2O
I2+2S2O2-32I-+S4O2-6
2.2.3 傳統滴定方法
傳統的滴定方法是用標準液硫代硫酸鈉溶液滴定待測液中的碘單質,選擇淀粉溶液為指示劑,當待測液恰好由藍色變為無色,且充分振蕩溶液不變色時即到達滴定終點,此時準確記錄消耗的標準液體積。滴定實驗的關鍵,一是正確判斷滴定的終點;二是準確測定液體的體積。傳統方法存在如下問題:(1)用肉眼判斷滴定終點和讀取液體的體積均存在一定誤差;(2)應在臨近終點時加入淀粉指示劑,滴定至溶液藍色消失為終點[5]。如果淀粉指示劑加入過早,溶液中大量的碘分子被淀粉表面牢固地吸附著,會出現終點遲鈍現象而產生滴定誤差。
2.2.4 氧化還原電位滴定
本實驗用氧化還原電勢(ORP)傳感器,在氧化還原電位滴定中,隨著氧化劑的加入,物質氧化態和還原態的濃度逐漸改變,有關電對的電位也隨著不斷改變,其變化情況可以用滴定曲線表示[6]。當硫代硫酸鈉溶液滴定生成的碘分子時,當兩者恰好完全反應時,ORP傳感器測得的電勢將迅速增加,此時電勢的變化最大。我們可以根據氧化還原滴定曲線,通過數據處理,計算碘分子的物質的量,進而計算樣品中碘元素的質量分數。
3 實驗過程
3.1 實驗儀器及藥品
儀器:電子天平、25.00mL滴管、燒杯、ORP傳感器、滴數傳感器、磁力攪拌器、數據采集器(VENIER LabPro)、計算機及其相配套軟件LoggerPro3
藥品:加碘鹽樣品、0.0100mol/L硫代硫酸鈉標準溶液、除氧蒸餾水
3.2 實驗步驟及數據處理
3.2.1 待測樣品處理
(1)電子天平稱取10.00g加碘食鹽樣品,用除氧蒸餾水50mL溶解。
(2)再加10%稀醋酸10mL酸化,最后加碘化鉀0.5g,攪拌使其充分反應,待測。
3.2.2 氧化還原電勢傳感器滴定
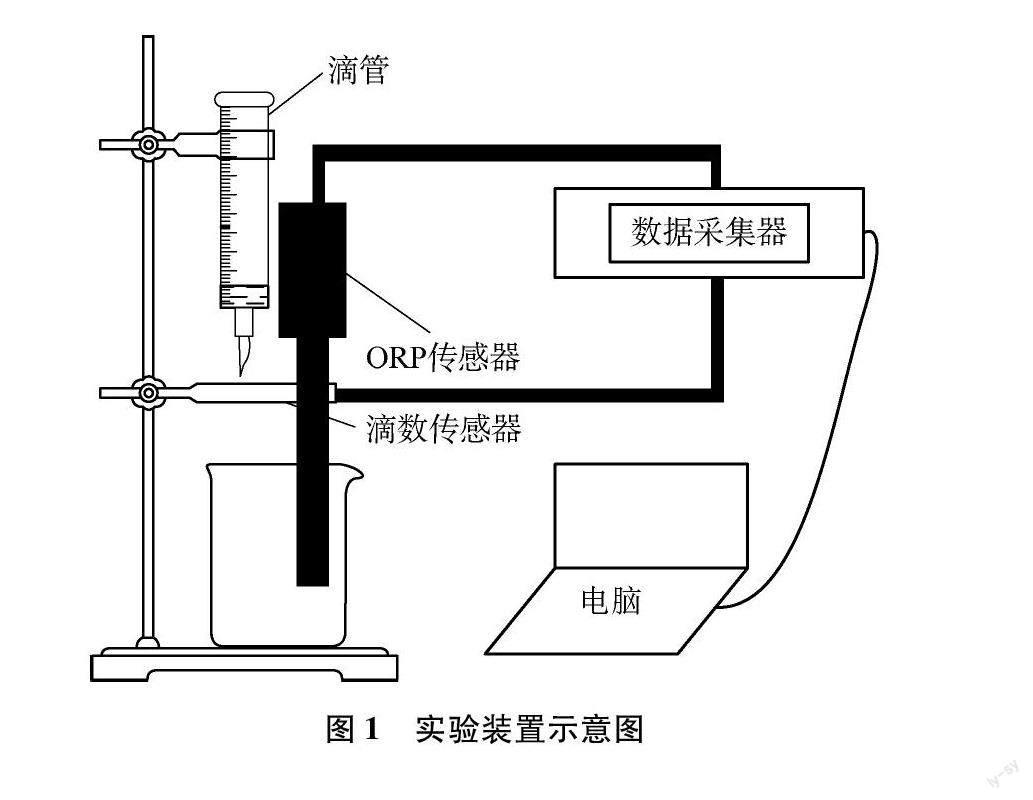
(1) 實驗裝置如圖1所示,將ORP傳感器、滴數傳感器分別與數據采集器相連,數據采集器再與計算機相連,之后將磁力攪拌器、小燒杯、ORP傳感器、滴管依次放好,打開LoggerPro3(軟件)。
(2) 先用硫代硫酸鈉標準溶液潤洗滴管,裝液25.00mL,排氣泡。再將上述酸化的待測樣品溶液置于小燒杯中,準備滴定。
(3) 打開軟件中數據采集功能,為使反應物混合均勻,采用磁力攪拌器攪拌溶液。
(4) 打開滴液器開關,緩慢打開滴管活塞,讓硫代硫酸鈉標準溶液逐滴滴入燒杯中,數據采集器自動記錄數據,并自動繪制滴定曲線。
(5) 重復三次實驗,完成實驗數據記錄(如表1所示)。
4 實驗結果與討論
4.1 實驗結果
硫代硫酸鈉溶液滴定生成的碘單質溶液過程中ORP傳感器測量溶液的電勢隨硫代硫酸鈉溶液體積增加的曲線圖如圖2(a)所示,利用軟件所帶的程序對圖2(a)中的曲線進行求導,得到一次導數曲線如圖2(b)所示。
因此,由計算得知10.00g樣品中碘元素的含量為0.243mg/kg,與食鹽包裝袋所示含量(18~33mg/kg)相符合。
4.2 實驗創新點
(1) 滴定分析中的定量計算是高中化學教學的重難點之一。中學化學教材所涉及的滴定實驗僅限于酸堿中和滴定,而氧化還原滴定也是一種重要的滴定方法,可以作為對酸堿中和滴定的深化和拓展。此外,中學化學教材中只有對加碘食鹽中碘元素的定性檢驗而缺少定量測定。筆者基于此內容設計了該實驗,幫助學生學習氧化還原滴定的原理和方法,以彌補教材實驗內容的不足。
(2) 在氧化還原滴定的定量測定中,利用ORP傳感器測量電勢變化,可以不需要指示劑就能精確測量出氧化還原反應恰好進行完全的等量點,消除指示劑顏色變化帶來的誤差,使氧化還原滴定的實驗結果更準確[7](見表2)。與滴數傳感器結合使用,精準記錄滴加標準溶液的體積,同時利用自帶軟件生成圖像并處理數據,更準確地得到所消耗標準溶液的體積。
(3) 在教學過程中,可以用四重表征(宏觀表征、微觀表征、符號表征、曲線表征)來加深對氧化還原滴定的理解(見表3)。滴定過程中溶液由藍色變為無色這一宏觀表征與曲線中的“突躍”這一現象的完美結合,既有效消除了由淀粉溶液作指示劑帶來的誤差問題,同時也使氧化還原滴定可視化,加深學生對“突躍”的理解[8]。數字化實驗能夠極大地激發學生求知的欲望,進一步培養學生的思維能力,培養學生的實驗創新能力,使其更深入地思考和分析物質的定性檢驗與定量測定,對學科知識的理解得到升華。
4.3 誤差分析
4.3.1 介質的選擇
間接碘量法的滴定應在中性或弱酸性溶液中進行。因為在堿性溶液中會發生如下副反應:
S2O2-3+4I2+10OH-2SO2-4+8I-+5H2O
3I2+6OH-IO-3+5I-+3H2O
在強酸性溶液中,S2O2-3容易分解,I-也容易被空氣中的O2緩慢氧化,發生的反應如下:
S2O2-3+2H+S↓+SO2↑+H2O
4I-+O2+4H+2I2+2H2O
4.3.2 I2易揮發
I2易揮發,可能是造成誤差的原因。因此為了防止碘揮發,可采取如下措施:①過量加入KI溶液助溶,防止揮發,提高速率;②溶液溫度不宜高;③在碘量瓶中進行反應,快滴慢搖。
4.3.3 I-具有強還原性
I-具有強還原性,可能是造成誤差的原因。在酸性條件下易被空氣中的O2氧化,為此可采取下列措施:①暗處放置避免強光;②除去催化性雜質(NO、 NO2、 Cu2+);③控制溶液酸度;④密塞放置;⑤I2完全析出后立即滴定。
5 結語
和傳統實驗相比,運用手持技術數字化實驗進行表征使氧化還原滴定過程可視化,使定量實驗設計便捷、測定結果更準確,提升學生的實驗創新能力。在實際教學中,氧化還原電勢傳感器不僅可以測定加碘鹽中碘元素的含量,還可應用于其他氧化還原滴定教學中。
參考文獻:
[1]中華人民共和國衛生部制定. 食品安全國家標準. 食用鹽碘含量: GB 26878—2011[S]. 北京: 中國標準出版社, 2011.
[2]項佳敏, 錢華, 馬宏佳等. 信息技術與化學學科教學深度融合的案例研究——以數字化實驗為例[J]. 化學教學, 2020, (9): 21~27.
[3]周公度主編. 化學辭典[M]. 北京: 化學工業出版社, 2004: 108~109.
[4]朱成東, 戈益超. 利用氧化還原電勢(ORP)傳感器定量測定亞硫酸鈉含量創新實驗[J]. 安徽教育科研, 2021, (12): 98~99.
[5]孟靜. “食鹽中碘元素含量測定的實驗探究”的教學設計與反思[J]. 上海課程教學研究, 2017, (2): 50~52, 65.
[6]倪霞. 運用手持技術測定果蔬中維生素C含量的研究性學習[J]. 教育與裝備研究, 2019, 35(7): 77~79.
[7]喬金鎖, 劉延華, 白燕燕. 碘鹽在模擬烹調過程中碘損失的實驗探究[J]. 化學教學, 2016, (9): 54~56.
[8]刁卓, 錢揚義, 王立新, 唐文秀. 發展學生“宏觀辨識與微觀探析”素養的數字化實驗設計[J]. 化學教學, 2022, (5): 62~64.

