重癥吉蘭-巴雷綜合征電生理特征以及預后不良相關因素分析
朱婷鴿, 陳芬英, 孫世輝, 孫 超, 薛文娟, 宿長軍
吉蘭-巴雷綜合征(Guillain-Barré syndrome,GBS)是一種免疫介導的多根神經病變,由脊神經根和周圍神經的急性脫髓鞘或軸索損傷引起。它的常見特征是感覺、運動和自主癥狀,通常伴有進行性延髓麻痹和深部肌腱反射減弱[1]。估計每年在全世界有10萬例新病例,是小兒麻痹癥時代之后導致四肢急性弛緩對稱無力和反射性無力的最常見原因[2]。
近年來,根據臨床和電生理特性對GBS進行了重新分類,病變范圍從典型的急性炎性脫髓鞘多神經病變和軸索型不等;包括幾種非典型臨床類型的急性運動和感覺軸突神經病和急性運動軸突神經病[3]。GBS被認為是一種自身免疫性疾病,導致周圍神經的抗原蛋白產生抗體,進而導致T細胞激活。巨細胞病毒、肺炎支原體和空腸彎曲桿菌等傳染性病原體可刺激抗體的產生[4]。迄今為止,靜脈免疫球蛋白和血漿交換是唯一公認的免疫治療藥物,可以加速GBS的恢復。然而,該綜合征仍然是一種嚴重的疾病,即使采用標準免疫療法治療,約5%的人死亡,在發病1年后,高達20%的人不能獨立行走[5]。基于此,本文主要分析重癥GBS電生理特征以及影響預后不良相關因素,為重癥患者的臨床治療和預后提供理論依據。
1 資料與方法
1.1 一般資料 選取2020年3月-2022年5月收治于我院的78例GBS患者的臨床資料,根據病情嚴重程度分為輕癥組和重癥組,輕癥組患者52例(男30例,女22例),年齡11~68歲,平均年齡(37.15±4.15)歲;重癥組患者26例(男16例,女10例),年齡10~68歲,平均年齡(36.69±4.78)歲。另根據預后情況分為良好組和不良組,良好組患者45例(男27例,女18例),年齡10~66歲,平均年齡(36.79±3.79)歲;不良組患者33例(男19例,女14例),年齡12~68歲,平均年齡(37.36±4.96)歲。
1.2 納入標準與排除標準 納入標準:(1)涉及下肢和(或)上肢的急性或亞急性弛緩性無力;(2)肢體反射減退或反射消失;(3)以急性起病、快速進展、主要進行性四肢麻痹伴或不伴球麻痹;(4)被診斷為急性眼肌麻痹、腱反射減弱或消失和共濟失調的三聯征。排除標準:(1)急性神經病變導致慢性炎癥性脫髓鞘多神經病變的患者;(2)有共病和基礎疾病的患者,如自身免疫疾病、神經功能缺損或既往進行性疾病;(3)病程進行性進展> 8周,減肥手術后出現的癥狀。
1.3 治療方法 根據適應證和給藥可行性,給予靜脈注射免疫球蛋白0.4 g/(kg·d),連續5 d。所有患者均得到適當的神經康復護理,并監測并發癥的發展和病情的進展。對符合標準的患者給予呼吸機輔助呼吸,并進行適當的危重監護管理。
1.4 檢測方法和診斷標準 所有患者入院時均采用丹麥公司生產的Keypoint多功能肌電圖電位誘發電位儀進行相關電生理檢查,通過刺激腓總神經、脛神經、正中神經和尺神經進行運動傳導檢測,檢測指標包括潛伏時、波幅和傳導速度。
GBS患者肌力的評定:采取英國醫學研究會(Medical Research Council,MRC)制定的0~5級(分別對應0~5分)肌力測定法評價患者病情高峰期時肌力損傷情況:0級,肌肉完全麻痹,觸診肌肉完全無收縮力;1級,肌肉有主動收縮力,但不能帶動關節活動;2級,可以帶動關節水平活動,但不能對抗地心引力;3級,能對抗地心引力做主動關節活動,但不能對抗阻力;4級,能對抗較大的阻力,但比正常者弱;5級,正常肌力。MRC總分指雙側上、下肢6組肌群包括肩外展、肘屈、腕伸、髖屈、膝伸及足背屈肌力的總和,共0分(四肢完全性癱瘓)~60分(正常)。GBS患者病情等級的評定:以病情高峰期MRC總分作為GBS患者病情等級評估的標準。將GBS患者劃分為3個等級:輕度型(40~60分);中度型(30~40分);重度型(≤30分)[6]。
Hughes評分標準[7]:0~6分依次為正常、癥狀較輕、無需幫助可步、需幫助可步行、臥床、需呼吸機輔助呼吸、死亡。根據發病高峰期的Hughes評分判定患者病情的嚴重程度,Hughes評分≤3分為輕癥,>3分為重癥;根據治療前后(6個月后)的Hughes評分差值評定預后分組,治療后與治療前差值≤0,且Hughes評分<3分則為預后良好,反之記為預后不良。自主功能障礙:出現心律失常、心率和血壓波動(包括體位性血壓下降)、出汗異常、瞳孔異常、胃腸功能障礙和尿潴留的患者被認為有自主功能障礙。機械通氣:使用呼吸機輔助呼吸的患者,臨床表現為缺氧,動脈血氣分析異常(PaO2<70 mmHg;PaCO2>45 mmHg)。
1.5 觀察指標 收集患者入院時的臨床數據,包括年齡、性別、發病年齡、發病季節、入院前病程、入院時MRC評分;不良癥狀發生率包括上呼吸道感染、面癱、胸悶、腹瀉、是否進行機械通氣、自主神經功能障礙、胃腸道感染、肺部感染;合并疾病包括合并高血壓病、合并2型糖尿病、合并慢性乙型肝炎以及合并其他自身免疫性疾病;詳細的運動系統評估包括顱神經檢查、動力和反射,如肌肉萎縮、顱神經受累等;電生理檢測包括腓總神經傳導速率、脛神經運動傳導速率、F波異常率和遠端復合肌肉動作電位波幅(Diaphragmatic Compound Muscle Action Potential,dCMAP)異常率;血IgG、腦脊液蛋白、腦脊液白蛋白、腦脊液IgG以及肌電圖損傷類型。
1.6 隨訪 通過電話等線上聯系方式或門診復診等方式對患者進行6個月的按月隨訪,以6個月后的MRC總和評分和Hughes評分評價臨床改善情況。
2 結 果
2.1 兩組病情嚴重程度不同患者臨床資料的比較 比較病情嚴重程度不同的兩組患者的臨床資料發現,兩組患者在年齡、性別、發病年齡、發病季節、胃腸道感染、肌肉萎縮、肺部感染、顱神經受累、合并高血壓病、合并2型糖尿病、合并慢性乙型肝炎方面無顯著性差異(P>0.05);而重癥組患者面癱、胸悶、腹瀉、機械通氣、自主神經功能障礙、合并其他自身免疫性疾病的發生率顯著高于輕癥組患者(P<0.05)(見表1)。

表1 病情嚴重程度不同患者臨床資料的比較
2.2 病情嚴重程度不同患者電生理特征的比較 通過比較兩組患者電生理特征發現,重癥組的腓總神經傳導速率和脛神經運動傳導速率顯著低于輕癥組,而F波異常率和dCMAP波幅異常率則顯著高于輕癥組(P<0.05)(見表2)。

表2 病情嚴重程度不同患者電生理特征的比較
2.3 影響預后不良的相關因素分析 通過分析預后不同的兩組患者各項指標發現,預后不良組患者入院前病程>2周、腦脊液蛋白升高、入院時MRC評分≤30、機械通氣、合并其他自身免疫性疾病、腓總神經傳導速率減慢、脛神經運動傳導速率減慢、F波異常率、dCMAP 波幅異常率以及軸索型損傷的比例均顯著高于預后良好組(P<0.05);而在血IgG升高、腦脊液白蛋白升高、腦脊液IgG升高、前驅癥狀發生率、合并高血壓病、合并2型糖尿病、合并慢性乙型肝炎、脫髓鞘型方面則無明顯差異(P>0.05)(見表3)。
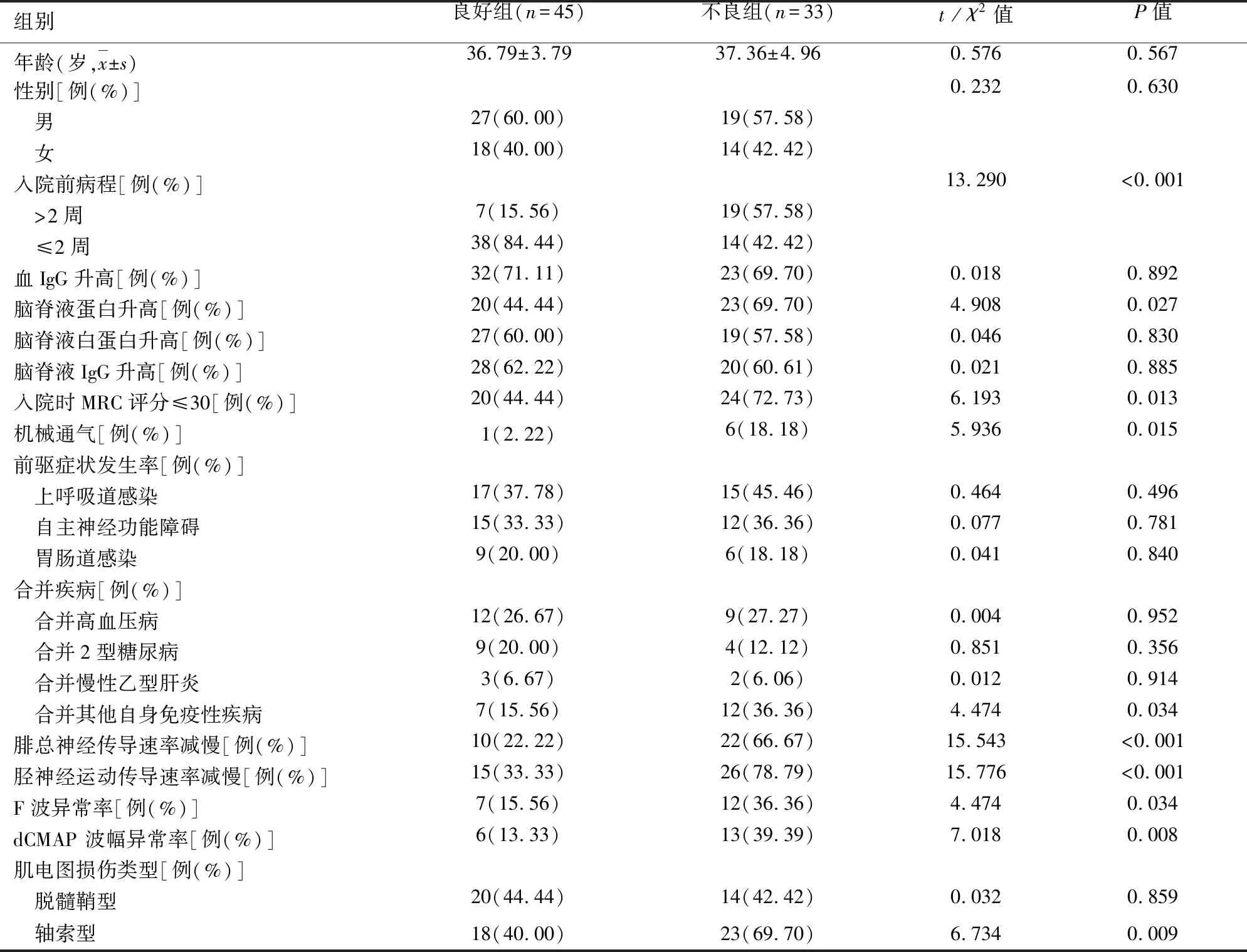
表3 影響預后不良的相關因素分析
2.4 影響預后不良的多因素分析 將表3中差異顯著的指標進行多因素Logistic回歸分析,結果如圖1所示。
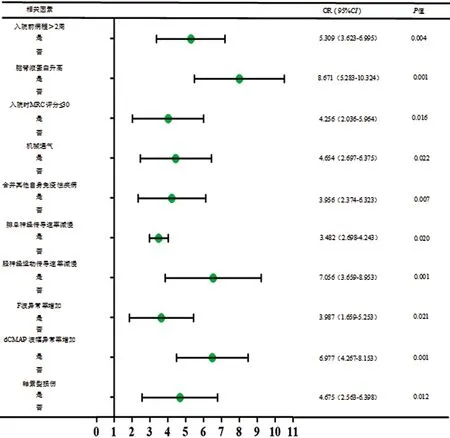
圖1 影響預后不良的危險因素森林圖
入院前病程>2周、腦脊液蛋白升高、入院時MRC評分≤30、機械通氣、合并其他自身免疫性疾病、腓總神經傳導速率減慢、脛神經運動傳導速率減慢、F波異常率增加、dCMAP 波幅異常率增加以及軸索型損傷均為影響預后不良的危險因素(OR值均大于1,P<0.05)。
2.5 ROC曲線分析神經電生理特征對GBS患者預后的預測價值 采用ROC曲線獲得腓總神經傳導速率、脛神經運動傳導速率、F波異常率、dCMAP波幅異常率及四者聯合預測GBS患者預后不良的效能,結果如表4所示,腓總神經傳導速率、脛神經運動傳導速率、F波異常率、dCMAP波幅異常率及四者聯合后預測ROC曲線下面積,分別為0.816(95%CI0.720~0.899,P<0.001)、0.735(95%CI0.699~0.832,P<0.001)、0.724(95%CI0.687~0.803,P<0.001)、0.834(95%CI0.719~0.867,P<0.001)和0.859(95%CI0.787~0.913,P<0.001)(見圖2),四者聯合預測的ROC曲線下面積、陽/陰性預測值、靈敏度、特異度均明顯高于單獨預測,具有更優的預測效能。

圖2 ROC曲線分析神經電生理特征對GBS患者預后的預測價值

表4 支原體抗體滴度、IFN-γ/IL-5及二者聯合對MP肺炎患者的預測價值
2.6 列線圖模型的構建 基于多因素分析結果構建列線圖預測模型,結果如圖3所示,入院前病程>2周為31分、腦脊液蛋白升高為75分、入院時MRC評分≤30為55分、機械通氣為44分、合并其他自身免疫性疾病為72分、腓總神經傳導速率減慢為20分、脛神經運動傳導速率減慢為58分、F波異常率增加為83分、dCMAP 波幅異常率增加為98分以及軸索型損傷為95分,總分613分,對應預后不良概率為74.56%。

圖3 列線圖模型
2.7 模型驗證
2.7.1 模型區分度評價 模型區分度的評價是通過ROC曲線進行的,結果如圖4所示。訓練集AUC為0.862(95%CI0.688~0.903,P<0.001);C-index為0.861。驗證集AUC為0.871(95%CI0.655~0.893,P<0.001);C-index為0.825。在訓練集和驗證集中的模型區分度均較高。

圖4 預測模型的ROC曲線(A:訓練集;B:驗證集)
2.7.2 校準度評價 Hosmer-Lemeshow擬合優度檢驗結果顯示:在訓練集中χ2=7.124,P=0.663(見圖5A);在驗證集中χ2=5.681,P=0.675(見圖5B),無明顯差異(P>0.05)。

圖5 預測模型的校準度(A:訓練集;B:驗證集)
2.7.3 臨床決策曲線 臨床決策曲線結果顯示,訓練集中,當閾概率在13%~89%時使用列線圖預測預后不良的凈獲益率高(見圖6A),而在驗證集中,閾概率在11%~84%范圍內凈獲益高(見圖6B),由此證明列線圖模型安全性和實用性較強。

圖6 預測模型的決策曲線分析(A:訓練集;B:驗證集)
3 討 論
GBS是一種單相疾病,以急性起病、免疫介導的多神經根病變、軸索或脫髓鞘為特征,臨床表現為急性起病反射性四肢麻痹伴或不伴球性麻痹,有時導致呼吸肌無力,因此需要機械通氣支持[8]。與其他自身免疫或慢性炎癥疾病不同,在以社區為基礎的研究中,發現16歲以下兒童發病的頻率為0.25~1.5/100 000人,雖然有研究報道GBS沒有性別差異,但也有報道稱GBS在男性中的發病率較高(男女比約為1.5∶1.0)[9]。本文與以往研究相似,GBS被認為是散發的,沒有季節性活動,但也由研究發現,GBS更可能出現在春季(44.4%)和夏季(24.4%)[10]。
在大多數患者中,神經系統癥狀的急性發作之前是前驅感染病史,之后出現進行性肢體無力,通常在1個月內達到頂峰,大多數患者在出現癥狀前6周內出現呼吸道或胃腸道感染,這種臨床癥狀通常表現為不同的嚴重程度和預后[11]。GBS與彎曲桿菌感染密切相關,空腸彎曲桿菌是最常見的和廣泛報道的,但只有不到0.1%的感染導致該綜合征[12]。由分子擬態和交叉反應抗體形成的感染誘導的異常免疫反應,由補體激活和某些宿主因子改變宿主的易感性貢獻,已被涉及到GBS的免疫發病機制。約20%~30%的GBS患者需要機械通氣[13],特別是在出現快速進展的肢體無力、自主神經功能障礙、球麻痹和雙側面肌無力的患者,機械通氣與功能預后相關,與本文研究結果一致。
GBS診斷結果是沒有明顯的炎癥表現,雖然在發病的第1周蛋白質水平可能是正常的,但如果在2或3周后測量,大多數患者的蛋白質水平會增加。先前的研究發現,GBS患者腦脊液蛋白異常升高可能是由于引起血-腦脊液屏障破裂或脈絡膜叢炎癥反應的疾病所致[14],這也是解釋了本研究中腦脊液蛋白升高為何是預后不良的危險因素。
脫髓鞘型和軸索型代表了GBS最常見的臨床亞表型,二者很難單獨從臨床角度進行區分,電生理在GBS的診斷、亞型的分類和預后的確定中起著決定性作用。傳導阻滯和遠端運動潛伏期延長似乎是脫髓鞘型的2個主要異常參數,發生在近50%的受累神經中,而F波延長和腓總神經傳導速率減慢則不常見[15]。在軸突GBS中,減少的CMAP明顯比缺失的F波更常見,但其頻率與傳導阻滯相當。考慮到單個運動神經,根據GBS亞型的不同,異常率似乎存在差異。在脫髓鞘型中,腓總神經和正中神經是最常受影響的神經,而在軸突GBS中,脛神經是最常受影響的神經,其次是腓總和尺神經。另一方面,正中神經較少受軸索型影響[16]。腓總神經傳導速率減慢,雖然在脫髓鞘型中相對罕見,但在下肢更為常見。這表明對脛總神經進行單獨的踝關節遠端刺激會阻止腓總神經傳導速率的測量。在脫髓鞘型中,遠端運動潛伏期的評估似乎在上肢更重要,而在軸索GBS中,在下肢需要特別注意CMAP振幅[17]。
綜上所述,腓總神經傳導速率和脛神經運動傳導速率減慢、F波和dCMAP 波幅異常率增加提示患者有預后不良的風險,故神經電生理檢測對重癥GBS患者病情及預后的預測具有重要價值。

