基于FAERS 數據庫的利奧西呱不良事件信號挖掘*
劉 芳,陳 靜,張麗新,成 華△
(1.首都醫科大學附屬北京潞河醫院,北京 101149; 2.內蒙古自治區人民醫院,內蒙古 呼和浩特 010017)
利奧西呱為口服的可溶性鳥苷酸環化酶受體激動劑,適用于慢性血栓栓塞性肺動脈高壓(CTEPH)且世界衛生組織心功能分級(WHO-FC)為Ⅱ級/Ⅲ級的成年患者或動脈型肺動脈高壓(PAH)且WHO - FC 為Ⅱ級/Ⅲ級的成年患者,以改善患者的運動能力。2013年在美國上市,2014 年初日本及歐洲批準用于治療CTEPH 和PAH[1],2018 年9 月在中國上市。目前,關于利奧西呱安全性的研究多為臨床試驗,暫無上市后基于大數據的藥品不良事件(ADE)信號的系統性研究。美國食品和藥物管理局(FDA)不良事件報告系統(FAERS)收集了由不同地區醫療保健專家、制藥廠商、患者等自發上報的ADE 報告,每季度更新1 次。本研究中基于FAERS 數據庫挖掘利奧西呱的ADE 信號,以期為臨床合理用藥提供參考。現報道如下。
1 資料與方法
1.1 數據來源
通過OpenVigil 2.1 數據平臺收集FAERS數據庫自建庫起至2022 年3 月31 日有關利奧西呱的ADE 報告,分別以“Riociguat”“Adempas”為檢索詞進行檢索。
1.2 數據提取與篩選
剔除原始數據中重復上報和ADE 為空白或非目的藥品名稱的報告,清洗數據,為減少“適應證偏倚”(將處方藥物的適應證報告為ADE)的影響,本研究中將與藥物適應證相關的首選術語(PT)刪除,獲得目標藥物的ADE 數據。根據《ICH 國際醫學用語詞典》25.0 版(MedDRA 25.0)中的PT 和系統器官分類(SOC)對ADE進行分類。
1.3 數據挖掘
采用頻率法檢測利奧西呱的ADE 信號,統計指標為報告比值比(ROR)和比例報告比(PRR)[2]。基于比例失衡測量法(表1 和表2)計算ROR與PRR,當目標ADE出現頻率高于整個數據庫背景頻率的閾值時,則代表出現1 個ADE 信號,且ROR和PRR越大,ADE 信號越強,說明目標藥物與目標ADE 之間的統計學關系越強。納入同時滿足ROR法和PRR法信號要求的ADE。

表1 比例失衡測量法四格表Tab.1 Four grid table for proportional unbalance measurement method

表2 比例失衡測量法計算公式Tab.2 Calculation formula for proportional unbalance measurement method
2 結果
2.1 ADE 報告的基本情況
共收集到以利奧西呱為首要懷疑藥物的ADE 報告6 551 份,涉及患者6 551 例;報告數據來源于39 個國家,其中上報數量排名前3 的國家分別為美國(84.69%)、日本(3.01%)、加拿大(2.69%),中國僅上報2 例;男女比例為1∶2.22;年齡≥60 歲的患者占比最高(54.24%);結局以死亡和住院治療為主,分別占33.86%和33.83%。詳見表3。
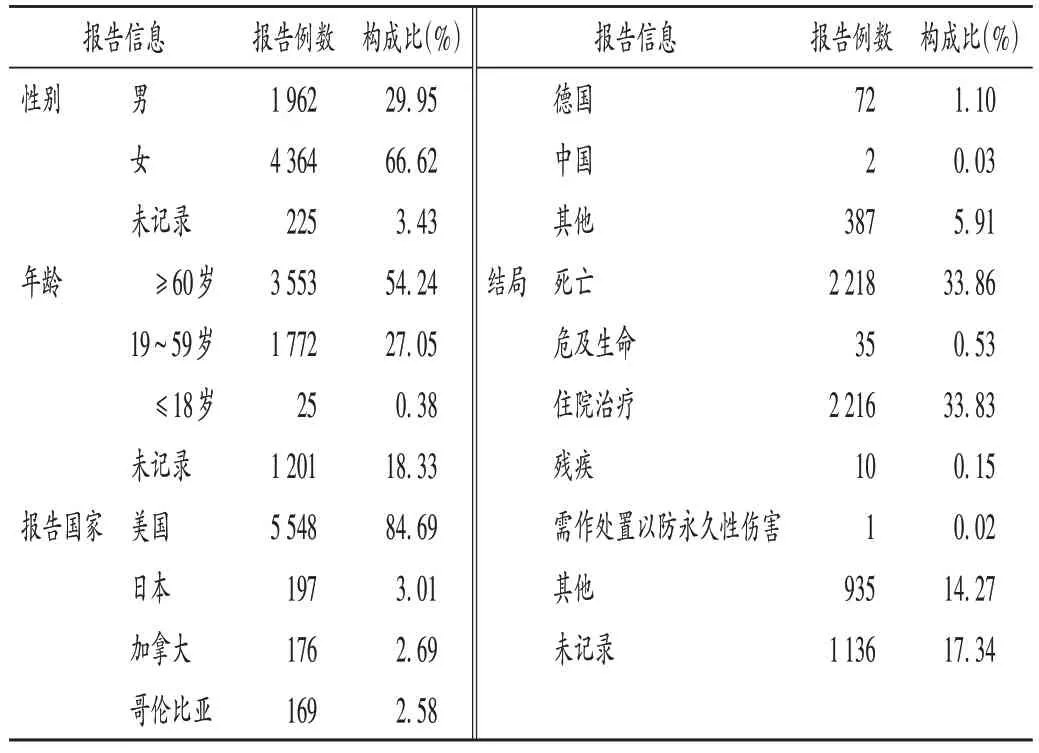
表3 利奧西呱ADE報告基本信息(n=6 551)Tab.3 Basic information of riociguat ADE reports(n=6 551)
2.2 各SOC 的ADE 報告與信號挖掘情況
挖掘到利奧西呱的ADE 信號584 個,排除適應證及產品問題、各類損傷、中毒及操作并發癥、各種手術及醫療操作、各種先天性家族性遺傳性疾病、社會環境等與藥物治療無關的信號167 個,最終獲得ADE 信號417個,其中358個(85.85%)ADE 信號在中文藥品說明書中未提及。涉及21 個SOC,SOC 報告數排名前5 的分別為胃腸道系統疾病、呼吸系統/胸及縱隔疾病、全身性疾病及給藥部位各種反應、各類檢查、各類神經系統疾病。詳見表4。SOC 項下報告數排名前5 的ADE 和信號分析結果見表5,ADE 發生頻次排名前10 的分別為死亡、呼吸困難、頭痛、血壓降低、外周水腫、頭暈、惡心、腹瀉、疲勞、液體潴留。
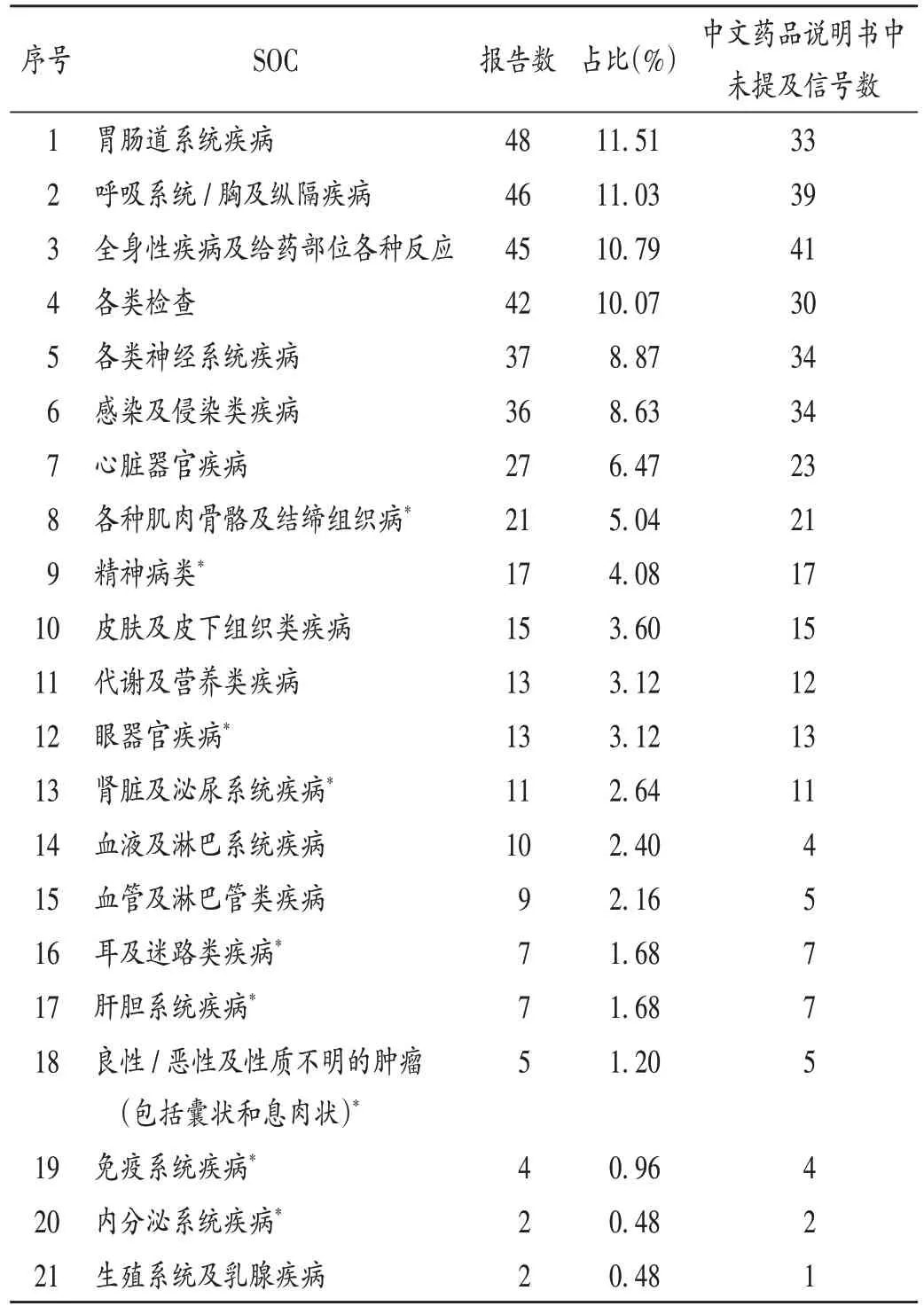
表4 利奧西呱ADE信號與累及系統/器官(n=417)Tab.4 ADE signals of riociguat and the involved systems /organs(n=417)
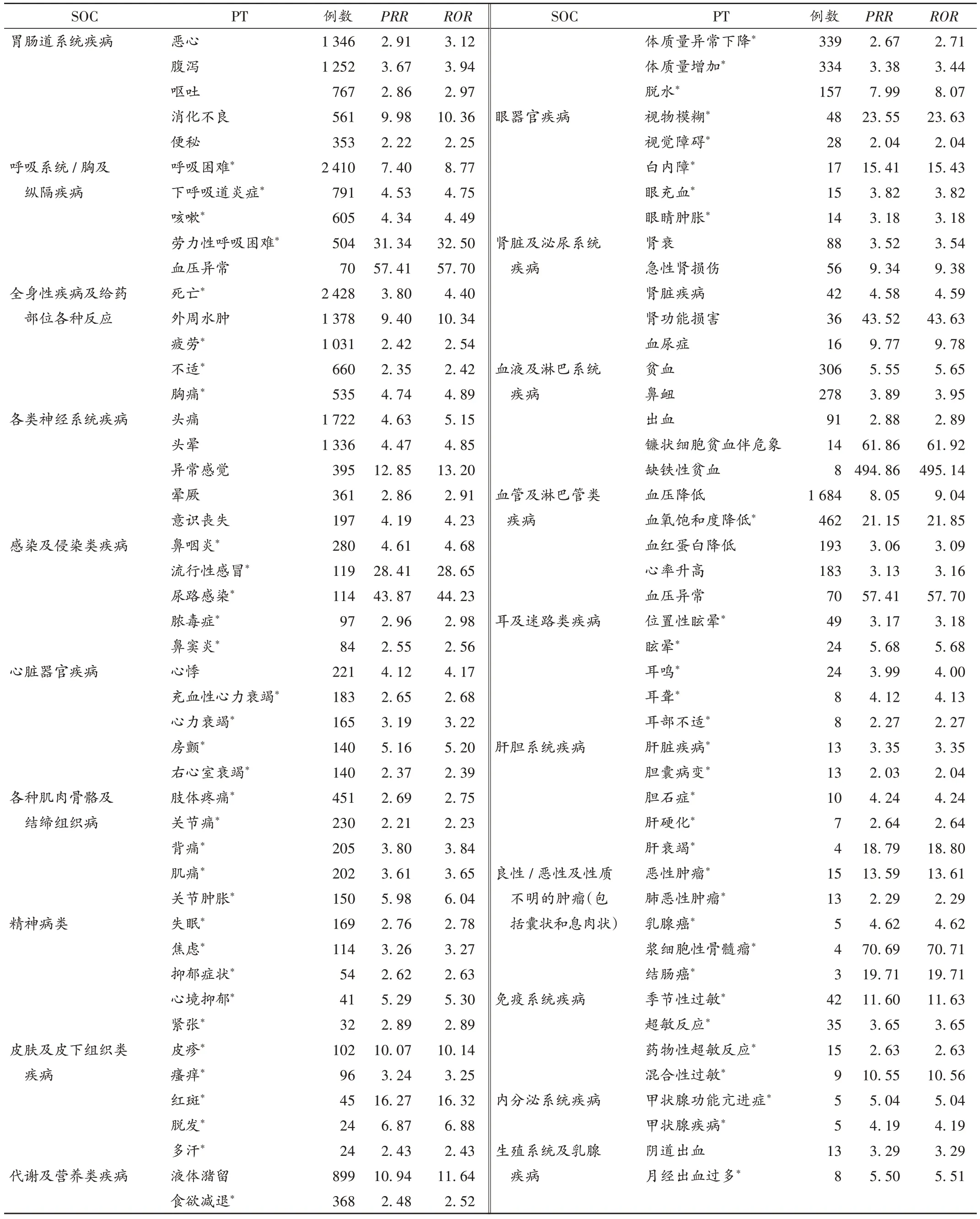
表5 利奧西呱各SOC項下報告數排名前5的ADE和信號分析結果Tab.5 Top five ADE reports under each SOC of riociguat and the signal analysis results
ROR法信號強度排名前50的ADE信號見表6,其中66.00%的ADE在中文藥品說明書中未提及,檢索文獻以進一步分析,但均尚無相關報道。警戒信號排名前10的分別為腸梗阻、副鼻竇不適、缺鐵性貧血、畏光、腦利尿鈉肽升高、痔瘡、低血糖、味覺障礙、味覺喪失、血壓異常。
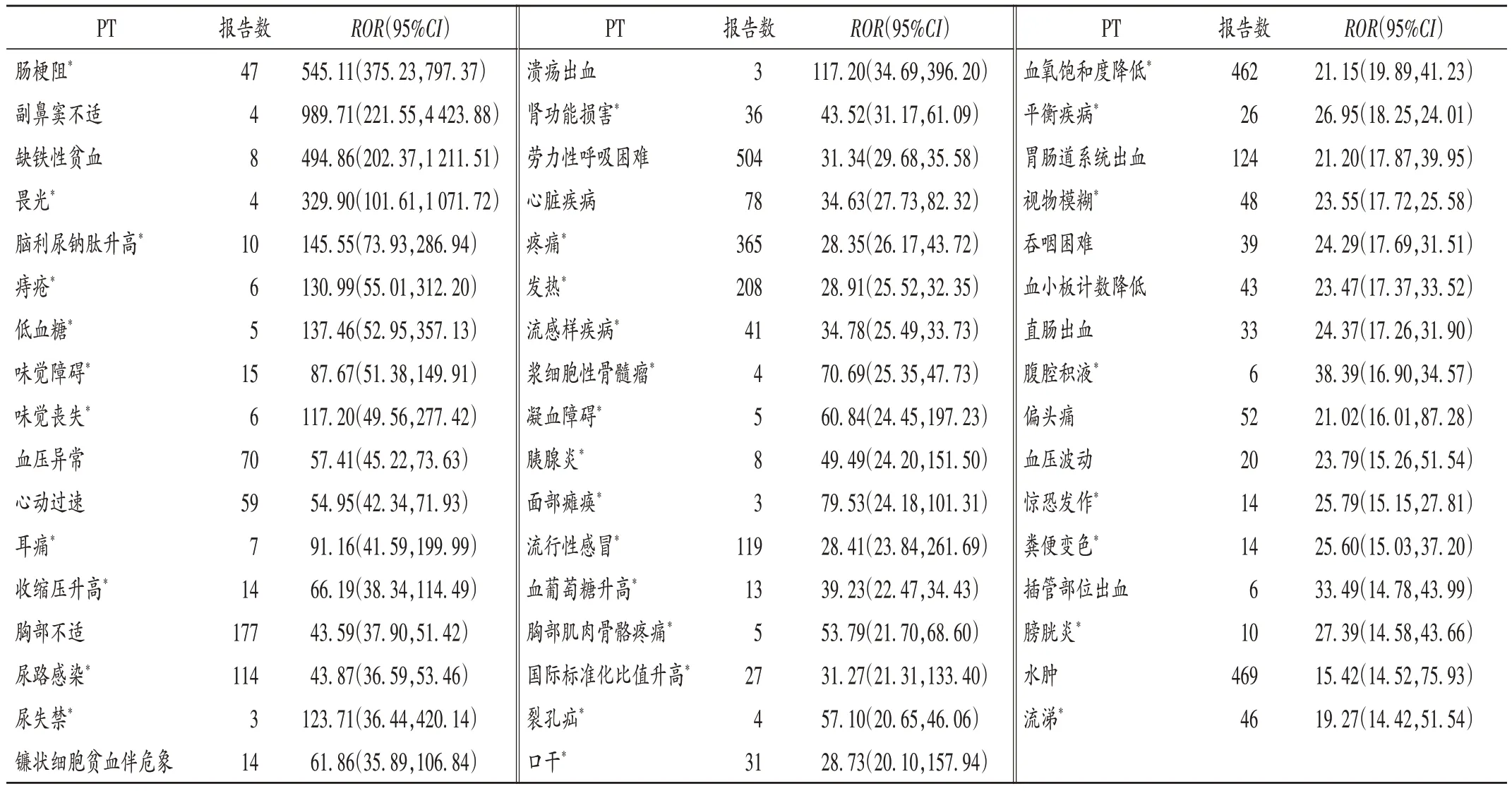
表6 利奧西呱ADE信號強度排名前50的PT(ROR法)Tab.6 Top 50 PT in the terms of signal intensity of riociguat - induced ADEs(ROR method)
3 討論
3.1 OpenVigil 2.1 數據平臺
FAERS 數據庫為自發呈報數據庫,上報的數據本身存在一定局限性,如上報信息不完整、報告不規范、重復上報等。OpenVigil 2.1數據平臺基于外部藥物數據庫Drugbank 和drugs@FDA 對FAERS 數據庫的信息進行映射,僅加載具有完整病例信息的報告。本研究中剔除了信息不完整的報告,故數據的質量更可靠,分析更完整[3]。
3.2 已知的ADE
ADE發生頻次排名前10的分別為死亡、呼吸困難、頭痛、血壓降低、外周水腫、頭暈、惡心、腹瀉、疲勞、液體潴留。其中,呼吸困難和疲勞為利奧西呱中文藥品說明書未提及的ADE。中文藥品說明書記載,Ⅲ期臨床試驗中最常見的ADE 為頭痛、頭暈、消化不良、外周水腫、惡心、腹瀉和嘔吐,與本研究中的5個信號重疊。日文藥品說明書記載,呼吸困難、疲勞、鼻塞發生率為1%~10%,為常見ADE,說明本研究結果可靠。
CHEST-1 試驗[4]結果表明,常見的嚴重藥品不良事件(SAE)為肺動脈高壓惡化、胸痛、咳嗽和右心室衰竭,2.5 mg 組(最大劑量)的藥物相關SAE 包括肝酶水平升高、暈厥前期、急性腎衰竭、食管疼痛和食道腫脹、室上性心動過速、全身性水腫和頸部疼痛,甚至可能因膿毒癥和咯血導致死亡。PATENT-1試驗[5]結果表明,最常見的SAE 為右心室衰竭和咯血,藥物相關的SAE包括胃炎和急性腎衰竭,其他ADE 包括國際標準化比值升高、活化部分凝血酶原時間延長、上呼吸道感染、背痛、血清肌酐水平升高、四肢疼痛和失眠。
一項納入510 例CTEPH 患者的Meta 分析結果顯示,利奧西呱的常見ADE 為消化不良和周圍水腫,未觀察到其他SAE,利奧西呱組患者頭痛、頭暈、鼻咽炎、惡心、嘔吐、腹瀉、低血壓、上呼吸道感染、便秘、呼吸困難和咳嗽的發生率與安慰劑組比較無顯著差異(P>0.05),但其導致消化不良和周圍水腫的發生率較高[6]。
一項日本上市后監測的中期數據研究結果顯示,利奧西呱治療CTEPH 的患者中,19.5%報告了ADE,2.1%報告了SAE[7]。發生率不低于0.5%的ADE 分別為低血壓(5.9%)、頭痛(3.0%)、頭暈(1.9%)、胃食管反流病(1.5%)、腹瀉(1.3%)、惡心(1.0%)、腹部不適(0.9%)、外周水腫(0.8%)、消化不良(0.6%)、咯血(0.6%),超過0.1% 的SAE 為低血壓(0.4%)、頭暈(0.2%)、缺氧(0.2%)。
3.3 新的ADE 風險信號
由表6 可知,中文藥品說明書未提及的ADE 風險信號有33 個,信號強度排名前10 的風險信號中腸梗阻、畏光、痔瘡、低血糖、味覺障礙和味覺喪失在藥品說明書及Ⅲ期臨床試驗中均未提及。在PubMed 數據庫中暫未檢索到相關ADE 的報道。由表4 可知,SOC 眼器官疾病、耳及迷路類疾病、肝膽系統疾病、良性/惡性及性質不明的腫瘤(包括囊狀和息肉狀)、免疫系統疾病和內分泌系統疾病項下的ADE 信號在藥品說明書及臨床研究中均未提及。可見,臨床應用利奧西呱時應密切關注頭痛、頭暈、消化不良、外周水腫、惡心、腹瀉、嘔吐、呼吸困難、疲勞等已知的ADE,以及腸梗阻、畏光、痔瘡、低血糖、味覺障礙/ 喪失等藥品說明書未提及的ADE,一旦發生應立即對癥處理。建議患者在用藥過程中注意飲食營養均衡,警惕可能出現的低血糖。
3.4 小結
本研究中基于FAERS數據庫,利用ROR法與PRR法挖掘利奧西呱上市后的安全警戒信號,為合理用藥提供參考。應重點關注利奧西呱可能引發的腸梗阻、畏光、痔瘡、低血糖、味覺障礙、味覺喪失等藥品說明書中暫未收錄、但真實世界信號強度較高的ADE,應用該藥前應做好評估,密切關注疾病進展,如發生ADE 及時采取干預措施,必要時停藥,以降低臨床用藥風險。

