大豆蛋白組分制備及其功能性的研究進展
欒濱羽,張 波,孟 昂,黃雨洋,夏曉雨,朱秀清,*
(1.哈爾濱商業大學食品工程學院,黑龍江省谷物食品與谷物資源綜合加工重點實驗室,黑龍江 哈爾濱 150028;2.中國農業科學院農產品加工研究所,農業農村部農產品加工綜合性重點實驗室,北京 100193)
大豆是重要的植物蛋白源和油料作物,我國進口的轉基因大豆主要用于榨油,其豆粕用于制作飼料,而國產非轉基因大豆榨油后的豆粕可以制備大豆分離蛋白(soybean protein isolate,SPI)、大豆濃縮蛋白、脫脂大豆粉等進入食品鏈[1-3]。大豆中蛋白主要存在于籽粒子葉組織的蛋白質體中,約占籽粒干物質總量的40%[4-5],根據其在0.5 mol/L離子強度下的沉降系數可分成2S、7S、11S和15S球蛋白4 種組分[6];也可按功能分成結構蛋白、貯藏蛋白和調節代謝、合成儲存物質、創建細胞結構的酶等代謝蛋白[7]。其中7S和11S球蛋白是大豆主要的貯藏蛋白,約占蛋白總量的80%[8]。此外,近年在大豆蛋白分離過程中還發現一種包裹在籽粒油體周圍的膜蛋白——親脂蛋白(lipophilic proteins,LP),該組分是由大豆球蛋白、β-大豆伴球蛋白和油球蛋白等油體結合蛋白與磷脂形成的復合物[9-10]。
大豆蛋白組分結構、功能性等對豆腐、豆漿、植物肉等大豆或大豆蛋白制品的感官品質均有較大影響[11-13]。王喜波等[14]研究發現當大豆蛋白的含硫氨基酸相對含量高于2%、11S與7S球蛋白比例高于1.88、平行式β-折疊結構相對含量高于39.96%時,生產的千葉豆腐品質較好;James等[15]分析了大豆蛋白含量與球蛋白亞基組成對豆腐凝膠性質的影響,發現蛋白含量越高豆腐硬度越大,11SA4亞基的缺失與豆腐硬度和持水性呈正相關;Zhang Qing等[16]對近年來原料品質和加工條件對豆腐品質的影響進行綜述,提出豆腐的品質主要與大豆球蛋白和β-大豆伴球蛋白有關,一般大豆球蛋白影響豆腐的硬度,而β-大豆伴球蛋白影響豆腐的彈性,故11S與7S球蛋白比例可視為篩選適宜生產豆腐的大豆品種的一個指標。
本文綜述大豆蛋白組分結構的研究現狀,重點闡述大豆蛋白組分制備工藝,總結大豆蛋白不同組分的功能性,旨在為大豆或大豆蛋白制品質量控制提供參考。
1 大豆蛋白組分的結構
11S球蛋白是大豆中含量最多的球蛋白,主要為含硫氨基酸較多的大豆球蛋白,分子質量介于320~375 kDa之間,其結構在中性條件下為由5 種亞基構成的空心六聚體[17],每種亞基由一條酸性多肽和一條堿性多肽通過二硫鍵連接形成,等電點處pH值約為5.8[8,18-19]。7S球蛋白主要由β-大豆伴球蛋白、γ-大豆伴球蛋白和堿性7S球蛋白組成[8]。其中β-大豆伴球蛋白是7S球蛋白的主要組分,分子質量約為180~210 kDa,在中性條件下以三聚體形式存在,由α、α’、β3 種亞基經疏水相互作用聚合形成,α、α’亞基等電點分別為5.2和5.3,而β亞基由等電點在5.8~6.2的4 種組分(β1~β4)構成[5,20-22];β-大豆伴球蛋白結構尤其特殊,表現在α和α’亞基除了核心區外還存在延伸區,且3 種亞基均為N-糖基化,即3 種亞基N末端均與高甘露糖聚糖分子相連,這使它們在溶解性上與大豆球蛋白截然不同[21,23-25]。11S和7S球蛋白的變性溫度在不同實驗中也有所差別,一般β-大豆伴球蛋白在68~72 ℃變性,大豆球蛋白在86~90 ℃變性[9,26]。大豆籽粒中11S與7S球蛋白的含量比通常在0.5~1.3之間,具體要歸因于生長環境和基因型的差異[27-29]。
此外,大豆蛋白中15S球蛋白含量最少,約5%,但凝膠過濾層析分析其分子質量表明15S球蛋白可視為由11S球蛋白亞基構成的二聚體[8,30]。2S球蛋白主要由胰蛋白酶抑制劑等抗營養因子構成,雖然其含量僅為8%,但其可引發人體呼吸道過敏反應,故加工中必須除去[8]。LP中約含蛋白70%、脂質10%,主要由脂肪氧合酶和膜蛋白組成[9,19]。其蛋白根據分子質量可分成來自油體的油質蛋白(24、18 kDa)、源于液泡中的蛋白(34 kDa)以及7S和11S球蛋白中各亞基和多肽等,其中7S和11S球蛋白亞單位約占LP總蛋白含量的60%[9]。LP中的蛋白對考馬斯亮藍染液的敏感性較低,因此通常十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)無法對其蛋白組成進行粗略定量。Samoto等[19]在2008年才通過凱氏定氮法和薄層色譜定量脫脂過程中未被正己烷除去的LP,最終發現7S、11S球蛋白及LP分別占脫脂豆粕總蛋白含量的23%、46%、31%。
2 大豆蛋白組分的制備
目前常見的大豆蛋白商品主要有脫脂豆粉、大豆濃縮蛋白、SPI 3 種。其中SPI的蛋白含量最高,可達90%以上;大豆濃縮蛋白次之,約70%;而脫脂豆粉僅去除了原料中絕大部分脂質,殘留約50%的多糖等非蛋白組分,但它是SPI的原料[5],它們均具有完備的工藝流水線生產方案。但7S、11S球蛋白及LP的提取方法還遠未達到流水線生產的標準。
Nagano等[31]為測定7S大豆球蛋白凝膠的動態流變參數,首次提出了一個針對7S和11S球蛋白的提純方案。該方案以脫脂豆粕為原料,將其與蒸餾水混合后,室溫靜置1 h,篩去不溶性組分后離心;離心后對上清液添加終質量濃度為0.98 g/L的亞硫酸氫鈉(sodium bisulphite,SBS),調整pH值至6.4后冰浴過夜儲存,再次離心,此時得到的沉淀物為11S球蛋白;上清液再加入0.25 mol/L NaCl溶液并調整pH值至5.0,再次離心;將離心后的上清液與2 倍體積的蒸餾水混合,調整pH值至4.8,再次離心,此時的沉淀為7S球蛋白。這種方法獲得的11S和7S球蛋白在脫脂豆粕中的提取率分別為10%和6%,純度均可達到90%以上。其中0.25 mol/L NaCl、pH 5.0和4 ℃被認為是分離7S球蛋白的最佳條件,而SBS則起到還原劑的作用,從而使蛋白提取率提高[32]。該方法是大豆蛋白“三步酸沉”的基本分離方案。
自1992年起,眾多研究致力于優化大豆蛋白的提取效果,主要基于提取過程中溫度、pH值和離子強度等工藝參數對蛋白構象的影響[31,33-35]。Deak等[33]曾為簡化提取過程采用CaCl2代替NaCl,由于表面電荷密度差異,pH 6.4時鈣離子更易與11S球蛋白結合,此方法雖提高了蛋白產量,但所提取的蛋白純度較低。Liu Chun等[34]選取堿性提取液的種類、堿溶pH值、提取溫度、脫脂豆粉與Tris-HCl緩沖液的比例、SBS濃度5 個因素,以11S和7S球蛋白含量、純度和提取率為指標依次進行單因素優化試驗,結果表明,以0.3 mol/L Tris-HCl緩沖液作為提取液可使11S和7S球蛋白的產量分別顯著提高2.01%和1.16%;堿溶pH值從7.5升高至9.0的過程中,兩種蛋白的產量和純度均先升高再降低,在pH 8.5時提取效果最好;提取溫度是指堿溶溫度,在由25 ℃升溫至45 ℃的過程中,兩種蛋白產量均顯著上升,并在45~65 ℃時顯著下降,相比Nagano等[31]在室溫下提取的方法效果更好,但45~55 ℃并未達到兩種蛋白通常的變性溫度;增加單位質量豆粉所需緩沖液的質量對增大蛋白溶解度從而提高產率和純度是最簡便有效的方法,但這還需考慮所用容器容量問題;通過SBS破壞二硫鍵從而降低蛋白聚集度同樣可提高蛋白溶解性,但隨著SBS濃度的提高,兩種蛋白的產量、蛋白含量、純度均呈先升高后降低趨勢,并在SBS濃度為0.01 mol/L時均達到最大值。在此基礎上,Din等[36]于2021年注意到前處理條件、原料種類對蛋白提取效果的影響,并將二次酸沉得到的中間產物回收用于提取11S球蛋白;結果表明用植酸酶前處理大豆籽粒、脫脂豆粕和SPI均可使11S和7S球蛋白的純度顯著提高,其中用SPI提取11S球蛋白效果最好,純度可達97.16%,產率可達48.92%,但酶處理后7S球蛋白產率會顯著下降。
實際上SPI中不僅有7S和11S球蛋白,在籽粒蛋白體和油體周圍還存在著大量膜蛋白[9]。研究表明通過傳統堿溶酸沉方式提取的大豆蛋白味道不佳,還殘留部分與脂類結合的蛋白,即LP[32]。受此啟發,Samoto等[19]重點探討了蛋白提取過程中LP的反應,為保證蛋白品質設計了一種新提取方案。該方案以經過70~80 ℃預熱處理的低溫脫脂豆粕為原料,與Nagano等[31]方法的明顯區別在于:選用5 mol/L稀硫酸和氫氧化鈉調節pH值;將pH值調整到5.8后提取11S球蛋白,之后調節pH值至5.0,再調至pH 5.5后進行離心提取LP,最后將pH值調至4.8得到7S球蛋白;此方法不需要大量的鹽和冷卻分離過程。該方法能夠提取LP的關鍵是利用了LP具有強疏水性且易于發生鹽析的特性。在pH 5.0時LP與7S球蛋白都處于不可溶狀態,pH 5.5時達到7S球蛋白溶解而LP不溶的狀態。此外預熱處理可保證7S和11S球蛋白的提取效果,但溫度過高會降低LP提取率。LP的發現間接解釋了以往方法中提取的11S與7S球蛋白不純且量少的原因,同時也促使一些研究者開始探討其功能性。
不同研究中大豆蛋白組分的提取流程和參數分別如圖1和表1所示。

表1 大豆蛋白提取工藝參數Table 1 Process parameters of soybean protein extraction
3 大豆蛋白組分功能性
加工條件會導致蛋白質由天然狀態轉換為中間狀態,最終徹底變性,蛋白質的功能性也由此變化[37]。在該轉變過程中蛋白質分子質量和一級結構通常不變,主要變化體現為蛋白質二級和三級結構改變引起的表層氨基酸組成改變,這為蛋白與蛋白之間以及蛋白與其他組分的相互作用提供條件。故蛋白質的天然狀態并不能完全決定其功能性,還需了解溶液、界面和凝膠等環境下蛋白質在折疊與展開過程中的結構轉變行為。
3.1 溶解性
蛋白質的溶解性通常是凝膠、乳液、飲料等產品生產所需考察的首要特性,可通過蛋白質在特定溶液中處于可溶狀態的氮含量占樣品總氮含量的比例表示。溶解性不僅與蛋白本身的氨基酸組成、序列、分子質量、蛋白構象有關,還與離子強度、pH值、溫度等環境因素有關[38-39]。根據蛋白結構可推測中性條件下β-大豆伴球蛋白N末端所連多糖會使其在水中的溶解度增大,這一結果已得到部分研究證實[40-41]。Jiang Jiang等[40]采用同種脫脂豆粕分別制備出SPI及11S、7S球蛋白3 種蛋白,將所得樣品以20 mg/mL質量濃度分散于pH 7.0、10 mmol/L磷酸鈉溶液中,通過調節分散液pH值,發現在pH 7.0時7S球蛋白溶解度最大(90%),其次是SPI(80%)和11S球蛋白(60%)。3 種蛋白的溶解度隨pH值的變化曲線均呈現為U型,7S球蛋白和SPI均在pH 4.5左右溶解度最低,11S球蛋白在pH 5.0處達到溶解度最低點,表明11S和7S球蛋白的等電點分別約為4.5和5.0。此外,隨著分散液中鹽濃度的增大,3 種蛋白的溶解度對pH值的敏感性都降低,在0、0.1、0.6 mol/L NaCl條件下,11S和7S球蛋白的溶解度變化差值分別為82.2%、82.0%、53.7%和93.9%、88.7%、8.2%。這與NaCl的離子效應有關。在等電點(pH 4~5)內,較高濃度的Na+和Cl-與蛋白質表面帶電基團相互作用,可在晶體-溶液界面形成雙電子層,從而增加等電點處大豆蛋白質的表觀溶解度。在等電點外,高濃度的離子會中和蛋白質表面異種電荷,并因此降低了調節溶液的pH值時引起的凈電荷增益。
大豆蛋白的溶解性還會受到熱聚集行為影響。一些研究者提出了Lumry-Eyring成核聚集模型,該模型中認為蛋白聚集由多個階段組成,依次包括構象變化、成核前、不可逆的聚集體成核、聚合程度增大和聚集體自締合[42-44]。Tang Chuanhe等[41]研究表明經過80 ℃預熱處理后,SPI僅在97.6 ℃出現11S球蛋白對應的吸熱峰,這可能是由于7 S 球蛋白在8 0 ℃下完全變性展開后與11 S 球蛋白形成了更穩定的聚集體。Guo Jian等[21]發現了β-大豆伴球蛋白和大豆球蛋白在加熱過程中聚集行為的區別。β-大豆伴球蛋白在由50 ℃加熱至100 ℃的過程中溶解度基本不變,而大豆球蛋白的溶解度隨溫度增加呈下降趨勢。當大豆球蛋白與β-大豆伴球蛋白分別按照4∶1、2∶1、1∶1的比例混合時,隨著β-大豆伴球蛋白的加入,復合物聚集體更小,溶解度提高。疏水相互作用可能是蛋白聚集的主要驅動力[45]。兩種蛋白的熱聚集機理如圖2所示。當聚集發生時,對于β-大豆伴球蛋白,一旦疏水殘基被覆蓋并形成聚集體,表面的多糖和親水基團就會提供排斥力抑制其他蛋白單體接近;但大豆球蛋白的堿性多肽中存在較多疏水氨基酸,因此展開后會暴露出更多活性位點。雖然部分活性位點在聚集過程中被覆蓋,但聚集體表面仍存在疏水殘基,導致活性位點持續聚集;在兩種蛋白共存時,覆蓋在球蛋白聚集體表面的不再是疏水殘基,而是β-大豆伴球蛋白的親水基團,從而終止了聚集行為。此外,這種蛋白質之間的熱聚集行為還與濃度有關。增加蛋白濃度會減小蛋白間距,有效地促進聚集[46-47]。葉榮飛等[48]研究表明不同濃度的SPI經80、100、120 ℃熱處理后的溶解度均隨著蛋白濃度的增大而減小。Chen Nannan等[49]認為由于天然大豆蛋白在高濃度下自發結合,導致蛋白質濃度越大,形成的聚集體回轉半徑越大,蛋白間相互作用越強。
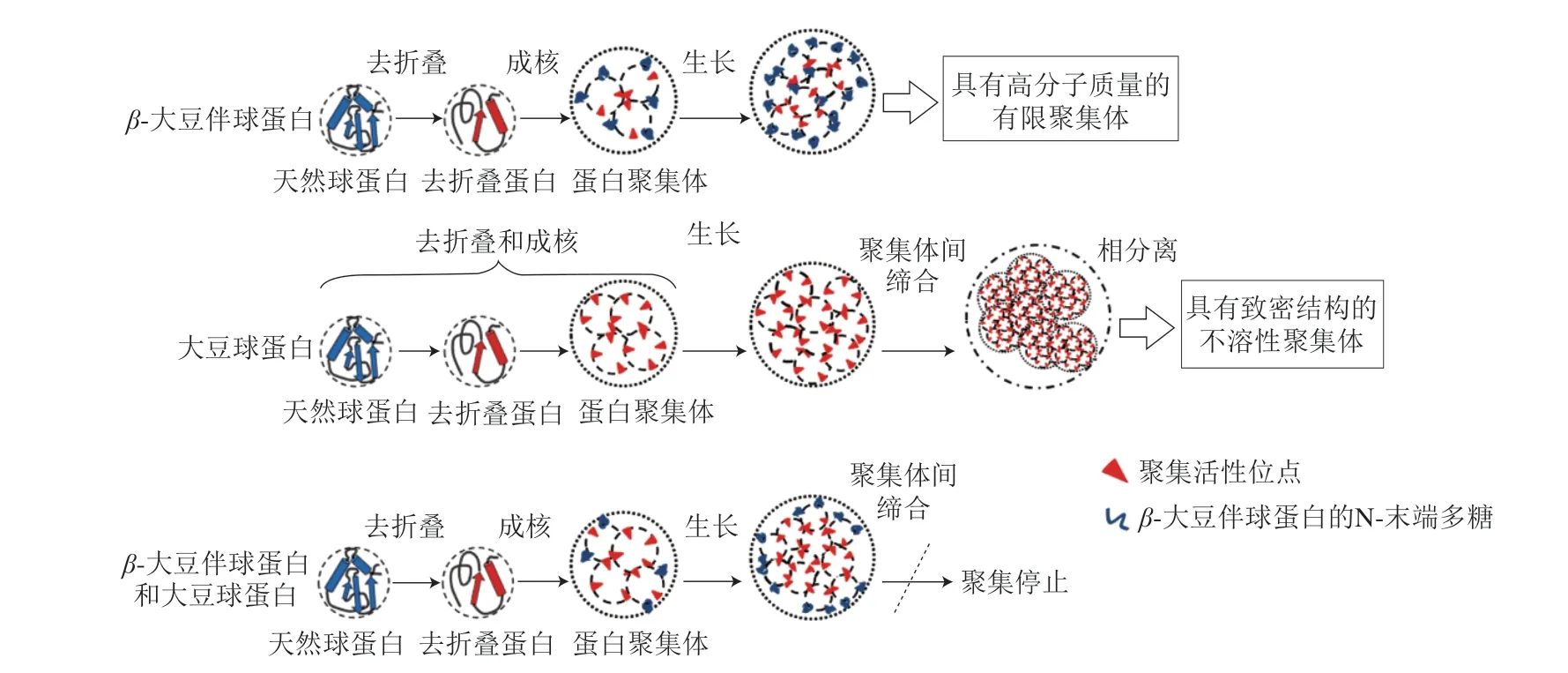
圖2 pH 7.0條件下β-大豆伴球蛋白、大豆球蛋白及其混合物的熱聚集行為[21]Fig.2 Thermal aggregation behavior of β-conglycinin,glycinin and their mixtures at pH 7.0[21]
育種和蛋白提取工藝的改進為獲得純度較高的某種大豆蛋白提供了更好的方法,Yuan Debao等[50]以經低熱處理后的豆粕為原料,通過DEAE-Sepharose快速流動色譜結合固定化金屬離子親和色譜,成功獲得了純度較高的β-大豆伴球蛋白的3 種亞基,其中β亞基含量為91.4%、α亞基含量為95.0%、α′亞基含量為92.1%。在此基礎上,He Xiuting等[25]發現7S球蛋白的熱聚集主要由β亞基主導,11S球蛋白熱聚集由堿性多肽主導。β亞基在50~90 ℃加熱過程中分子質量較高(>669 kDa)的組分對應色譜峰的峰面積顯著增加,而α及α’亞基的分子質量分布基本不隨溫度變化而改變;11S球蛋白的部分酸性多肽在加熱過程中完全不聚集,堿性多肽在90 ℃加熱30 min后即產生大量不溶物。動態光散射結果表明從50 ℃至90 ℃,11S球蛋白和酸性多肽的粒徑均變大,兩者的Z-平均直徑分別由56 nm增至158 nm(11S球蛋白)、由79 nm增至112 nm(酸性多肽);7S球蛋白粒徑在加熱過程中的增長較小(由29 nm增至44 nm),α及α’亞基的Z-平均直徑在不同溫度下始終穩定在29 nm左右,但β亞基的Z-平均直徑在50 ℃加熱時就達到了70 nm,在90 ℃時增大至158 nm,因此7S球蛋白中β亞基更易于聚集。對比不同蛋白亞基及多肽間表面疏水性發現,11S球蛋白的表面疏水性H0在60 ℃時約為5 000,后隨溫度升高急劇增加,在80 ℃時達到峰值12 000;酸性多肽加熱過程中的H0變化較小,在80 ℃同樣達到峰值,為4 200。7S球蛋白、β亞基和α及α’亞基在不同溫度下加熱的H0峰值分別在8 000、7 800和6 000左右波動。此外,蛋白、亞基和多肽的表面疏水性均在加熱過程的前10 min內增長迅速。這些結論與Guo Jian等[21]相似,即球蛋白分子先經過去折疊,在變性溫度下加熱一定時間后球狀結構展開,暴露出更多的疏水殘基,使表面疏水性增加。這種亞基及多肽間的熱聚集行為差異可能與蛋白一級結構氨基酸組成有關,例如含Val、Leu、Ala等疏水氨基酸較多的堿性多肽室溫下即可形成不溶性聚集體[51],β亞基同樣疏水氨基酸含量較多,且其結構中的延伸區僅有一個N-連接的高甘露糖多糖,但α及α’亞基各含有兩個,因此β亞基比α及α’亞基更易于聚集。故大豆球蛋白的溶解性受溫度影響較大,β-大豆伴球蛋白溶解性受離子強度影響較大。
3.2 凝膠性
凝膠是一種介于固態與液態之間的物質特殊狀態,大多食品都可以凝膠狀態食用。當蛋白溶膠的分子間相互作用增加,交聯增大至一定程度時轉化為凝膠[37]。大豆蛋白熱誘導凝膠的基本形成過程如下:大豆蛋白分散在水中,先以卷曲緊密的形式構成溶膠,隨溫度升高蛋白逐漸變性去折疊,鄰近分子間先形成聚集體,同時高溫使分子運動加劇,蛋白與蛋白間疏水相互作用更頻繁,達到平衡后形成具有一定網絡結構的凝膠,部分游離水被截留在凝膠網絡之中[52]。該形成過程中,共價相互作用二硫鍵起主導作用,同時也存在氫鍵、靜電斥力等非共價相互作用[37]。其中11S和7S球蛋白在35 mmol/L磷酸鹽緩沖液中(pH 7.6),100 ℃下形成凝膠的臨界蛋白含量分別為2.5%和7.5%[53]。11S球蛋白熱凝膠主要通過二硫鍵和靜電相互作用形成,7S球蛋白熱凝膠則通過氫鍵形成[16]。故pH值和溫度同樣可通過影響蛋白質聚集體的方式影響凝膠的結構和性質[54-55]。
根據大豆球蛋白加熱后聚集度更高可推測其熱誘導凝膠的儲能模量(G’)也應相對較大。Renkema等[56]證實了這一結論。同種大豆制備的大豆球蛋白(純度95%)和β-大豆伴球蛋白(純度60%)熱誘導凝膠的溫度掃描結果表明,在pH 3.8下大豆球蛋白和β-大豆伴球蛋白凝膠冷卻結束時的G’分別為4 000 Pa和2 500 Pa,pH 7.6下前者的G’為7 400 Pa,后者為5 400 Pa。pH 3.8和pH 7.6的大豆球蛋白凝膠的斷裂應力也顯著大于β-大豆伴球蛋白凝膠,前者分別為46.2 kPa和18.1 kPa,后者分別為2.1 kPa和2.2 kPa。
這兩種蛋白凝膠G’的差異也可能是由于含硫氨基酸含量不同,11S球蛋白每單位蛋白的蛋氨酸和半胱氨酸含量是7S球蛋白的3~4 倍[57],因此11S球蛋白在凝膠形成過程中有更強的交聯網絡。Bainy等[58]的研究結果也表明熱誘導凝膠的G’與11S和7S球蛋白比例并不直接相關(r<0.50),還取決于一種半胱氨酸殘基含量較少的A3酸性亞基的含量。由11 種不同大豆球蛋白、β-大豆伴球蛋白亞基缺失型大豆和1 種正常蛋白組成大豆制成的SPI熱誘導凝膠的動態流變分析結果表明,當A3亞基占總蛋白含量小于2%時,11S球蛋白亞基含量與凝膠完全形成時的G’存在相關性(r>0.967);當A3亞基占總蛋白含量大于2%時,凝膠完全形成時的G’與大豆蛋白組成無相關性,且11S球蛋白含量高的品種與11S球蛋白含量低的品種凝膠G’間無顯著差異,即7S球蛋白是熱誘導凝膠的主要結構單體,這可能是90 ℃下11S球蛋白不足以完全展開造成的。在針對豆腐的研究中也有相似結論,即11S球蛋白亞基組成與凝膠硬度間存在相關性[15,59]。此外,由于蛋白去折疊是凝膠形成的先決條件,故可以預測熱轉變溫度較低的β-大豆伴球蛋白凝膠形成時(損耗模量(G’)/G’=1)的溫度低于大豆球蛋白。7S球蛋白含量較高的品種凝膠形成溫度為74.2~82.2 ℃,11S球蛋白含量較高的品種凝膠形成溫度則介于86.2~90.2 ℃之間。
3.3 流變學特性
流變性測試可通過施加較大的剪切力或剪切頻率來破壞物料結構,從而在一定程度上反映原料在加工過程中的相變,具體通過黏度、G’、G’’以及扭矩等參數表征[60-62]。例如蛋白黏度過高往往會在加工中形成結塊無法溶解。物料流變性變化既受工藝參數的影響也受物料本身組成的影響。
Sandoval等[60]的研究表明對于高水分擠壓大豆蛋白產品,由黏度不同導致的速度梯度是其纖維狀結構形成的關鍵。Wittek等[63]對來源和蛋白質含量基本相同(占干物質總量的90%以上)的4 種SPI凝膠的穩態掃描結果表明,相同條件下,處理60 s時SPI凝膠的復合黏度分別為44 kPa·s(SPI 1)、43 kPa·s(SPI 2)、34 kPa·s(SPI 3)和14 kPa·s(SPI 4),這種差異可歸因于提取工藝不同導致的變性程度不一[64]。在Wittek等[63]的研究中,大豆濃縮蛋白的蛋白含量約占干物質總量的67%,但相同條件下其黏度(101 kPa·s)為SPI黏度的2 倍以上。這表明原料中較高比例的多糖等其他成分對黏度也有影響,與Zhang Wei等[65]對擠壓植物蛋白的研究結果相似,SPI的變性焓(ΔH)為0.72 J/g,將SPI、谷朊粉分別與小麥淀粉、玉米淀粉、馬鈴薯淀粉、甘薯淀粉、木薯淀粉、綠豆淀粉、豌豆淀粉、馬鈴薯直鏈淀粉、玉米支鏈淀粉共9 種淀粉混合(m(SPI)∶m(谷朊粉)∶m(淀粉)=65∶15∶20)后,混合物的ΔH介于1.24~2.42 J/g之間,混合物擠壓時的黏度介于308.70~633.61 Pa·s之間,混合物的ΔH與黏度呈顯著正相關(P<0.05)。
大多研究從蛋白質組分理化性質的角度討論其對凝膠結構形成的影響,但這不足以解釋凝膠加工過程的變化行為[66-69]。Mellema等[70]提出由展開的蛋白互相連接形成的鏈的曲率和連接方式決定著凝膠將以何種方式在微觀水平上變形,例如具有弧形鏈的凝膠主要變形方式為彎曲,而直線型且互相連接的鏈以拉伸的方式變形。在此基礎上,Renkama[71]的研究表明蛋白質鏈越彎曲,凝膠斷裂時的應變越大,因為彎曲的鏈要先伸直再發生斷裂。Xia Wenjie等[72]通過大振幅振蕩剪切實驗發現SPI、富11S蛋白(11S球蛋白含量72.1%、7S球蛋白含量3.3%)和富7S蛋白(7S球蛋白含量30.4%、11S球蛋白含量4.2%)三者形成熱凝膠的固有黏度和分子間相互作用強度不同。低蛋白含量(6%)條件下,三者G’排序依次為富11S蛋白(600 Pa)>SPI(300 Pa)>富7S蛋白(60 Pa),較低蛋白含量時的G’可反映分子間不發生或較少發生碰撞、聚合等相互作用時分散相的固有黏度,故富11S蛋白的固有黏度較高,SPI次之。但富7S蛋白的分子間相互作用更高,這可通過3 種蛋白G’-蛋白濃度曲線體現,富7S蛋白對應曲線的斜率最大(281.25),其次是SPI(266.67),富11S蛋白最小(150),即每增加單位濃度蛋白,富7S蛋白分子碰撞、聚集程度更大,G’增長更快。這可能是由于大豆球蛋白展開不充分,剛性結構的球蛋白顆粒抑制了分子間交聯[73-74]。對于富7S蛋白凝膠,可能是由于β-大豆伴球蛋白的柔性較強,形成的顆粒分支較多,相互間的聯系也更緊密,隨著應變增加,最初解離的顆粒會互相纏繞形成新團簇[75]。Gisler等[76]利用共聚焦激光掃描顯微鏡和掃描電子顯微鏡進行觀察發現,SPI和富11S凝膠具有相對致密的網絡,由較大的聚集體構成,而富7S蛋白凝膠更粗糙和不均勻,其組成的顆粒較小且分支較多。
4 結語
大豆雖在我國食品生產中有較多應用,但由于其組分和提取工藝的多樣性,企業對于產品品質的調控仍多憑借經驗選擇,原料組成、結構、功能性與感官品質之間的相關性仍比較模糊。本文介紹了近年來有關大豆蛋白組成及工業生產的相關知識,主要側重于蛋白提取工藝和功能性方面。有關大豆各組分的分離鑒定和蛋白功能性的表征手段仍留有空白。此外,為了達到綠色生產、減少碳排放的目的,應該鼓勵豆渣、豆粕等副產品廢棄物的利用,例如采用擠壓蒸煮生產素肉產品、開發大豆活性肽、生產生物基塑料制品等。

