最大血小板聚集率與急性腦梗死合并2型糖尿病患者神經缺損程度與預后的相關性*
仲婷婷, 張耀元, 王歡歡, 孫凡, 張淑娟, 薛茜**, 鄒玉安
(1.河北北方學院附屬第一醫院 神經內科, 河北 張家口 075000; 2.承德醫學院附屬醫院 神經內科, 河北 承德 067000)
腦梗死是由多種原因引起的局部腦組織供血障礙,導致腦組織缺血、缺氧性病變壞死,臨床上迅速出現相應神經功能缺損的一類綜合征,在血栓形成引起的腦梗死中血小板起著關鍵作用[1]。研究發現利用抗血小板藥物治療后,血小板的高反應性可能與基因多態性、糖尿病及肥胖等多種因素相關[2]。近年來血小板功能檢測在臨床血栓病防治研究和臨床實踐中取得了一些成績[3-4],因此開展血小板功能檢測不僅可以作為急性腦梗死的診斷依據,還可以對口服抗血小板藥物的患者 進行療效評價及監控,確保對腦梗死患者的預防及治療,并達到遠期療效,同時還能盡可能的避免及減少相關的副作用,因此本研究采用全血連續血小板計數檢測法對合并2型糖尿病的急性腦梗死患者進行血小板功能檢測,觀察最大血小板聚集率(max aggregation ratio,MAR)與無糖尿病腦梗死患者及正常健康人群的差別,對比MAR在此類患者用藥前后的變化,評估其與神經功能缺損程度、改良Rankin量表(mRS)評分、空腹血糖(FBG)及糖化血紅蛋白(HbAlc)的相關性。
1 資料與方法
1.1 一般資料
選取2018年12月—2021年12月在神經內科治療的120例腦梗死患者作為病例組,并根據患者是否患有2型糖尿病再均分為合并糖尿病組(病例組)和未合并糖尿病組(參照組),納入標準[5]:(1)首次出現急性腦梗死,發病時間不超過48 h的患者;(2)所有2型糖尿病合并急性腦梗死病例均符合中華醫學會糖尿病學分會制定的《中國2型糖尿病防治指南(2017年版)》中的糖尿病診斷標準,急性腦梗死符合1996年由中華神經科學會及中華外科學會制定的腦梗死診斷標準;(3)急性腦梗死患者需經頭顱CT和(或)MRI和(或)頭頸磁共振血管成像(MRA)或非創傷性血管成像(CTA)排除在腦梗死病因分型(TOAST)分型中的心源性栓塞及其它原因引發的缺血性卒中;(4)在過去3個月中沒有在醫院進行過抗血小板的治療;(5)病例患者或家屬對檢查結果知情并同意納入研究。排除標準[6]:(1)近半年內有患周圍血管閉塞性疾病、急性心肌梗死、有嚴重創傷或重大手術者;(2)有各種急慢性感染、腫瘤、結締組織疾病、溶血性貧血、甲狀腺功能異常、腎功能不全失代償者(血肌酐≥186 mmol/L)及心肺功能障礙者;(3)不能正常配合、具有神經性疾病等神經系統疾病的患者;(4)2型糖尿病患者經相關檢查需排除其他慢性疾病;(5)無法按時隨訪者。選取60例同期健康體檢者作為正常對照組。
1.2 治療方法
所有急性腦梗死患者入院后均采用依達拉奉注射液(南京先聲東元制藥有限公司,國藥準字H20050280, 20 mL∶30 mg)30 mg,溶入100 mL 0.9%氯化鈉注射液靜脈滴注,1次/d;丁苯酞注射液(石藥集團恩必普藥業有限公司,國藥準字H20100041,丁苯酞25 mg與氯化鈉0.9 g)100 mL,靜脈滴注,1次/d;注射用血塞通(昆藥集團股份有限公司,國藥準字Z20026438)0.5 g,溶入100 mL 0.9%氯化鈉注射液靜脈滴注,1次/d。阿司匹林腸溶片(拜耳醫藥保健有限公司,國藥準字J20130078,)100 mg,口服,1片/d。病例組患者在此基礎上加用二甲雙胍片治療(中美上海施貴寶制藥有限公司,國藥準字H20023371 ,0.5 g),初始用藥劑量為0.5 mg,一日1次,一周后根據血糖控制情況進行調整劑量。發病3個月后對病例組患者進行門診隨訪,根據mRS評分將病例組患者分為預后良好、預后不良2個亞組, mRS評分判斷標準[8]為≤2分為預后良好,mRS評分3~5分為預后不良,總分0~5分。
1.3 觀察指標
(1)比較病例組、參照組發病48 h內及正常對照組正常體檢時的FBG、HbAlc及MAR水平;采用日立7170A生化分析儀、PL-12血小板檢測儀進行檢測;(2)比較病例組患者在不同時間點(發病48 h、第7天及3個月)時的MAR水平變化;(3)比較病例組中不同神經功能缺損程度患者發病48 h時的MAR水平,神經功能缺損程度[7]根據發病48 h內NIHSS評分進行評估,0~1分表示神經功能正常,2~4分表示輕度神經功能缺損,5~15分表示中度神經功能缺損,16~20分表示中重度神經功能缺損,21~42分表示重度神經功能缺損;(4)比較病例組中不同預后亞組患者發病48 h內MAR水平;(5)分析病例組患者MAR水平與FBG、HbAlc、NIHSS及mRS評分的相關性。
1.4 統計學分析

2 結果
2.1 一般資料
結果顯示,3組受試者在年齡、性別、體質量指數(BMI)等一般資料比較,差異無統計學意義(P>0.05,表1)。具有可比性。
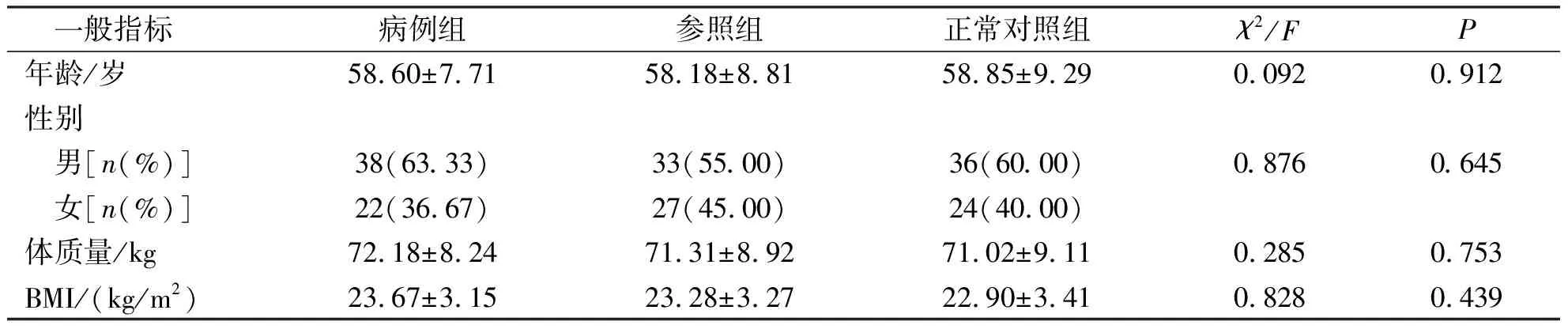
表1 三組受試者一般資料比較
2.2 MAR、FBG及HbAlc水平
結果顯示,3組受試者MAR、FBG及HbAlc水平比較,病例組>參照組>正常對照組,差異有統計學意義(P<0.05)。見表2。

表2 3組受試者MAR、FBG及HbAlc水平比較
2.3 病例組MAR比較
結果顯示,病例組不同時間點MAR比較,發病48 h>發病第7天>發病3個月,差異有統計學意義(P<0.05)。見表3。
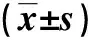
表3 病例組不同時點MAR比較
2.4 病例組不同神經功能缺損程度患者的MAR比較
結果顯示,病例組不同神經功能缺損程度患者的MAR比較,輕度<中度<中重度<重度,差異有統計學意義(P<0.05)。見表4。

表4 病例組不同神經功能缺損程度患者的MAR比較
2.5 病例組不同預后患者的MAR比較
結果顯示,病例組不同預后患者的MAR比較,預后良好患者低于預后不良患者,差異有統計學意義(P<0.05)。見表5。

表5 病例組不同預后患者的MAR比較
2.6 病例組MAR與FBG、HbAlc及NIH SS、mRS評分的相關性
Pearson相關性分析結果顯示,病例組MAR水平與FBG、HbAlc及NIHSS、mRS評分均呈顯著正相關(r=0.276、0.186、0.458及0.427,P<0.05)。見表6。
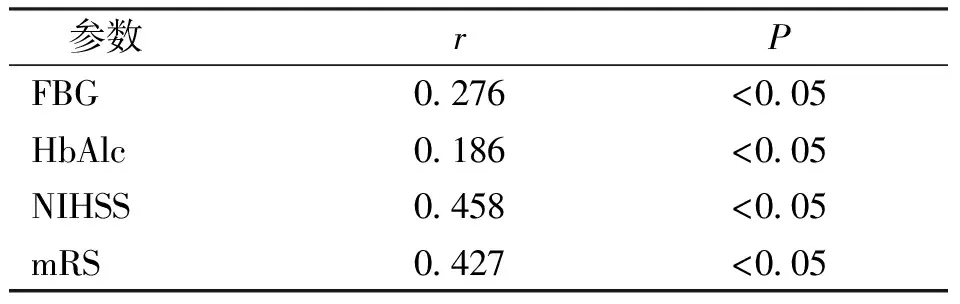
表6 病例組MAR與FBG、HbAlc及NIH SS、mRS評分的相關性
3 討論
糖尿病是目前臨床上十分常見,也是發病較為廣泛的一種多發疾病,極易引發各種常見并發癥,嚴重影響患者預后效果并損害其身心健康,2型糖尿病最常發生且較嚴重的并發癥為急性腦梗死,其發生腦卒中的風險是不患糖尿病患者2~4倍[9],患者血管極易變得狹窄甚至發生閉塞,從而引起血管的自我調節能力失去作用,血液成分發生變化,最終處在高度凝結狀態,引發患者致死或者自殘[10],另外還可以引發顱內動脈粥樣硬化狹窄,造成大腦神經損壞,引起大腦微循環失調,進而使腦部神經受到傷害,提高腦梗死的風險[11]。有研究表明,急性腦梗死的發生和發展與血小板的異常聚集和活化密切相關,因此可通過研究控制血小板聚集來控制病情是目前一個主要的手段[12]。血小板的聚集是指血小板具有相互黏附的特性[13],正常血液循環中,血小板是分散分布的,當有血管破裂出血的時候,凝血酶和膠原等誘導劑與血小板膜受體的結合,從而使血小板發生聚集,相互黏附在一起,形成血小板血栓,從而起到止血作用。在臨床上,血小板聚集可以反映機體血小板的功能。在急性腦梗死患者體內易造成動脈粥樣硬化,血小板活性增強,釋放出可以促進凝血的相關因子;當患者身體出現突發性失血后,由于腎上腺素能夠誘導血小板在破裂的動脈粥樣中出現硬化,從而使本身對血小板聚集抑制能較差的患者大概率出現梗死的現象[14]。MAR是血小板功能的一個重要指標,當MAR升高時,血小板容易聚集形成血栓,因此MAR數值越高患者形成血栓的可能就越大[15]。本研究通過對病例組、參照組以及正常對照組進行研究及分析,結果表明在發病48 h內病例組測得的檢測指標MAR、FBG和HbAlc的數值相較于參照組有明顯的增高,且具有統計學意義(P<0.05);參照組的MAR水平也明顯高于正常對照組(P<0.05),并且與正常對照組相比,參照組發病48 h內的FBG和HbAlc明顯升高,同時病例組患者的FBG和HbAlc檢測數據也明顯升高。通過Pearson相關性分析的結果顯示,病例組患者的MAR與FBG和HbAlc均表現為顯著正相關(P<0.05),可能與胰島素功能有關的部分受體存在于人類的血小板表面,當血小板上的胰島素受體與胰島B細胞分泌產生的胰島素特異性結合后,可以激活血小板表面的胰島素受體,從而使血小板的活性大大降低有關[16]。而2型糖尿病患者的主要病因是由于細胞內的胰島素受體對胰島素的敏感度大大降低,使相關信號通路的傳導增加,無法激活血小板上的胰島素受體并降低血小板活性,從而促進了血小板活化,誘發機體易形成血栓[17]。本研究還發現伴隨著治療時間的推移,2型糖尿病合并急性腦梗死患者病情在逐漸得到好轉后,其MAR也在逐漸降低(P<0.05),病例組不同神經功能缺損程度的MAR存在差異(P<0.05),預后不良亞組的MAR顯著高于預后良好亞組(P<0.05)。進一步通過Pearson相關性分析得出病例組患者的MAR水平與NIHSS和mRS評分均表現為顯著正相關(P<0.05),提示2型糖尿病合并急性腦梗死患者的MAR與腦梗死患者的病情嚴重程度和預后密切相關。
綜上所述,MAR對2型糖尿病合并急性腦梗死患者神經功能缺損情況和預后存在密切關系相關,可在臨床診斷以及預后方面為臨床醫生提供治療依據。

