老年衰弱與肌少癥
唐鑫鈺,黃賢濤,馬曌 綜述 楊帆 審校
遵義醫科大學第三附屬醫院&遵義市第一人民醫院,貴州 遵義 563000
伴隨全球老齡化形勢加劇,衰弱和肌少癥逐漸成為老年失能領域的熱點話題。衰弱與肌少癥臨床表現相似,且患病率與年齡相關,卻又各具特點,且均對老年人生活及生命質量產生影響。因此,對比衰弱與肌少癥的定義,找尋兩者臨床表現、發病機制之間的聯系,可為衰弱和肌少癥的預防提供借鑒及指導。
1 定義
衰弱(frailty)是與年齡相關的臨床綜合征,表現為老年人生理儲備能力下降導致易損性增加、抗應激能力減退的非特異性狀態;即使輕微刺激,衰弱老人都可能出現一系列負性臨床事件,如非計劃性入院、住院時間延長、失能、死亡等[1]。同樣地,在正常老化過程中,骨骼肌質量在30歲左右時達到峰值,之后,隨著年齡的增加,每年約有1%的肌量丟失,50歲以后每年下降1.5%,在70歲之后這個過程會更快,每年下降約3%[2]。肌少癥(sarcopenia)主要表現為漸進性和全身性肌肉質量減少和功能減退,并伴有生活質量下降和死亡率增加等不良風險,其與活動障礙、跌倒、低骨密度及代謝紊亂密切相關,是老年人生理功能逐漸減退的重要原因和表現之一[3-4]。
從定義上看,衰弱與肌少癥存在部分重疊,與年齡相關,且都表現為機體力量及耐力下降并增加不良事件的發生率,最終影響老年人的生活及生命質量;兩者常相互包含,例如,大多數衰弱的老年患者符合肌少癥診斷標準,而一些肌少癥患者也可表現為衰弱[5]。所以深入掌握老年人肌少癥和衰弱的發病機制、診斷篩查手段和治療策略,可以早期干預和診斷,減少不良情況的發生率,改善生活質量。
2 流行病學
因測定方法及納入標準不同,肌少癥和衰弱的患病率也存在差異。一研究團隊分別針對衰弱和肌少癥完成了兩項系統評價,包括28 篇衰弱相關文獻,共計95 036 名參與者,發現衰弱患病率為13%(95%CI:0.11,0.17)[6];而針對肌少癥,納入了9篇文獻,共計7 656 名被調查者,顯示肌少癥患病率為14%(95%CI:0.09,0.20)[6]。國外一項納入了100 例70 歲以上住院患者(女性48 例,男性52 例)的研究顯示,肌少癥占42%,衰弱占33%,19%的患者同時出現肌少癥和衰弱[7]。盡管肌少癥與衰弱的診斷標準不同,但兩者既可獨立存在,也可共存。
3 篩查方法
衰弱常用的篩查工具包括:Fried 衰弱表型(frailty phenotype,FP)[8]、以“累計健康缺陷”學說為依據的“衰弱指數(frailty index,FI)”[9]、Tilburg 衰弱評估量表[10]等衰弱評估工具。這些量表均不同程度涵蓋了老年人生理、心理、營養、生活方式、生活能力甚至社會支持等層面。其中,Fried 衰弱表型更注重描述身體衰弱,同時將肌肉萎縮視為生物基礎[11]。Fried等[12]專家將衰弱定義為至少存在下列三個及以上要素:(1)體質量下降,在過去12個月內或隨后出現的非故意體質量減輕≥4.5 kg以上,上一年體質量減輕≥5%;(2)無力,基線時握力降低至最低20%,根據性別和體質量指數進行調整;(3)耐力和精力差,如自我報告的疲憊和減少的峰值攝氧量(峰值VO2)所示;(4)步速減慢,基于4 m步態速度測試,根據性別和身高進行調整;(5)低體力活動水平,每周消耗的卡路里加權分數,根據性別調整。肌少癥則是對肌肉質量、功能、強度進行測定,其中較為常見的篩查工具即SARC-F 問卷(Strength,Assistance in walking,Rise from a chair,Climb stairs,Falls,SARC-F),該問卷包含5個維度:肌肉力量(strength)、輔助行走(assistance walking)、座椅起立(rise from a chair)、攀爬樓梯(climb stairs)和跌倒次數(fall),按Likert3級評分法分別計0~2分,5個維度得分之和即為SARC-F問卷總分,總分0~10分,評分≥4分為陽性篩查試驗[13-14]。其中的“肌肉力量測定”就是以測量握力為標準。由此看出,在篩查工具上“肌少癥”和“衰弱”所含變量可能部分重疊。同樣地,亞洲肌少癥工作組(Asian Working Group for Sarcopenia,AWGS)[15]對肌少癥的篩查方法中就包含了測量握力和步行速度(圖1)[16],而該項指標也是“衰弱表型”量表的構建參數。
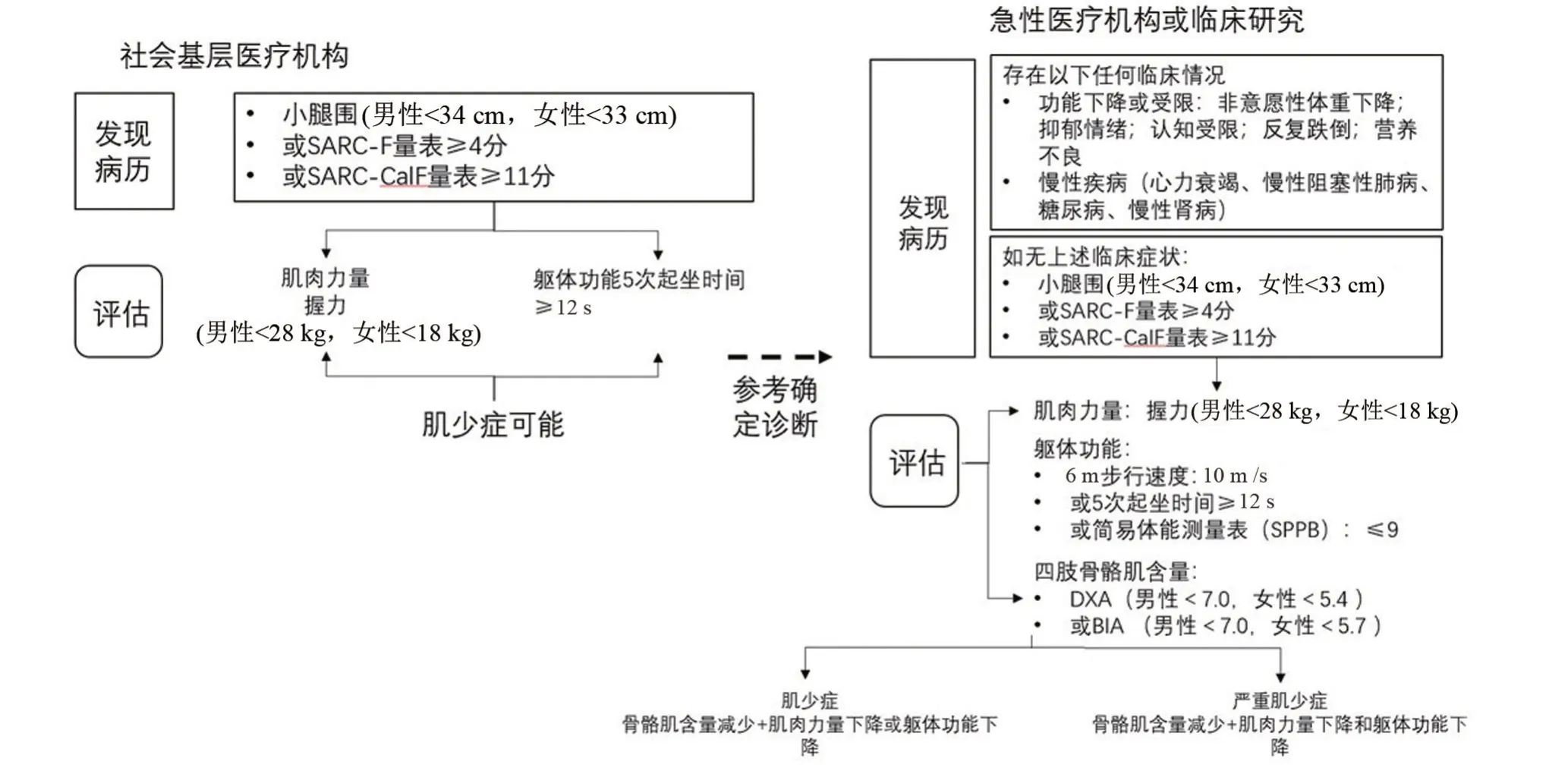
圖1 AWGS2019 肌少癥診斷路徑[16]Figure 1 Diagnostic pathway of sarcopenia in the Asian Working Group for Sarcopenia in 2019[16]
4 發病機制
4.1 炎性細胞因子衰老通常與炎癥水平的增加相關,盡管尚不清楚“炎癥”同衰老的因果關系[17]。有學者表示與衰老相關的脂代謝及炎癥分子(低度慢性炎癥)系統功能失調可能是肌少癥的關鍵因素[18],其特點是促炎性細胞因子水平增加,抗炎性細胞因子降低。Giovannini 研究團隊分析了大鼠腓腸肌中IL-15 信號和TNF-α介導的凋亡途徑與限制能量攝入之間的關系,結果表明衰老與大鼠腓腸肌IL-15 信號轉導降低有關,可能部分通過增強TNF-α介導的細胞凋亡而導致肌少癥[19-20]。同樣,促炎性細胞因子也與衰弱相關,一項白細胞介素-6 與衰弱的相關性Meta 分析結果顯示白細胞介素-6 水平偏高可能是衰弱的危險因素[21]。更有研究表明,血清IL-6 水平與握力和步態速度呈負相關[22-23]。所以衰弱與肌少癥可能與免疫失調相關,這也是肌少癥、動脈粥樣硬化、2 型糖尿病、癡呆等多種增齡性疾病的病理生理學基礎[24]。
4.2 低蛋白 有研究顯示老年住院患者前白蛋白水平<266 mg/L 時,前白蛋白與肌肉減少癥呈負相關。也有證據顯示低前白蛋白與男性肌少癥有顯著相關,周雨婷等[25]專家在老年維持性血液透析患者衰弱及其影響因素分析中表明白蛋白下降等多重因素可促進衰弱的發展。
4.3 內分泌因素隨年齡增長,促性腺激素釋放激素(GnRH)分泌發生變化,睪酮水平以每年約1%的速度下降。有證據表明睪酮能改善老年肌少癥患者的功能[26],較高的雄激素水平可能是老年男性免于衰弱的保護因素。同樣地,雌激素也可影響骨骼肌力量,有研究表明低雌激素水平的小鼠表現出骨骼肌力量的下降,并且這種影響可以通過雌激素替代療法(ERT)逆轉[27]。但該說法仍有存疑,例如在一項納入了9 項研究,共涉及2 476 名絕經后婦女的Meta分析中,得出了相矛盾的結論[28]。此外,有學者指出,非雄激素合成代謝激素如胰島素樣生長因子1(IGF-1)、維生素D 與中老年男性的衰弱狀態變化獨立相關。盡管有實驗證據顯示激素治療聯合阻力訓練可以改善患者的肌肉力量,但仍慎用,例如,雌激素替代療法可增加乳腺癌、中風、血栓栓塞、卵巢腫瘤的發生率[29]。
4.4 氧化應激 肌少癥本質上是由于蛋白質周轉的改變導致蛋白質合成和降解之間的不平衡,當蛋白質降解多于合成時就會發生肌少癥[30],氧化應激在這一過程中起著重要作用。氧化蛋白的積累和蛋白質穩態改變會導致肌肉質量的喪失、運動單位的喪失、單個肌肉纖維的喪失、神經肌肉連接的結構改變和碎裂以及肌肉神經支配受損[31]。而肌肉質量下降所致的活動量、握力下降也可促進衰弱的發生。
5 臨床表現
肌少癥與衰弱均包含以機體功能受損為特點,主要包括機體平衡障礙、步速下降以及肌力降低(圖2)[32]。肌少癥側重于肌肉功能減退及肌肉質量減少;衰弱綜合征除表現出與肌肉相關的身體活動能力降低外,還包含心理、認知障礙、社交孤立等方面;因而有學者認為肌少癥是衰弱綜合征的早期表現之一。

圖2 衰弱綜合征與肌少癥的臨床表現[33]Figure 2 Clinical manifestations of frailty syndrome and sarcopenia[33]
6 干預措施
6.1 運動干預 有Meta 分析證實,運動干預同樣可以有效改善衰弱老人的步態能力和平衡能力、降低跌倒風險[33]。國內專家通過養老機構老年人進行奧塔戈壁運動(起源于新西蘭,主要包鍛煉肌力和平衡力、步行鞏固鍛煉效果兩部分,整個過程為期1 年,康復師全程跟蹤及調整),顯示干預組移動能力、下肢肌力、平衡能力和衰弱狀況均顯著改善(P<0.05)[34-35]。一項納入了2 668 份記錄的Meta 分析同樣發現運動干預可能在改善肌肉質量/肌肉力量和步行速度方面發揮作用[36]。
6.2 營養干預
6.2.1 蛋白質及氨基酸 楊杰等[37]通過調查1 693 名老年人得出,衰弱老年人膳食模式的總能量、蛋白質、脂肪和膳食纖維等攝入量偏低,食用豆制品、油脂類及深海魚等海產品嚴重不足。這種膳食模式同樣可造成營養不良,進而引起肌少癥。補充必須氨基酸(EAA)和β-羥基-β-甲基丁酸(HMB)可改善肌肉質量和功能[38]。
6.2.2 維生素D 有Meta分析表明較低的25(OH)D水平與衰弱嚴重程度的增加顯著相關[39]。《老年人肌少癥口服補充中國專家共識(2019)》[40]也提出維生素D營養補充劑能夠使肌少癥患者在改善肌肉力量和步態方面獲益。另一項針對維生素D 水平與衰弱表型的相關性分析中也顯示維生素D 缺乏與衰弱綜合征密切相關[41]。
7 小結
肌少癥與衰弱綜合征雖在發病機制、評估方法等方面存在重疊,但同衰弱相比,肌少癥更加側重于骨骼肌減少及肌肉質量下降,而衰弱構建時涉及到的變量及臨床表現更加寬泛;由于衰弱的評估工具不同,所含參數也會不同,所以衰弱的治療策略更加復雜及個體化。無論肌少癥還是衰弱,都要強調早期篩查、預防為主、早期治療,減少半失能、失能患者的患病率,向健康老齡化目標邁進。

