基于DCs探討芍藥苷治療銀屑病的機制
王艾琳,危建安,韓 凌,盧傳堅,胡祥宇*
(1. 重慶市中醫院/重慶市第一人民醫院,重慶 400011; 2. 廣東省中醫院,廣東 廣州 510120)
既往研究表明芍藥苷可降低Th17細胞相關細胞因子水平[1],抑制IMQ誘導銀屑病動物模型中炎癥細胞的浸潤[2],并且可通過NF-κB和ERK通路抑制TNF-α誘導的血管內皮細胞趨化因子產生和白細胞遷移從而發揮抗炎作用[3],在一定程度上闡明了芍藥苷治療銀屑病的機制。但基于DCs研究芍藥苷治療銀屑病的具體作用靶點及調控機制尚不明確。
成熟樹突狀細胞(Mature dendritic cells,mDCs)通過淋巴管遷移至二級淋巴組織內,在此過程中其細胞表型發生了很大的變化,DCs成熟標志物 CD83等表達量逐漸增多,并分泌多種趨化因子及細胞因子(如IL-4、IL-10、IL-12、IL-23等),從而發揮調控T淋巴細胞的作用。總的來說,未成熟樹突狀細胞(Immature dendritic cells,imDCs)功能主要有抗原識別、攝取及處理,而mDCs的功能主要有抗原提呈及細胞因子分泌,可激活Na?ve CD4+T細胞,使其分化成Th1、Th2、Thl7或Treg細胞等。
1 材料與方法
1.1 實驗動物
BALB/c小鼠和C57小鼠,雄性,6周齡,體重18g~22g,購于廣東省醫學動中心。動物許可證書編號 SYXK(粵)2018-0094。
1.2 實驗設備和材料
1.2.1 實驗試劑
芍藥苷(純度≥95%)購自成都曼斯特公司;紅細胞裂解液購自博士德生物公司;Imiquimod(IMQ)購自阿拉丁公司;RPMI-1640培養液、胎牛血清購自Gibco公司;LPS購自SIGMA公司;小鼠細胞因子集落刺激因子(GM-CSF)和白細胞介素-4(IL-4)購自Pepro Tech公司;FITC Anti-Mouse CD11c、FITC Anti-Mouse CD11c、BV421 Anti-Mouse CD86、PerCP-Cy5.5 Anti-Mouse CD80、PE Anti-Mouse CD83、BV510 Anti-Mouse CD83、Alexa Fluro?647Anti-MouseI-A/I-E抗體購自BD公司;PrimeScript RT reagent Kit反轉錄試劑盒購自Takara公司。
1.2.2 實驗儀器
超高速流式細胞分選儀(BD,FACSAriaⅢ)、自動細胞計數儀(Countstar,IC1000)、低溫高速離心機(Eppendorf,5810R)、超凈臺(Esco Airstream,ClassⅡ)、電子分析天平(梅特勒-托利多儀器有限公司)、顯微鏡(奧林巴斯,BX51T-PHD-J11)、CO2培養箱(Galaxy 170S)、熒光定量PCR儀(Thermo life,ViiA7)、紫外分光光度計(Thermo,SMA2000)、細胞培養板及培養瓶(Corning公司)、全自動免疫磁珠細胞分選儀(Miltenyi,AutoMACS Pro)。
1.3 方法
1.3.1 BMDCs誘導培養
分離C57小鼠股骨、脛骨,收集骨髓腔中骨髓細胞,裂解紅細胞,細胞計數后用含10%FBS的RPMI-1640培養液調整濃度為(0.5~1)×106/mL,鋪至6孔培養板內,每孔2mL細胞,同時加入小鼠GM-CSF(20ng/mL)和IL-4(10ng/mL),37℃,5%CO2培養箱培養;每2天輕晃培養板,更換3/4體積培養液,補足細胞因子;第6或7天,收集細胞。
1.3.2 Na?ve CD4+T細胞的分選
獲取BALB/c小鼠脾臟制備單細胞懸液,孵育Na?ve CD4+T細胞磁珠,MASC自動分選儀分選收集 Na?ve CD4+T細胞。
1.3.3 Na?ve CD4+T細胞與BMDCs共培養
BMDCs與Na?ve CD4+T細胞按1∶9的比例調整細胞濃度至0.5×106個/mL,鋪至6孔培養板內,每孔2mL細胞,芍藥苷(5μM、20μM、100μM)提前干預24h,LPS(1μg/mL)或IMQ(10μg/mL)刺激共培養體系48h,5% CO237℃培養箱繼續培養24h。
1.3.4 流式檢測
收集細胞,標記染色,采用FlowJo V10軟件分析流式細胞術數據。
1.3.5 熒光定量PCR檢測細胞因子mRNA的表達
芍藥苷和IMQ(10μg/mL)干預BMDCs8h,提取總RNA,逆轉錄合成cDNA,用ViiA7熒光定量PCR儀,采用2-△△CT法進行數據的相對定量分析。表1為引物上下游堿基序列。

表1 RT-PCR引物序列
1.3.6 統計學處理
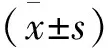
2 結果
2.1 芍藥苷對 BMDCs成熟的影響
流式檢測結果見圖1,與空白對照組對比,IMQ組BMDCs表面CD83、CD86表達顯著增高(P<0.0001),但芍藥苷不能抑制CD83、CD86的表達(P>0.05),差異無統計學意義。說明芍藥苷不能抑制體外IMQ誘導的BMDCs成熟。

圖1 芍藥苷 IMQ干預的小鼠 BMDCs成熟的影響 注:*P<0.05,**P<0.01,***P<0.001,****P<0.0001,vs IMQ,#P<0.05,##P<0.01,###P<0.001,####P<0.0001,vs Control.
2.2 芍藥苷對 BMDCs 細胞因子 mRNA的影響
RT-PCR檢測結果見圖2,與空白對照組對比,IMQ造模組BMDCs中基因IL-1β、IL-6、IL-12A、IL-23、IFN-γ及TNF的mRNA的表達顯著增高(P<0.05);與IMQ組對比,5μM、100μM芍藥苷不能抑制BMDCs中上述細胞因子mRNA的表達,甚至促進炎癥因子基因IL-1β、IL-6、IFN-γ、IL-23和TNF的表達(P<0.05)。說明芍藥苷不能抑制 IMQ誘導的 BMDCs中炎癥因子 mRNA的表達。

圖2 芍藥苷對 IMQ 刺激 BMDCs 細胞因子 mRNA的影響 注:*P<0.05,**P<0.01,***P<0.001,****P<0.0001,vs IMQ,#P<0.05,##P<0.01,###P<0.001,####P<0.0001,vs Control.
2.3 芍藥苷對 BMDCs調控Treg細胞分化的影響
BMDCs與Na?ve CD4+T細胞共培養3天,收集細胞,流式檢測Na?ve CD4+T細胞的分化。結果見圖3,LPS組CD4+CD25+、CD4+CD152+細胞比例與空白對照相比顯著減少(P<0.01);5μM、20μM和100μM濃度芍藥苷干預后,CD4+CD25+、CD4+CD152+細胞比例具有增高的趨勢,其中20μM、100μM芍藥苷組CD4+CD25+、CD4+CD152+細胞比例顯著增高(P<0.01)。說明芍藥苷可能通過上調Treg細胞的表達,從而發揮抗炎抗銀屑病的作用。

圖3 芍藥苷對 BMDCs控Th細胞分化的影響 注:*P<0.05,**P<0.01,***P<0.001,****P<0.0001,vs IMQ,#P<0.05,##P<0.01,###P<0.001,####P<0.0001,vs Control.
3 討論
張晗等[4]研究認為芍藥苷可抑制不成熟DCs共刺激分子CD80、CD40和MHCⅡ的表達;史冬梅等[5]發現芍藥苷抑制DCs表面分子MHCⅡ、CD40、CD80、CD86的表達,從而抑制DCs表型成熟。但在本研究中,芍藥苷在體外未能抑制DCs表面共刺激分子CD83、CD86表達,并且芍藥苷不能抑制IMQ刺激BMDCs中炎癥因子IL-1β、IL-6、IL-12A、IL-23、IFN-γ及TNF mRNA表達的增高。說明芍藥苷不能抑制DCs的成熟和 DCs產生炎癥因子。
Treg細胞對維持機體免疫微環境穩態具有重要作用,對效應Th1及Th2細胞均具有抑制作用。據此推測,銀屑病患者皮損和外周血中的Treg細胞受損,其對效應T細胞的抑制能力下降,造成免疫穩態失衡。CD152在Treg分化發揮積極作用,芍藥苷可誘導Treg分化。鄭凱等[6]發現芍藥苷能誘導幼稚CD4+T細胞向CD4+CD25+FoxP3+Treg分化并促進IL-10mRNA的產生。本研究表明體外BMDCs與Na?ve CD4+T細胞共培養實驗中,LPS刺激組CD4+CD25+、CD4+CD152+細胞比例顯著較空白對照顯著減少,而20、100μM芍藥苷可顯著增加CD4+CD25+、CD4+CD152+細胞比例。據此推測,芍藥苷可能是基于DCs促進Na?ve CD4+T細胞向Treg細胞分化,從而發揮抗炎抗銀屑病的作用。
4 結論
通過本研究表明芍藥苷不能抑制IMQ誘導的BMDCs的成熟和BMDCs中炎癥因子IL-1β、IL-6、IL-12A、IL-23、IFN-γ及TNF mRNA的增高;但芍藥苷可以通過BMDCs促進Na?ve CD4+T細胞向Treg細胞分化,從而發揮抗炎抗銀屑病的作用,為芍藥苷在銀屑病等自身免疫病治療中的應用提供了實驗依據。

