解析北京等級考試題,探索化學教育教學路徑
秦 蕾 王耀宗* 陳瑞雪 溫利權
(1.北京大學附屬中學 北京 100086;2.北京教育考試院 北京 100083;3.北京市朝陽區教育科學研究院 北京 100021;4.北京市第二中學 北京 100010)
教育評價事關教育方向,有什么樣的評價引導,就有什么樣的教學導向。2020年6月,中央全面深化改革委員會第十四次會議審議通過了《深化新時代教育評價改革總體方案》,提出穩步推進中高考改革,構建引導學生德智體美勞全面發展的考試內容體系,改變相對固化的試題形式,增強試題開放性,減少死記硬背和“機械刷題”現象。考試評價尤其是高考命題工作,作為教育評價的重要組成部分,對教學實踐有顯著的導向作用,在培育良好教育生態、減輕學生課業負擔以及校外培訓負擔上應發揮其獨特的積極作用。
北京市化學科考試作為自主命題和素質教育的關鍵環節,其核心功能是立德樹人、服務選才、引導教學。自2014年以來,隨著高考改革的不斷深化,以“有利于促進學生健康發展,有利于科學選拔各類人才,有利于維護社會公平”為基本出發點和落腳點,化學科考試一直堅持“四個突出、四個考出來”命題理念,在不斷深化考試內容改革發揮命題的育人導向功能的過程中,積極通過考試的教育引導作用撬動中學教學變化。經過多年發展,化學科考試通過增強教考良性互動,引導教學減負,促進課堂提質,實現育人增效。考試的內容、形式和結果直接影響教學內容的設置和教育教學的形式。現以2022 年北京等級考化學卷的部分試題分析為例,探索日常的化學教育教學路徑。
一、秉承綠色化學觀念和可持續發展意識,堅持學科立德樹人根本任務
2022 年北京等級考化學卷命題充分體現了化學在生產和生活中的廣泛應用,尤其是突出了綠色化學觀念和可持續發展意識,充分體現了學科選拔人才秉承的立德樹人根本任務。表1將全卷涉及的題面和立意進行了簡要匯總。
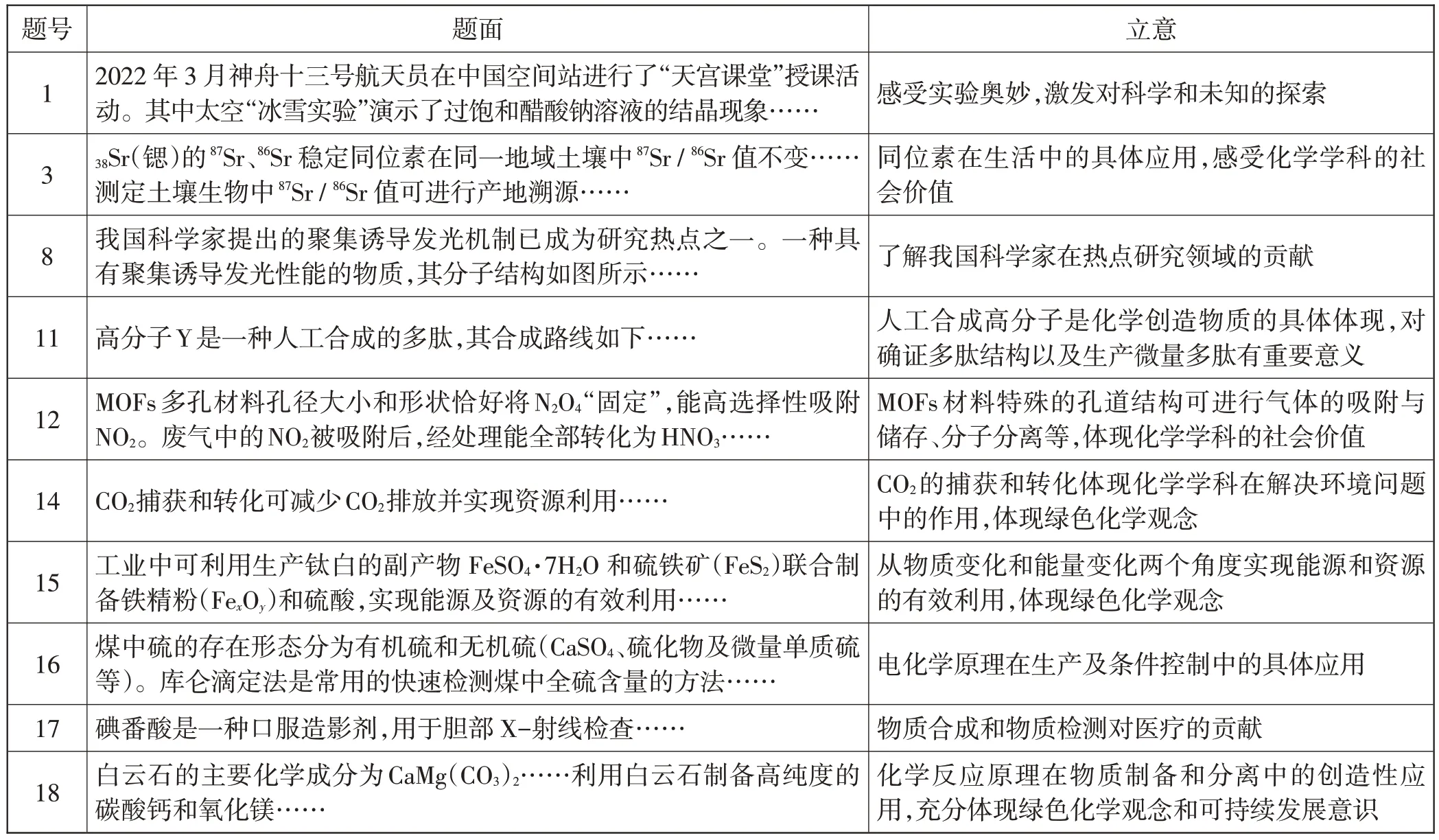
表1 2022年北京等級考化學卷試題中體現的立德樹人思想
由表1 可見,全卷19 道試題中有10 道試題基于化學學科在生產和生活中的實際應用。現以第15題為例,結合課程標準要求進一步說明對教育教學的啟示。
1.原題呈現
2022年第15題(節選):
工業中可利用生產鈦白的副產物FeSO4·7H2O 和硫鐵礦(FeS2)聯合制備鐵精粉(FexOy)和硫酸,實現能源及資源的有效利用。
(3)FeSO4·7H2O 加熱脫水后生成FeSO4·H2O,再與FeS2在氧氣中摻燒可聯合制備鐵精粉和硫酸。FeSO4·H2O分解和FeS2在氧氣中燃燒的能量示意圖如圖1 所示。利用FeS2作為FeSO4·H2O 分解的燃料,從能源及資源利用的角度說明該工藝的優點。
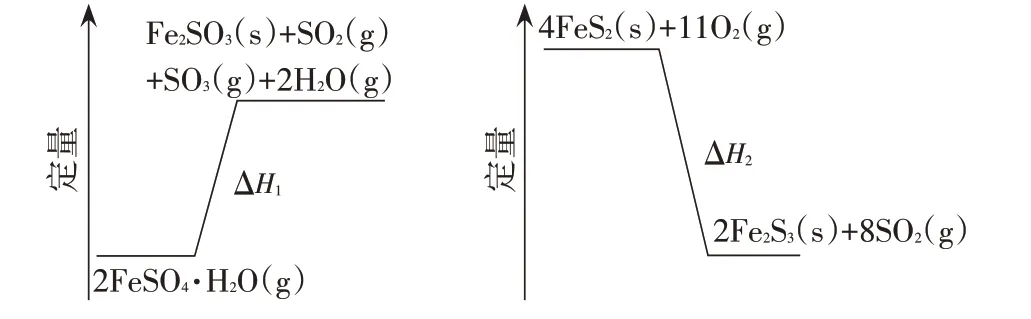
圖1
2.試題解析
試題給出分析問題“能源及資源利用”的兩個角度,學生需要關聯并選取題干的相關信息,就工藝優點做出分析。首先,從能量變化的角度來看這兩個反應。2FeSO4·H2O的分解反應是吸熱反應,FeS2在氧氣中摻燒的反應是放熱反應。從能源利用的角度可以聯合兩個反應,FeS2在氧氣中摻燒放熱為2FeSO4·H2O的分解提供能量,從而達到能源的有效利用。其次,從物質變化的角度來看這兩個反應。兩個反應的產物中均有Fe2O3,是制備鐵精粉(FexOy)的原料,產物中的SO2、SO3是制備硫酸的主要原料,從而達到資源的有效利用。
3.教學啟示
學科核心素養是學科育人價值的集中體現,在課程標準的不同主題中,均結合學習活動和情境素材,在學習過程中幫助學生認識化學學科在環境保護、資源合理開發利用等方面做出的貢獻,讓學生能夠秉承綠色化學觀念和可持續發展意識,能夠運用已有的知識和方法綜合分析解決化學過程中可能帶來的問題和影響,學生通過學科學習逐步培養科學態度與社會責任素養,以形成正確的價值觀和必備品格。化學考試和化學教學必須旗幟鮮明地將立德樹人作為根本任務,不斷加強學科學習的育人功能,樹立學科學習的積極導向作用,培養能夠踐行社會主義核心價值觀的社會主義建設者和接班人。[1]具體見表2 課程標準中的部分內容。[2]
二、基于認識物質性質及化學反應的學科角度和方法進行學習建構
1.原題呈現
2022年第7題:
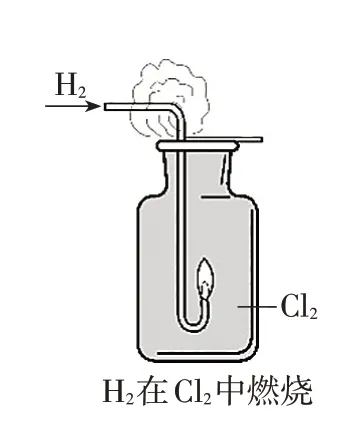
A.H2分子的共價鍵是s-s σ鍵,Cl2分子的共價鍵是s-p σ鍵
B.燃燒生成的HCl 氣體與空氣中的水蒸氣結合呈霧狀
C.停止反應后,用蘸有濃氨水的玻璃棒靠近集氣瓶口產生白煙
D.可通過原電池將H2與Cl2反應的化學能轉化為電能
2.試題解析
本題的素材選取考生非常熟悉的氫氣在氯氣中燃燒的實驗,四個選項的設置分別基于分子的成鍵類型、實驗現象、產物的性質以及化學反應能量變化的應用四個角度,層層遞進,考查考生對基本知識的理解和掌握情況。
A 選項源自選修2 物質結構模塊,主要考查考生對H2、Cl2分子中共價鍵成鍵方式的認識,H2分子中是通過s-s 形成的σ 鍵,Cl2分子中是通過p-p 形成的σ鍵。A選項不正確。
B 選項源自必修1 模塊氯氣的性質,主要考查考生對于物質性質的認識和實驗現象的理解。H2在Cl2中燃燒放熱,生成HCl 氣體,揮發到集氣瓶口處,HCl極易溶于水,遇到空氣中的水蒸氣呈霧狀。
C選項源自必修1模塊氯化氫和氨氣的性質。用蘸有濃氨水的玻璃棒靠近集氣瓶口,濃氨水有揮發性,NH3遇到HCl 迅速發生反應NH3+HCl===NH4Cl,NH4Cl為白色固體,在空氣中為白煙。
D 選項源自選修1 模塊對于原電池原理的認識。H2與Cl2的反應中發生了電子轉移,其本質為氧化還原反應,且反應自發,這樣可以通過原電池將H2與Cl2反應的化學能轉化為電能,體現課程標準中關于“制作簡單的燃料電池”的要求。
3.教學啟示
本題基于熟悉的化學反應,通過必修1、選擇性必修1、選擇性必修2三個不同模塊內容的巧妙融合,在一道選擇題中盡現高中化學在不同階段的學習認識發展。素材選取貼近教材,注重基礎,通過設問引導日常教學重視落實基于學科本質的認識發展進階。梳理必修和選修模塊學習中對于物質性質和化學反應的認識如圖2所示,在不同模塊教學階段應注意建構化學科認識世界的學科視角和學科方法,在不同的學習階段開啟的是同一個客觀的世界,只是認識的角度在不斷地豐富,認識的層面在不斷地深入。對于物質性質的認識從宏觀表象到微觀結構,幫助學生“看到”了一個看不見的微觀世界,凸顯化學學習的奧妙;對于化學反應從本質的認識到創造性的應用反應、創造新的物質,幫助學生理解化學學習的學科價值和社會價值。教學內容的結構化設計有助于學生在學習建構過程中體會化學科學是人類認識世界和改造世界的工具。

圖2 對物質性質和化學反應認識的學習進階
三、基于核心素養、結合技術手段,挖掘實驗功能、促進學習發展
1.原題呈現
2022年第14題:
CO2捕獲和轉化可減少CO2排放并實現資源利用,原理如圖3所示。反應①完成之后,以N2為載氣,將恒定組成的N2、CH4混合氣,以恒定流速通入反應器,單位時間流出氣體各組分的物質的量隨反應時間變化如圖4 所示。反應過程中始終未檢測到CO2,在催化劑上檢測到有積炭。下列說法不正確的是( )。
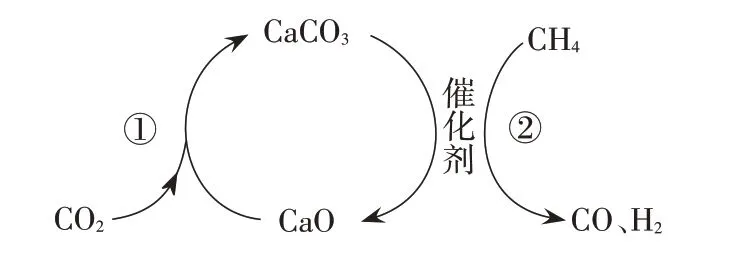
圖3
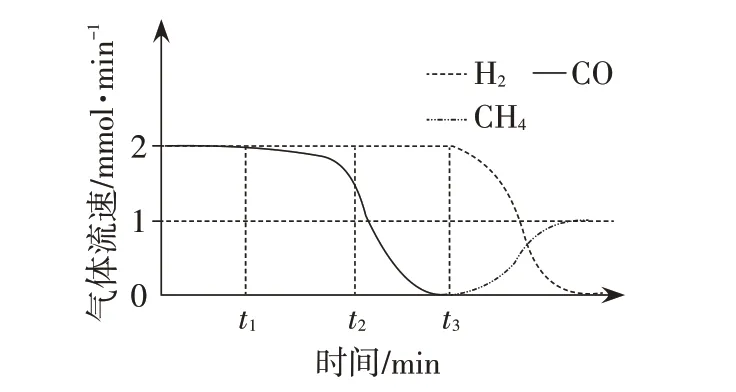
圖4
A.反應①為CaO+CO2==CaCO3;反應②為CaCO3
B.t1-t3,n(H2)比n(CO)多,且生成H2的速率不變,推測有副反應
C.t2時刻,副反應生成H2的速率大于反應②生成H2的速率
D.t3之后,生成CO 的速率為0,是因為反應②不再發生
2.試題解析
t2時刻,反應②生成H2的速率即為生成CO 的速率,圖4 中H2總流速與CO 流速的差值即為副反應的速率,由t2時刻的縱坐標可知副反應生成H2的速率小于反應②生成H2的速率。C選項不正確。
t3之后,生成CO 的速率為0,推測反應②不再發生。D選項正確。
3.教學啟示
本題通過分析單位時間流出氣體各組分的物質的量隨反應時間的變化,推測反應體系中存在的副反應、主反應與副反應在不同時段的主次關系、反應的進程等,均是基于宏觀可“觀測”到的實驗現象,充分體現了對宏觀辨識與微觀探析、證據推理與模型認知化學學科核心素養的考查。隨著時代的進步,化學反應的“現象”已遠不限于通過感官可以觀察到的顏色、氣味、狀態等的變化,更多的是借助現代化的儀器和設備來表征的實驗“現象”,比如用pH計監測反應過程中溶液酸堿度的變化,用電導率測定溶液中離子濃度的變化等,時代的進步為化學學科認識微觀世界插上了技術的翅膀。
實驗是化學學科認識世界的基本方法,是化學學習的重要手段。如何以實驗為載體推動中學化學的課程建設,如何發揮實驗的育人功能值得深入挖掘。現以必修1課程標準中要求的“配制一定物質的量濃度的溶液”實驗為例(見表3),可以通過引入紫外可見分光光度計、色度計等儀器,定量表征配制溶液濃度的實驗結果。

表3 必修1“配制一定物質的量濃度的溶液”實驗改進
“配制一定物質的量濃度的溶液”實驗,以前學生做就是照方抓藥,改進后將溶質由氯化鈉換成了硫酸銅,借助紫外可見分光光度計或色度計來定量測定溶液的濃度,這樣不但可以直接評價濃度配制的結果,比較結果偏差的相對大小,促進學生理解實驗過程、規范實驗操作,還可以基于實驗結果關聯實驗過程做出誤差分析,培養科學的學習態度。在學習評價中引入了兩人以及全班的合作,旨在培養學生的合作精神和責任意識。配制一定物質的量濃度的溶液以實驗為載體,借助現代化儀器,以定量評價為手段,既用定量的結果推動了高質量學習的發生,又促成了育人功能的實際落實。
結合高考試題,圖像呈現的是氣體流速的變化,依據數據的變化對反應做出假設或判斷,再通過證據推理來揭示物質間的化學變化,試題呈現基于學科核心素養的考查,借助技術手段使得化學反應“可視化”。隨著技術日新月異地發展,基于圖像、圖表、數據等對化學反應做出分析和判斷已成為時代對化學學習的要求,因此需要在化學學習中努力挖掘實驗的功能,進一步促進學習的認識和發展,切實發揮化學實驗的學習功能和育人功能,讓實驗真正成為培養社會主義接班人的學科路徑。
四、融合學科本質價值、學科育人價值和學科社會價值進行學習建構
1.原題呈現
2022年第18題(節選):
白云石的主要化學成分為CaMg(CO3)2,還含有質量分數約為2.1 %的Fe2O3和1.0 %的SiO2。利用白云石制備高純度的碳酸鈣和氧化鎂,流程示意圖如下。
已知:
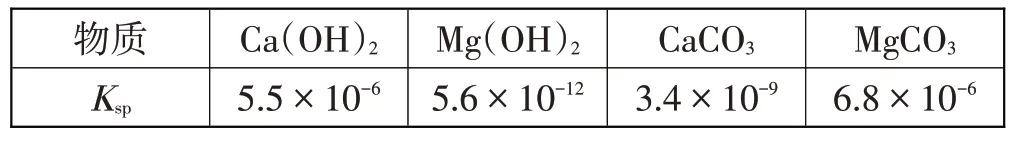
物質Ksp Ca(OH)2 5.5×10-6 Mg(OH)2 5.6×10-12 CaCO3 3.4×10-9 MgCO3 6.8×10-6
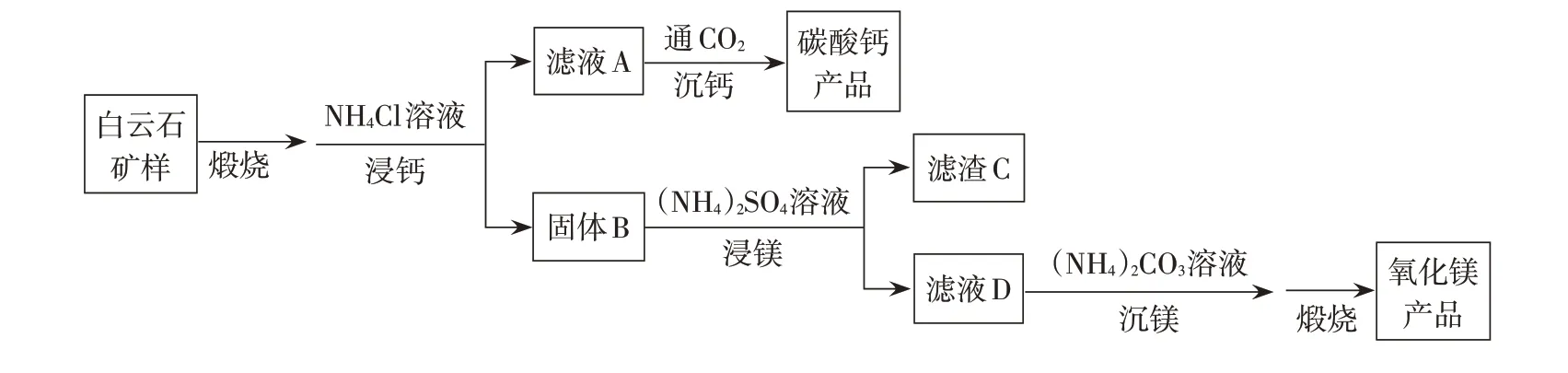
(1)白云石礦樣煅燒完全分解的化學方程式為________________________________________。
(2)NH4Cl用量對碳酸鈣產品的影響如下表所示。
①解釋“浸鈣”過程中主要浸出CaO的原因。
②沉鈣反應的離子方程式為______________。
③“浸鈣”過程不適宜選用n(NH4Cl):n(CaO)的比例為_________。
④產品中CaCO3純度的實測值高于計算值的原因是_______________________________________。
(3)“浸鎂”過程中,取固體B與一定濃度的(NH4)2SO4溶液混合,充分反應后MgO 的浸出率低于60%。加熱蒸餾,MgO 的浸出率隨餾出液體積增大而增大,最終可達98.9%。從化學平衡的角度解釋浸出率增大的原因是_____________________________________。
(4)濾渣C中含有的物質是_________________。
(5)該流程中可循環利用的物質是___________。
2.試題解析
首先,白云石礦樣煅燒完全分解化學方程式的書寫,一種方法是關聯CaCO3高溫分解生成CaO 和CO2的反應,利用Ca、Mg均為IIA族元素性質相似的特點,判斷MgCO3高溫分解生成MgO 和CO2;另一種方法是關聯(2)中NH4Cl溶液浸出的是氧化物MO,判斷出煅燒產物為CaO、MgO,再根據元素守恒判斷出第3種產物為CO2,寫出煅燒反應方程式
其次,浸鈣過程涉及反應i.CaO+H2O==Ca(OH)2、ii.Ca(OH)2+2NH4Cl==CaCl2+2NH3+2H2O,反應i 與反應ii 相加為浸鈣的總反應iii:CaO+2NH4Cl==CaCl2+2NH3+H2O。同理,浸鎂的總反應為iv:MgO+2NH4Cl==MgCl2+2NH3+H2O。根據反應的物質的量之比,理論上浸鈣所需的n(NH4Cl)/n(CaO)=2∶1,浸鎂所需的n(NH4Cl)/n(MgO)=2∶1。
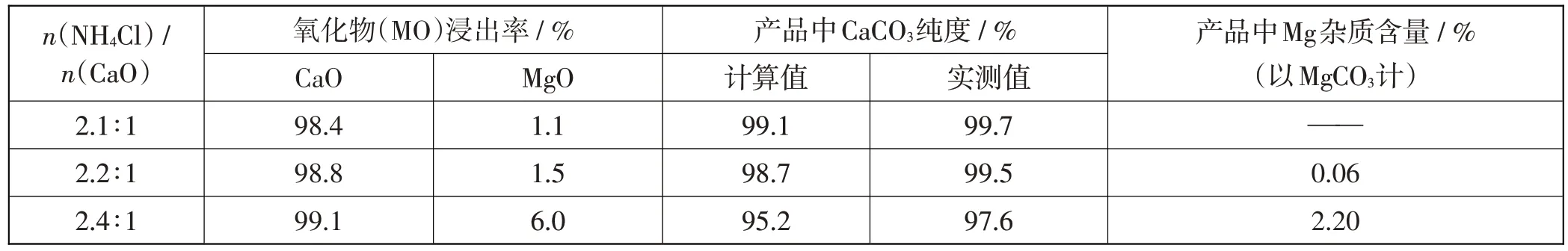
備注:i.MO浸出率=(浸出的MO質量/煅燒得到的MO質量)×100%(M代表Ca或Mg)ii.CaCO3純度計算值為濾液A中鈣、鎂全部以碳酸鹽形式沉淀時計算出的產品中CaCO3純度。
解釋“浸鈣”過程中主要浸出CaO的原因,需要關聯CaO、MgO 對應的Ca(OH)2、Mg(OH)2,二者均為二元堿,且Ksp[Ca(OH)2]?Ksp[Mg(OH)2],因此易溶于水的堿先反應,即CaO先浸出。
據煅燒產物n(CaO)∶n(MgO)=1∶1,若要將CaO、MgO 全部浸出,需n(NH4Cl)/n(CaO)=4∶1。解讀表中前3 列數據,第1 列為n(NH4Cl)/n(CaO),其比值分別是2.1∶1、2.2∶1、2.4∶1,n(NH4Cl)的用量僅比CaO 需要的多一點兒,哪一組銨鹽的用量也不能把鈣鹽和鎂鹽全部浸出。
由第2列和第3列的數據可以看出,隨著n(NH4Cl)/n(CaO)的增加,一是CaO 和MgO 的浸出率均有升高,即二者的浸出存在競爭;二是當n(NH4Cl)/n(CaO)升至2.4∶1時,浸出率的提升MgO明顯高于CaO,對于浸出CaO來說會引入更多的Mg2+雜質,因此控制n(NH4Cl)/n(CaO)的用量<2.4∶1,可以使浸鈣的主要浸出物為CaO,從而實現鈣鎂分離。
第三,沉鈣是向濾液A 中通入CO2。關聯浸鈣反應iii:CaO+2NH4Cl==CaCl2+2NH3+H2O,若向CaCl2溶液中直接通入CO2氣體,CaCl2+H2O+CO2←CaCO3+2HCl,反應環境為酸性,無法生成CaCO3沉淀,判斷是浸鈣生成的NH3調節了沉鈣反應的酸堿性,保證沉鈣是在堿性條件下進行,因此沉鈣的離子反應為Ca2++,直到NH3消耗完為止;同理,沉鎂的離子反應為沉鈣、沉鎂的反應關聯浸鈣、浸鎂的反應(CaO+2NH4Cl == CaCl2+2NH3+H2O、MgO+2NH4Cl ==MgCl2+2NH3+H2O)發現,沉鈣、沉鎂提供的NH3全部來源于浸鈣、浸鎂產生的NH3,即通入的CO2氣體最多將浸出的Ca2+、Mg2+全部沉淀。
沉鈣產品的純度分析,表格中第4-6 列數據,一是CaCO3純度的實測值高于計算值,二是第3 行數據即使有6%的MgO浸出時,產品中Mg雜質的含量仍然非常少,才只有2.2%。關聯信息Ksp(CaCO3)=3.4×10-9、Ksp(MgCO3)=6.8×10-6,發現Ksp(CaCO3)<Ksp(MgCO3),得知沉鈣過程中CaCO3首先析出。通入CO2的過程由于NH3極易揮發,還會帶走一部分NH3,則剩余NH3的量已不足以保證MgCO3析出的反應環境。
第四,浸鎂的反應原理與浸鈣的類似,具體反應為i.MgO+H2O==Mg(OH)2,ii.Mg(OH)2+(NH4)2SO4==MgSO4+2NH3+2H2O。浸出率在加熱蒸餾之后出現明顯變化,說明低于60%的時候,浸鎂的過程已經達到了反應的限度,即化學平衡狀態,說明浸鎂的反應是一個可逆反應
在加熱蒸餾的過程中,NH3極易揮發先從反應體系中逸出,水蒸氣也會逸出,隨著餾出液體積增多則NH3的逸出會更多,反應體系中c(NH3)不斷降低,上述平衡正向移動,MgO的浸出率增大。
第五,分析濾渣C中含有的物質。一是白云石礦樣中的Fe2O3和SiO2均不溶于銨鹽,因此留在濾渣中。二是MgO 的浸出率最終達98.9%,說明還有1.1%的MgO 并未完全浸出,濾渣中還會有Mg(OH)2(MgO)。三是浸鈣過程中鈣有殘留,以n(NH4Cl)/n(CaO)=2.2∶1的一組數據為例,還有1.2%的CaO 進入浸鎂的過程;浸鎂選用(NH4)2SO4代替NH4Cl 作為銨鹽,陰離子為,而CaSO4微溶,只有在浸鎂過程中以CaSO4沉淀的形式分離出鈣,才能保證獲得高純度的鎂,故濾渣C中含有CaSO4。
第六,分析該過程中可循環使用的物質。一是要區別“循環使用”和“回收利用”。循環使用指的是階段反應的產物能回到流程中再次使用,形成一個“循環”;回收利用指的是產物還能被回收利用,不一定回到流程中形成循環,回收他用也可。
綜上所述,該過程中可循環使用的物質分別為NH4Cl、(NH4)2SO4、NH3、CO2。
3.教學啟示
首先,教學中應著重基于學科本質價值進行學習建構。
本題以工業生產煅燒白云石制備高純度的碳酸鈣和氧化鎂為載體,借助高中化學常見元素化合物之間的反應,在對沉淀溶解平衡、鹽類水解平衡、弱電解質電離平衡等基礎性內容考查的同時,兼顧了解決實際問題的能力考查。
在數據的解讀和分析過程中,幫助學生理解化學科學在該工藝中創造性地多次運用了化學平衡思想來解決實際問題:
①控制n(NH4Cl)/n(CaO)比值,使得“浸鈣”過程中主要浸出的是CaO;
②沉鈣過程充分利用浸鈣所得的NH3來調節沉鈣溶液的酸堿性,又利用NH3具有揮發性,使得沉鈣既有利于鈣的沉降,又減少鎂的沉降;
③浸鎂過程采用蒸餾的方法,水蒸出反應體系,c(Mg2+)升高,抑制浸鎂,c(NH)降低緩慢,有利于浸鎂,工藝上充分利用NH3易揮發的特點隨著水蒸出反應體系,大大降低了反應體系中c(NH3)的濃度,拉動浸鎂的平衡正向移動,MgO的浸出率最終高達98.9%;
該工藝浸鈣、浸鎂與沉鈣、沉鎂的反應原理雖然類似,但根據工藝目標,通過對反應條件及反應限度的不同調控,完美實現了物質的制備和分離,是學科本質價值的高階體現。
教學中需要沿著化學科學認識世界、改造世界和創造世界的學習路徑來進行建構,促成學生在真實問題解決的過程中充分運用理解與辨析能力、分析與推測能力、歸納與論證能力、探究與創新能力,不斷感受化學科學的魅力和奇妙,認識化學科學對資源開發與利用,人類進步和發展的貢獻,從而實現化學教育教學的學科本質價值。
其次,教學中應著重挖掘基于學科育人價值和社會價值進行學習建構。
本題所涉及的元素化合物全部是高中常見的、熟悉的元素化合物,所涉及的反應原理均為水溶液平衡的主干內容,綜合考查學生對流程、數據和信息的接受、吸收、整合和加工的能力,以及用化學學科用語分析和表達能力。引導中學教學重視基本反應規律和化學反應原理的實際應用,培養學生關注反應體系在反應過程中的變化,反應環境對反應先后順序和反應競爭的影響,能夠辯證地看待變化,有序、有角度地調用學科思維思考問題,切實落實宏觀辨識與微觀探析、變化觀念與平衡思想、證據推理與模型認知、科學態度與社會責任等化學學科核心素養,充分理解并落實教學是通過學習來進行人才培養的過程。
本題涉及的化學工藝,處處體現綠色化學的理念。化學工藝中每一步試劑的選取都是既實現該步驟的目標,又兼顧整個工藝流程中物質的循環利用;從物質利用和資源節約的角度最大限度地提升原子利用效率。引導中學教學重視理解化學在解決生產、生活問題中的社會價值,體會化學科學在資源開發與利用、保護生態環境等問題上發揮的重要作用,樹立學生的化學環保意識和社會責任感,體會化學學習的責任擔當,努力成為一名真正的自然科學的學習者和社會責任的篤行者。
現以侯德榜制堿法為例,談談從學科本質價值、育人價值和社會價值來進行學習建構。侯德榜制堿法的工藝流程圖如圖5(魯科版教材圖)[3]所示。
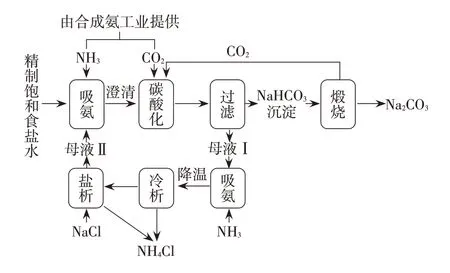
圖5 侯德榜制堿法工藝流程圖
(1)基于反應原理認識學科本質價值(表4)。

表4 基于反應原理認識學科本質價值
(2)基于制堿研制歷程發掘學科育人價值和社會價值。
侯德榜先生制堿研制的主要歷程和時代背景如圖6所示[5]。

圖6 侯德榜先生制堿研制的主要歷程和時代背景
侯氏制堿法通過循環使用母液,使得食鹽的利用率從原來的72%~74%提高到98%;省去了原料石灰石的使用、石灰窯和蒸氨等設備,消除了索爾維制堿法廢渣堆積、廢液污染等潛在資源隱患;聯合合成氨工業不但充分利用了其副產品CO2,而且生產出相當產量的氯化銨來作為氮肥,節約了合成氨工業制硫酸銨所使用的硫酸;所得的產品純堿純度達98.5%以上,氯化銨純度達99%以上。
侯德榜和范旭東先生能夠帶領團隊,不受時局所限,克服重重困難,因地制宜地不斷進行技術創新,巧妙地多次運用化學平衡思想,通過物質的加入順序和反應條件的調控,不但充分利用了物質資源,而且實現了工藝的連續生產,其研究成果不但為社會主義建設做出了貢獻,更以跨越國界的科學精神與世界分享技術成果,為世界的化工發展作出了巨大的貢獻。
白云石制備高純度碳酸鈣和氧化鎂的試題在化學平衡思想的創造性應用、物質資源的利用等多個方面與侯德榜制堿法有異曲同工之妙,化學學習只有基于學科的社會需求,才能體現學科學習的價值,而當學習服務于社會需求時,才是真正實現了學科的育人價值,基于學科本質的學習才真正有了意義。
綜上所述,以2022年北京等級考化學卷的部分試題分析為例,探索日常的化學教育教學路徑,一是明確學科學習為人才培養服務,只有堅持以立德樹人作為教學的根本任務,才能培養出為國家、為社會服務的人才;二是學科學習幫助學生建構的是認識世界、改造世界、創造世界的學科角度和方法,是可以脫離開知識,可以進行遠遷移的學科能力、學科思維和學科素養,因此教學中應著力基于學科本質建構高中三年的學習內容,讓每一課都為學生的終身發展打好學科基礎;三是學科學習要注意挖掘化學實驗的功能,化學實驗作為學科學習的重要載體和手段,要賦予學科核心素養的涵義,要結合時代發展的技術手段,讓化學實驗為化學學習插上翅膀;四是學科學習一定要融合學科本質價值、學科育人價值和學科社會價值進行建構,以真實問題為載體,幫助學生體會化學學習的責任和擔當,使化學課不但是科學課,更成為人生成長的必修課。

