蝴蝶蘭建蘭花葉病毒和齒蘭環斑病毒的實時熒光定量PCR檢測
宋起萱 浦艷飛 余蓉培 瞿素萍 楊春梅 吳麗芳 汪國鮮 阮繼偉


摘要:建蘭花葉病毒(Cymbidium mosaic virus,簡稱CymMV)和齒蘭環斑病毒(Odontoglossum ringspot virus,簡稱ORSV)是蝴蝶蘭生產中的主要病毒病害,建立穩定、靈敏的檢測體系是進行病毒早期檢測和脫毒技術研究的前提。本研究首先對CymMV和ORSV 的外殼蛋白(coat protein,簡稱CP)基因片段進行克隆和序列比對,隨后設計特異性引物,分別構建2種病毒的RT-qPCR(real time quantitative PCR,簡稱RT-qPC)檢測體系,并對云南地區20份樣品進行檢測。研究結果顯示,CymMV和ORSV CP基因序列與其他地區分離物中這2種病毒的核苷酸序列相似性分別為97.92%~98.66%和99.12%~99.56%,其CP基因序列具有保守性。CymMV和ORSV在RT-qPCR體系中最低檢出濃度分別為30.9、35.0 copies/μL,靈敏度較RT-PCR(reverse transcription polymerase chain reaction,簡稱 RT-PCR)提高10倍。利用RT-qPCR體系對20份溫室樣品進行檢測,CymMV陽性率為100%,ORSV陽性率為90%,陽性率均高于RT-PCR檢測結果。本研究構建的CymMV和ORSV RT-qPCR檢測體系將為蝴蝶蘭病毒病早期監測和脫毒種苗的培育奠定基礎。
關鍵詞:蝴蝶蘭;建蘭花葉病毒;齒蘭環斑病毒;實時熒光定量PCR;病毒檢測
中圖分類號:S436.8+1 文獻標志碼:A
文章編號:1002-1302(2023)15-0021-08
基金項目:云南省重大科技專項計劃(編號:202102AE090052);云南大學專業學位研究生實踐創新基金(編號:ZC-22222419)。
作者簡介:宋起萱(1999—),女,四川攀枝花人,碩士研究生,研究方向為觀賞植物研究。E-mail:songqixuan0218@126.com。
通信作者:余蓉培,博士,副研究員,研究方向為觀賞植物研究,E-mail:yrongpei@126.com;瞿素萍,碩士,研究員,研究方向為花卉組培繁育,E-mail:qsp@yaas.org.cn。
蝴蝶蘭(Phalaenopsis spp.)是一種原產于熱帶亞熱帶地區的附生蘭科植物,形態高雅、花期較長,是世界重要的花卉種類之一[1-2]。商品銷售的蝴蝶蘭多采用組織培養方法繁殖,長期無性繁殖使得病毒積累嚴重。目前,能夠感染蘭花的病毒有50多種,其中,建蘭花葉病毒(Cymbidium mosaic virus,簡稱CymMV)和齒蘭環斑病毒(Odontoglossum ringspot virus,簡稱ORSV)是蘭花中感染較為嚴重和普遍的2種病毒[3-4]。蝴蝶蘭植株感染CymMV和ORSV后,葉片分別會出現黃色環斑和條紋花斑,花朵出現褪色,使觀賞價值極大降低,造成巨大經濟損失,嚴重制約了我國蝴蝶蘭產業的發展[5]。因此,亟待建立快速準確的CymMV和ORSV檢測體系,為蝴蝶蘭帶病毒植株的早期鑒定以及種苗脫毒體系的構建提供可靠的技術保障。
CymMV和ORSV是正義單鏈RNA病毒[(+)ssRNA][3]。CymMV隸屬于線形病毒科(Flexiviridae)馬鈴薯X病毒屬(Potexvirus),病毒粒體由外殼蛋白和正義單鏈RNA基因組組成,基因組全長6.3 kb,包含5個開放閱讀框(ORF),ORF5編碼24 ku外殼蛋白[6-8]。ORSV隸屬于煙草花葉病毒屬(Tobamovirus),直桿狀顆粒,病毒粒體分散在細胞質內呈晶格排列,基因組全長6 618 bp,具有5個ORF,ORF5編碼18 ku外殼蛋白[3,9-10]。
目前,CymMV和ORSV的檢測方法主要有電鏡法、血清學方法和分子生物學方法[11-12]。其中,分子生物學方法是從核酸水平來檢測病毒,可以進行大批量的樣品檢測,具有靈敏度高、特異性強、檢測速度快、操作簡便等優點[11]。實時熒光定量PCR(real time quantitative polymerase chain reaction,簡稱RT-qPCR)是分子生物學檢測法中一種高效、穩定、準確的檢測技術,它是在PCR反應體系中加入熒光基團,利用熒光信號積累實時監測整個PCR進程,最終通過標準曲線可對未知模板進行準確定量分析[13]。靈敏度是RT-PCR(reverse transcription polymerase chain reaction,簡稱RT-PCR)的10~1 000 倍[14-17]。該技術在蔬菜、花卉、果樹等園藝植物病毒檢測中有廣泛應用[18-21]。但目前對于蝴蝶蘭CymMV和ORSV的RT-qPCR檢測方法尚缺乏深入報道。
本研究分別對CymMV和ORSV外殼蛋白(coat protein,簡稱CP)編碼基因設計特異性引物,克隆CP基因片段序列,構建CymMV和ORSV質粒標準品,進而分別建立CymMV和ORSV的RT-qPCR檢測體系,并應用于云南溫室栽培蝴蝶蘭的CymMV和ORSV檢測。該體系將為蝴蝶蘭規模化生產中CymMV和ORSV準確高效檢測提供技術支撐。
1 材料與方法
1.1 植物材料
使用云南省農業科學研究院花卉研究所九溪基地保存的CymMV和ORSV感病植株作為植物材料,于2022年3月在云南省花卉育種重點實驗室進行CymMV和ORSV的外殼蛋白基因片段克隆。用于檢測的溫室植株亦種植于云南省農業科學院花卉研究所九溪基地。
1.2 總RNA提取與反轉錄
使用艾德萊生物的多糖多酚復雜植物RNA快速提取試劑盒進行蝴蝶蘭葉片總RNA提取。用ND2000-超微量紫外可見光分光光度計測定RNA濃度、D260 nm/280 nm,用1%瓊脂糖凝膠電泳檢測所提RNA的完整性。
使用PrimeScript IV 1st strand cDNA Synthesis Mix試劑盒(TaKaRa)對RNA進行反轉錄,在RNase Free管中加入2 μL模板RNA、2 μL Primescript IV cDNA synthesis Mix、6 μL ddH2O配制混合液。混合液在42 ℃孵育20 min后,70 ℃孵育15 min,得到cDNA溶液保存于-20 ℃冰箱中,可用于PCR和RT-qPCR。
1.3 CymMV和ORSV的CP基因片段克隆與序列分析
在NCBI上查找CymMV和ORSV的CP基因序列,使用NCBI的Primer-BLAST設計引物(表1),并由北京擎科生物科技有限公司進行引物合成。以感染CymMV和ORSV植株的cDNA為模板,使用諾唯贊Green Taq Mix試劑盒和表1中的引物對CP基因片段克隆。反應體系如下:0.5 μL模板cDNA,上、下游引物(10 μmol/L) 各0.5 μL,5 μL Green Taq Mix,3.5 μL ddH2O。反應條件為:95 ℃預變性3 min;95 ℃ 變性15 s,57 ℃退火15 s,72 ℃延伸 1 min,進行35個循環;最后 72 ℃延伸5 min。PCR產物用1%瓊脂糖凝膠電泳進行檢測。測序結果使用DNAMAN軟件進行序列分析。
1.4 質粒標準品制備
將CymMV和ORSV的CP基因片段克隆得到的PCR產物使用全式金公司的Easy Pure Quick Gel Extration Kit進行切膠回收并純化。將回收純化后的產物與pEASY-T3 Cloning Kit進行載體連接,隨后轉化到Trans1-T1 Phage Resistant感受態細胞中,37 ℃、200 r/min培養1 h后,將菌液均勻涂于含有50 mg/L氨芐青霉素LB平板上,37 ℃倒置培養12 h,隨后挑取單菌落于50 mg/L氨芐青霉素LB液體培養基中擴大培養。將得到的菌液進行PCR,產物用1%瓊脂糖凝膠電泳檢測鑒定,選取條帶明亮且正確的菌液送至北京擎科生物科技有限公司進行測序。
選擇測序結果正確的菌液,使用全式金公司Easy Pure Plasmid MiniPrep Kit分別提取質粒,并放置于-20 ℃保存,將其作為CymMV和ORSV質粒標準品使用。運用公式C=A×10-9×B-1×6.02×1023(A為質粒濃度,ng/μL;B為質粒DNA分子量;C為質粒標準品濃度,copies/μL;6.02×1023 為摩爾分子數)計算出CymMV和ORSV質粒標準品濃度分別為 3.09×1011、3.50×1011 copies/μL。
1.5 CymMV和ORSV實時熒光定量PCR檢測體系的構建
1.5.1 引物設計
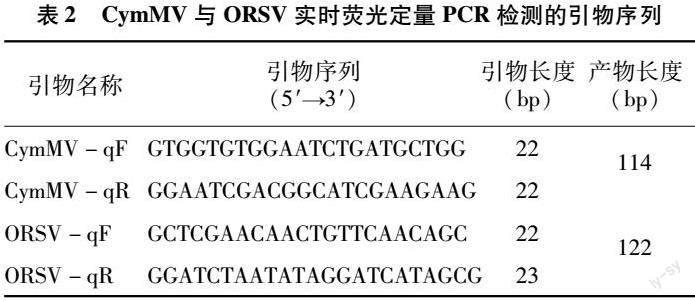
根據CymMV和ORSV的CP基因克隆片段測序結果,使用NCBI上的Primer-BLAST分別設計RT-qPCR引物(表2),引物由北京擎科生物科技有限公司進行合成。
1.5.2 RT-qPCR反應體系構建
采用TaKaRa公司的TB Green Premix Ex TaqTMⅡ(Tli RNaseH Plus)進行RT-qPCR,反應體系為:2.0 μL模板cDNA,上、下游引物各1.0 μL,12.5 μL TB Green Premix Ex TaqⅡ,8.5 μL ddH2O。反應條件為:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,40個循環;95 ℃ 10 s。熔解曲線分析溫度范圍為65~95 ℃。反應在CF-X96熒光定量PCR儀上進行。
1.5.3 建立標準曲線
將 CymMV與ORSV質粒標準品用TaKaRa的EASY Dilution稀釋液按10倍梯度逐級稀釋,形成終濃度為105~109 copies/μL的5個梯度,分別進行RT-qPCR反應,每個濃度梯度設置3次重復,并根據結果計算得到標準曲線。
1.5.4 靈敏度檢測
按10倍梯度對 CymMV與ORSV質粒標準品進行稀釋,終濃度分別為3.09×100~3.09×109 copies/μL和3.50×100~3.50×109 copies/μL,隨后以稀釋后各梯度質粒標準品為模板,分別對2種病毒進行RT-PCR和 RT-qPCR檢測,比較2種方法的靈敏度。RT-PCR檢測所用的引物和反應體系參照“1.3”節中CymMV和ORSV的CP基因片段克隆方法。
1.6 溫室樣品檢測
對種植于云南省農業科學院花卉研究所九溪基地的LL29、初戀、大辣椒和藍寶石等4個蝴蝶蘭品種,每個品種5株,共20份樣品,分別提取葉片總RNA,采用RT-PCR和RT-qPCR體系進行CymMV和ORSV病毒檢測。
2 結果與分析
2.1 CymMV、ORSV的CP基因片段克隆及序列分析
本研究以感染CymMV和ORSV蝴蝶蘭植株的cDNA為模板,使用表1中引物分別對CymMV和ORSV的CP基因片段進行克隆,所使用的引物特異性較好,獲得了目的片段條帶(圖1)。經測序獲得 534 bp CymMV的CP基因片段序列,以及235 bp ORSV的CP基因片段序列。
利用DNAMAN軟件對克隆到的CymMV CP基因片段序列進行分析,結果(圖2)顯示,本研究CymMV的CP基因片段序列與已登錄的CymMV 的CP基因相應序列(GenBank:U62963.1)有12個核苷酸差異,1個氨基酸差異,核苷酸相似性為98.21%,氨基酸相似性為99.55%,表明克隆出的目的條帶正確。與其他地區分離物中CymMV的CP基因(巴西GenBank:KX960737.1;河南GenBank:KU873000;云南GenBank:AM055640.2;西藏GenBank:KP137368.1)進行比對分析, 結果顯示,本研究CymMV CP基因片段序列與上述地區分離物中CymMV CP基因序列核苷酸相似性為97.92%~98.66%,氨基酸相似性為95.52%~99.55%,表明來自不同地區分離物中的CymMV CP基因序列存在保守性。
本研究克隆獲得的ORSV CP基因片段序列與已登錄的ORSV的CP基因相應序列(GenBank:AJ606105.1)有7個核苷酸差異,5個氨基酸差異,核苷酸相似性為98.53%,氨基酸相似性為96.84%,表明克隆出的目的條帶正確(圖3)。與廣州(GenBank:KF836079.1)、印度(GenBank:MN027919.1)、貴州(GenBank:KF225471.1)、臺灣(GenBank:AF455274.1)等其他地區分離物中的ORSV CP基因相應序列的核苷酸相似性為99.12%~99.56%,氨基酸相似性為98.73%~99.37%,表明來自不同地區分離物中的ORSV CP基因序列存在保守性。
2.2 RT-qPCR標準曲線的建立
本研究首先對RT-qPCR引物特異性進行分析,結果表明,表1中引物用于蝴蝶蘭CymMV和ORSV CP基因序列RT-qPCR檢測時,熔解曲線為單一峰,引物特異性較好(圖4-A、圖4-B)。
質粒標準品以10倍梯度逐級稀釋后,CymMV選取3.09×105~3.09×109 copies/μL等5個濃度的質粒標準品為模板,ORSV選取3.50×105~3.50×109 copies/μL等5個濃度的質粒標準品為模板,分別建立RT-qPCR標準曲線。結果表明,2種病毒質粒模板濃度的對數值與循環定量(Cq)值呈現良好的線性關系,CymMV的標準曲線為y=-3.459x+43.98,r2=0.999,擴增效率(E)為94.6%(圖5-A);ORSV的標準曲線為y=-3.427x+48.42,r2=0.984 1,擴增效率為95.8%(圖5-B),其中,y均為Cq值,x為模板濃度(C)的對數值(lgC=x)。該標準曲線可用于后期病毒濃度的計算。
2.3 RT-qPCR和RT-PCR靈敏度的比較
將母液濃度為3.09×1011 copies/μL的CymMV質粒標準品和3.50×1011 copies/μL的ORSV質粒標準品分別按10倍等比稀釋,以終濃度為3.09×100~3.09×109 copies/μL的CymMV質粒標準品和3.50×100~3.50×109 copies/μL的ORSV質粒標準品為模板,進行實時熒光定量PCR檢測和普通RT-PCR檢測。[JP+1]結果如圖6、 圖7所示, RT-PCR能檢測出的CymMV和ORSV最低濃度分別為 3.09×102、3.50×102 copies/μL;RT-qPCR能檢測出的CymMV和ORSV最低濃度分別為3.09×10、3.50×10 copies/μL。實時熒光定量PCR比普通PCR檢測的靈敏度提高10倍。
2.4 蝴蝶蘭溫室栽培植株CymMV及ORSV檢測
同時采用RT-PCR和RT-qPCR 2種方法對LL29、初戀、大辣椒和藍寶石等4個蝴蝶蘭品種進行CymMV與ORSV檢測,檢測結果如表3所示,2種檢測方法對病毒檢測的靈敏度存在差異。對20份樣本的RT-PCR結果顯示,15份樣品攜帶CymMV,6份樣品攜帶ORSV,陽性率分別為75%和30%。RT-qPCR結果則顯示,20份樣品均攜帶CymMV,陽性率為100%,病毒含量在3.75×101~1.47×1011 copies/μL之間;18份樣品攜帶ORSV,陽性率為90%,病毒含量在9.79×102~8.16×108 copies/μL 之間,藍寶石中有2株不攜帶OSRV。總體上看,RT-qPCR檢測的靈敏性更高。
盡管溫室栽培的蝴蝶蘭樣品普遍攜帶CymMV與ORSV,但是從病毒拷貝數來看,不同的品種攜帶病毒的情況不同,大辣椒和藍寶石攜帶CymMV與ORSV的情況較輕,而初戀攜帶病毒的情況較為嚴重,且CymMV和ORSV復合感染的情況較為嚴重。
3 討論與結論
本研究從蝴蝶蘭感病植株中克隆得到CymMV和ORSV的CP基因片段。測序后將所得CymMV CP基因序列與其他地區CymMV分離物CP基因序列進行比對,得到核苷酸序列與氨基酸序列相似性分別為97.92%~98.66%和95.52%~99.55%。與此相似,CymMV廣東分離物與30個其他地區的CymMV分離物比對,核苷酸序列與氨基酸序列相似性分別為89.73%~98.66%和97.31%~100.00%[22]。Rao等通過多序列比較,發現89個CymMV CP序列核苷酸與氨基酸相似性分別為84.6%~100.00%和89.5%~100.00%[23],本研究結果與之相似。本研究中ORSV CP基因片段測序后與其他地區ORSV分離物序列進行對比,得到核苷酸序列與氨基酸序列相似性分別為99.12%~99.56%和98.73%~99.37%。與此相似,ORSV廣東分離物與37個其他地區的ORSV分離物比對,核苷酸序列與氨基酸序列相似性分別為96.65%~100.00%和93.67%~100.00%[22]。吳偉文等所得ORSV江蘇分離物與141個其他地區ORSV分離物CP基因核苷酸序列相似性在94%以上[24],本研究結果與之相似。由此可見,CymMV和ORSV的CP基因核苷酸序列及編碼蛋白氨基酸序列在來自不同地區的分離物間存在保守性,這2種病毒的CP基因片段可作為模板,構建穩定的病毒檢測體系,用于檢測不同地區的蝴蝶蘭植株。
靈敏度是影響病毒早期診斷的關鍵因素[25]。本研究構建的RT-qPCR檢測體系能檢測出CymMV和ORSV的最低濃度分別為3.09×10、3.50×10 copies/μL。與此相似,溧芳等在使用 RT-qPCR 對河南蝴蝶蘭的檢測中,可檢測出CymMV最低濃度為2.66×10 copies/μL[26]。宋蒙等在百合中使用RT-qPCR檢測車前草花葉病毒(Plantago asiatica mosaic virus,簡稱PlAMV),可檢出最低濃度為 1.3×10 copies/μL[27],本研究結果與之類似,檢測下限均處于10 copies/μL數量級。然而,Eun等以Taq Man探針為檢測體系中的熒光指示劑,使用RT-qPCR對蘭科植物中CymMV和ORSV進行檢測,可檢測出CymMV和ORSV最低為104 copies[28],本研究結果與之存在差異,這可能是檢測體系中所用熒光指示劑不同導致的。在本研究中,RT-qPCR對CymMV和ORSV檢測的靈敏性較RT-PCR提高10倍,這與使用RT-PCR和 RT-qPCR 檢測西瓜種子中黃瓜綠斑駁花葉病毒(cucumber green mottle mosaic virus,CGMMV)的靈敏度比較結果[14]相同。然而,使用RT-qPCR對百合中PlAMV檢測靈敏度較RT-PCR高100倍[27],靈敏性略高于本研究,這可能是因為本研究的RT-PCR擴增效率較高。
CymMV和ORSV是蘭科植物病毒中危害最嚴重的2種病毒,且二者經常復合侵染蘭科植物[29-30]。本研究對20份云南地區溫室栽培的蝴蝶蘭樣品進行檢測,CymMV陽性率為100%,ORSV陽性率為90%,2種病毒復合感染陽性率為90%,蝴蝶蘭攜帶病毒較多,復合感染的情況較為普遍。與此相似,柳愛春等采用酶聯免疫吸附劑測定(ELISA)檢測法對浙江地區蝴蝶蘭進行檢測,CymMV陽性率為70%,ORSV病毒陽性率為60%,2種病毒復合感染率為56.7%,表明這2種病毒對浙江省蝴蝶蘭侵染率較高[31]。與本研究不同,謝林娜等采用ELISA檢測法對來自廣東、江蘇省大型蝴蝶蘭生產基地的45個蝴蝶蘭樣品進行檢測發現CymMV陽性率為20.0%,ORSV病毒陽性率為71.1%,2種病毒復合感染陽性率為17.8%[32]。周國輝等采用雙重RT-PCR對廣東順德153份蘭花樣品進行檢測,CymMV陽性率為49.7%,ORSV病毒陽性率為34.0%,2種病毒復合感染率為1.3%[33]。本研究結果與上述研究存在差異,這可能與不同地區蝴蝶蘭品種和栽培環境差異以及檢測方法靈敏度不同有關。
綜上所述,蝴蝶蘭受CymMV和ORSV危害較為普遍,未來需進一步開展種苗脫毒技術研究以此推動蝴蝶蘭產業健康發展。
參考文獻:
[1]梁 芳,鄧祖麗穎,許申平,等. 蝴蝶蘭2種病毒的同步檢測及其CP融合反義表達載體構建[J]. 西南農業學報,2018,31(8):1622-1627.
[2]Chien K W,Agrawal D C,Tsay H S,et al. Elimination of mixed ‘Odontoglossum ringspot and ‘Cymbidium mosaic viruses from Phalaenopsis hybrid ‘V3 through shoot-tip culture and protocorm-like body selection[J]. Crop Protection,2015,67:1-6.
[3]Pai H,Jean W H,Lee Y S,et al. Genome-wide analysis of small RNAs from Odontoglossum ringspot virus and Cymbidium mosaic virus synergistically infecting Phalaenopsis[J]. Molecular Plant Pathology,2020,21(2):188-205.
[4]Lee C H,Zheng Y X,Jan F J. The orchid-infecting viruses found in the 21st century[M]//Orchid biotechnology Ⅲ. New Jersey:World Scientific,2017:145-164.
[5]Kim S M,Choi S H. Simultaneous detection of Cymbidium mosaic virus and Odontoglossum ringspot virus in orchids using multiplex RT-PCR[J]. Virus Genes,2015,51(3):417-422.
[6]Kondo H,Takemoto S,Maruyama K,et al. Cymbidium chlorotic mosaic virus,a new sobemovirus isolated from a spring orchid (Cymbidium goeringii) in Japan[J]. Archives of Virology,2015,160(8):2099-2104.
[7]Wong S M,Mahtani P H,Lee K C,et al. Cymbidium mosaic potexvirus RNA:complete nucleotide sequence and phylogenetic analysis[J]. Archives of Virology,1997,142(2):383-391.
[8]Voinnet O,Lederer C,Baulcombe D C. A viral movement protein prevents spread of the gene silencing signal in Nicotiana benthamiana[J]. Cell,2000,103(1):157-167.
[9]明艷林,鄭國華. 齒蘭環斑病毒的研究進展[C]//陳海如.第三次全國植物病毒和病毒防治學術研討會論文集. 云南昆明:中國植物病理學會,2003:158-162.
[10]Ryu K H,Park W M. Nucleotide sequence analysis of a cDNA clone encoding the 34K movement protein gene of odontoglossum ringspot virus,ORSV-Cy,the Korean isolate[J]. Plant Molecular Biology,1994,26(3):995-999.
[11]劉沛然,王四清. 建蘭花葉病毒及齒蘭環斑病毒的檢測方法[J]. 熱帶作物學報,2009,30(1):99-103.
[12]涂小云,董小艷,郭春梅,等. 多重RT-PCR檢測蝴蝶蘭3種病毒CymMV、ORSV和CMV[J]. 江蘇農業科學,2017,45(5):91-93.
[13]Yin J L,Shackel N A,Zekry A,et al. Real-time reverse transcriptase-polymerase chain reaction (RT-PCR) for measurement of cytokine and growth factor mRNA expression with fluorogenic probes or SYBR Green I[J]. Immunology and Cell Biology,2001,79(3):213-221.
[14]劉 美,王毓洪,彭 斌,等. 黃瓜綠斑駁花葉病毒實時熒光定量PCR檢測體系的建立[J]. 植物保護學報,2022,49(4):1063-1070.
[15]王艷嬌,崔甜甜,黃愛軍,等. 柑橘脈突病毒實時熒光定量RT-PCR檢測體系的建立與應用[J]. 園藝學報,2016,43(8):1613-1620.
[16]王 麗,王振東,喬 奇,等. 甘薯褪綠矮化病毒西非株系實時熒光定量PCR檢測方法的建立及應用[J]. 植物病理學報,2014,44(5):461-468.
[17]高艷玲,范國權,程勝群,等. 苜蓿花葉病毒RT-PCR和RT-qPCR檢測技術體系的建立與應用[J]. 植物保護學報,2022,49(2):515-527.
[18]Al Rwahnih M,Osman F,Sudarshana M,et al. Detection of Grapevine leafroll-associated virus 7 using real time qRT-PCR and conventional RT-PCR[J]. Journal of Virological Methods,2012,179(2):383-389.
[19]Shabrangy A,Roustan V,Reipert S,et al. Using RT-qPCR,proteomics,and microscopy to unravel the spatio-temporal expression and subcellular localization of hordoindolines across development in barley endosperm[J]. Frontiers in Plant Science,2018,9:775.
[20]Elmahdy E M,Shaheen M N F,Mahmoud L H I,et al. Detection of norovirus and hepatitis a virus in strawberry and green leafy vegetables by using RT-qPCR in Egypt[J]. Food and Environmental Virology,2022,14(2):178-189.
[21]Vazquez-Iglesias I,McGreig S,Pufal H,et al. A novel high-throughput sequencing approach reveals the presence of a new virus infecting Rosa:rosa ilarvirus-1 (RIV-1)[J]. Journal of Virological Methods,2022,300:114417.
[22]任 銳,魏永路,朱根發,等. 廣東省國蘭病毒病害調查及CymMV和ORSV基于cp基因的系統進化分析[J]. 植物保護學報,2020,47(2):372-383.
[23]Rao X Q,Li Y,Sun J,et al. Genetic diversities of Cymbidium mosaic virus and Odontoglossum ringspot virus isolates based on the coat protein genes from orchids in Guangdong Province,China[J]. Journal of Phytopathology,2015,163(4):324-329.
[24]吳偉文,賀 振,劉 嫻,等. 江蘇省建蘭齒蘭環斑病毒的鑒定和遺傳多樣性分析[J]. 植物保護學報,2019,46(4):745-753.
[25]Pallás V,Más P,Sánchez-Navarro J A. Detection of plant RNA viruses by nonisotopic dot-blot hybridization[M]//Foster G D,Taylor S C.Plant Virology Protocds. New Jersey:Humana Press,1998:461-468.
[26]梁 芳,張 燕,王若斕,等. 建蘭花葉病毒SYBR GreenⅠ實時熒光定量PCR檢測方法的建立[J]. 江西農業大學學報,2017,39(3):572-580.
[27]宋 蒙,徐雷鋒,曹雨薇,等. 百合中車前草花葉病毒的實時熒光定量PCR檢測[J]. 園藝學報,2021,48(12):2497-2505.
[28]Eun A J C,Seoh M L,Wong S M. Simultaneous quantitation of two orchid viruses by the TaqMan real-time RT-PCR[J]. Journal of Virological Methods,2000,87(1/2):151-160.
[29]Jensen D D. Virus diseases of orchids in the Netherlands[J]. Netherlands Journal of Plant Pathology,1970,76(3):135-139.
[30]Zettler F W,Ko N J,Wisler G C,et al. Viruses of orchids and their control[J]. Plant Disease,1990,74(9):621-626.
[31]柳愛春,劉 超,趙 蕓,等. 利用ELISA檢測兩種蘭花病毒的研究[J]. 浙江農業學報,2009,21(2):91-95.
[32]謝林娜,蘇夢蕓,朱明明,等. 不同品種蝴蝶蘭2種病毒的ELISA檢測及其癥狀表現[J]. 江蘇農業科學,2017,45(3):80-83.
[33]周國輝,陳曉琴,李梅輝,等. 廣東地區兩種蘭花病毒病害的分子鑒定及檢測[J]. 中國病毒學,2004,19(2)149-152.

