雌激素受體陽性HER2陰性乳腺癌新輔助化療反應的影響因素分析
馬金平,王海波,張 劍,方 圣,張家宏,王 騰,馬 源,張 勇
(1.煙臺市蓬萊人民醫院普外一科,山東 煙臺 265600;2.青島大學醫學院附屬醫院乳腺病診療中心,山東 青島 266000)
乳腺癌已經成為女性最常見的癌癥,與發達國家相比,中國確診的病人更多是晚期乳腺癌(advanced breast cancer,ABC)[1]。局部晚期乳腺癌(locally advanced breast cancer,LABC)傳統上是指不能手術的非轉移性局部晚期乳腺癌[2]。術前的全身治療已經成為LABC的標準治療方法,包括新輔助化療(neoadjuvant chemotherapy,NACT)、新輔助靶向治療和新輔助內分泌治療。新輔助治療能夠直接監測原發性乳腺癌的治療反應,評估藥物敏感性,預測預后;能夠降低腫瘤分期,使無法手術的乳腺癌可以手術切除,增加保乳的機會。其中,新輔助化療應用最為廣泛,在乳腺癌各個分型中均有應用。化療藥物已被證明可以改善乳腺癌的預后,尤其是含有蒽環類藥物和紫杉類藥物能夠最大限度降低風險,二者是乳腺癌的一線用藥。
雌激素受體(estrogen receptor,ER)陽性、人表皮生長因子受體-2(human epidermal growth factor receptor 2,HER2)陰性的乳腺癌約占所有乳腺癌的70%[3]。但這部分群體對NACT不太敏感,客觀應答率(objective response rate,ORR)約為65%,病理完全緩解率(pathological complete response rate,pCR)為5%~10%[4]。乳腺癌腫瘤生物學對新輔助化療反應有顯著影響,其中三陰性、HER2陽性型發生pCR遠高于ER+/HER2-乳腺癌,pCR已被證明是改善生存的重要標志[5]。相較于三陰性、HER2陽性型乳腺癌,ER+/HER2-乳腺癌生存期較長,但新輔助治療效果較差,而作為乳腺癌基數最龐大的群體,探尋其新輔助化療效果的影響因素,預測可能出現的效果,對于指導臨床治療策略的選擇有著重要意義。
1 資料與方法
1.1 研究對象
收集青島大學附屬醫院乳腺病診療中心2017年7月至2021年7月診治的ER陽性、HER2陰性的230例乳腺癌病例資料。均于乳腺病診療中心進行完整的診療過程。所有研究對象均知情同意自愿參與研究。
1.2 納入及排除標準
納入標準:女性;無其他惡性腫瘤病史;無遠處轉移;新輔助化療前均經空心針穿刺確診;浸潤性非特殊類型乳腺癌;患者臨床信息及病理信息完整;新輔助化療中,聯合化療方案優于單藥化療方案,同時含有蒽環類和紫杉類的方案完全緩解率最高,因此根據中國臨床腫瘤協會(The Chinese Society of Clinical Oncology,CSCO)指南,本文納入病例時選擇二者聯合或序貫方案為一線用藥;手術行乳房切除+腋窩淋巴結清掃。排除標準:妊娠期或哺乳期;有其他惡性腫瘤病史;遠處轉移;新輔助化療前無穿刺病理或不確定;特殊類型乳腺癌或原位癌;信息缺失或不確定;新輔助化療用藥非一線用藥;行保乳手術和/或前哨淋巴結活檢術。
1.3 收集數據及分組分級
收集患者年齡、體質量指數(body mass index,BMI)、初潮年齡、月經狀態、臨床腫瘤分期(clinical tumor staging,cT)、孕激素受體(progesterone receptor,PR)、HER2、Ki67的表達狀況。ER、PR陽性均指≥1%。HER2蛋白表達水平通過免疫組化(immunohistochemistry,IHC)原位雜交(in situ hybridization,ISH)進行評估[6]。HER2陰性分為三組:IHC0、IHC1+、IHC2+/ISH-。Ki67分組以30%作為臨界。化療方案選擇蒽環類序貫紫杉類(anthracycline sequential taxane,AC-T)、蒽環類聯合紫杉類(anthracycline combined with yaxane,TAC/TA)。NACT前淋巴結狀態分為未穿刺組、穿刺陰性組、穿刺陽性組。NACT后淋巴結狀態根據術后病理結果分組。
原發腫瘤新輔助化療反應按照 Miller-Payne(M-P)分級分為G1~G5,G1指浸潤癌細胞無改變或僅個別癌細胞發生改變,癌細胞數量總體未減少;G2指浸潤癌細胞輕度減少,但總數量仍高,癌細胞減少不超過30%;G3指浸潤癌細胞減少30%~90%;G4指浸潤癌細胞顯著減少超過90%,僅殘存散在的小簇狀癌細胞或單個癌細胞;G5指原腫瘤床部位已無浸潤癌細胞,但可存在導管原位癌。
1.4 統計學方法
采用SPSS 26.0軟件進行統計分析。計數資料用例數(n)和百分比(%)表示,組間比較采用χ2檢驗。單因素分析篩選出有意義的變量納入多因素二元Logistic回歸分析。P<0.05為差異具有統計學意義。
2 結果
2.1 研究對象臨床病理特征
本研究共收集230例ER陽性、HER2陰性的乳腺癌病例資料,其臨床病理特征見表1。
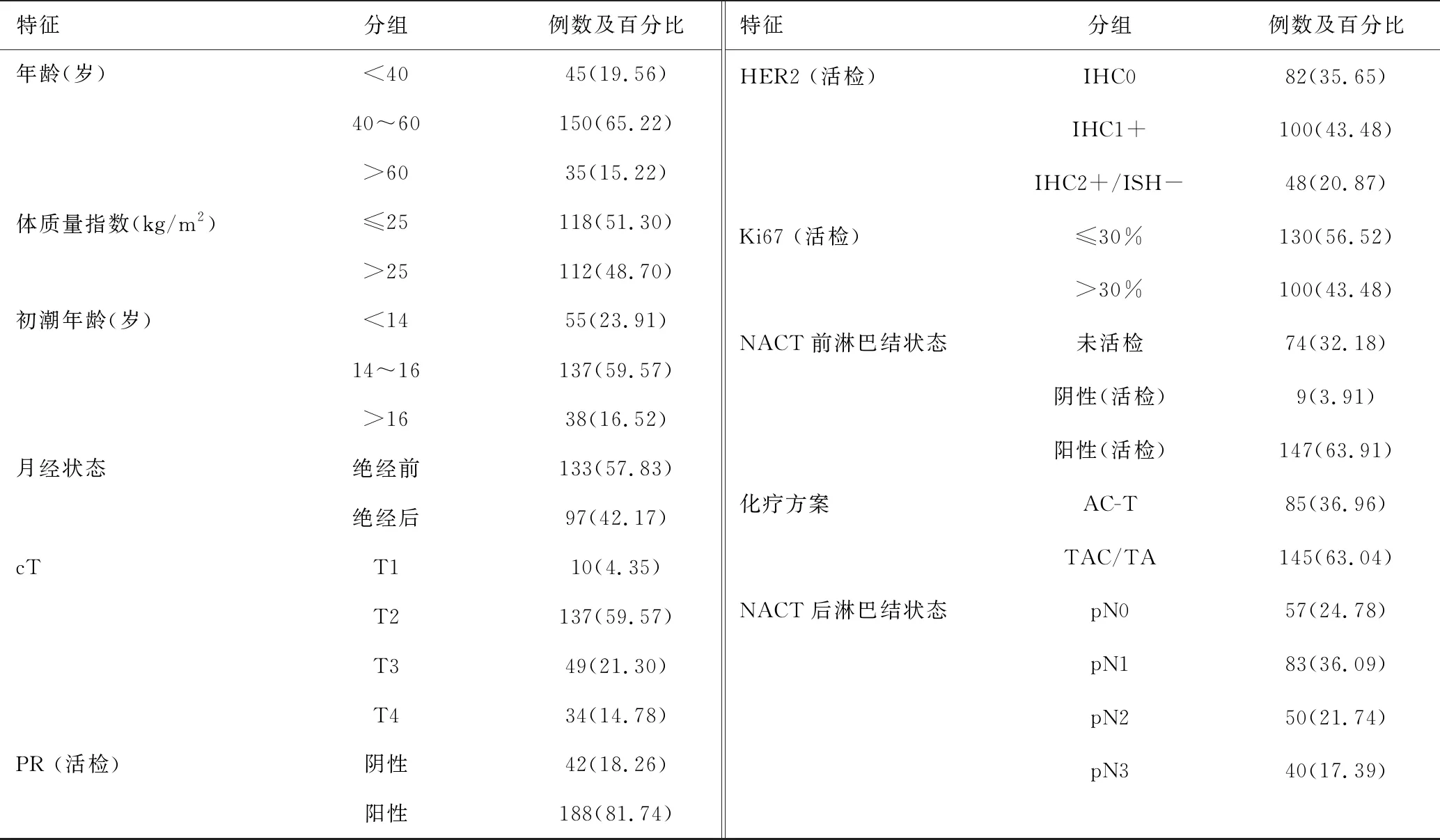
表1 患者臨床病理特征 [n(%)]
2.2 腫瘤新輔助化療反應單因素分析
原發腫瘤新輔助化療反應按照M-P分級,G1~G5例數分別為21例、61例、95例、22例、31例。年齡、BMI、初潮年齡、cT、HER2、NACT前淋巴結狀態與原發腫瘤新輔助化療反應分組差異無統計學意義(P>0.05);新輔助化療反應以G4~G5/G1~G3分組,G4~G5組絕經前緩解率高于絕經后、PR陰性緩解率高于PR陽性、Ki67>30%緩解率高于Ki67≤30%、蒽環類聯合紫杉類化療方案緩解率高于蒽環類序貫紫杉類、NACT后pN0緩解率高于pN+,差異均有統計學意義(χ2值介于5.434~35.852之間,P<0.05),見表2。
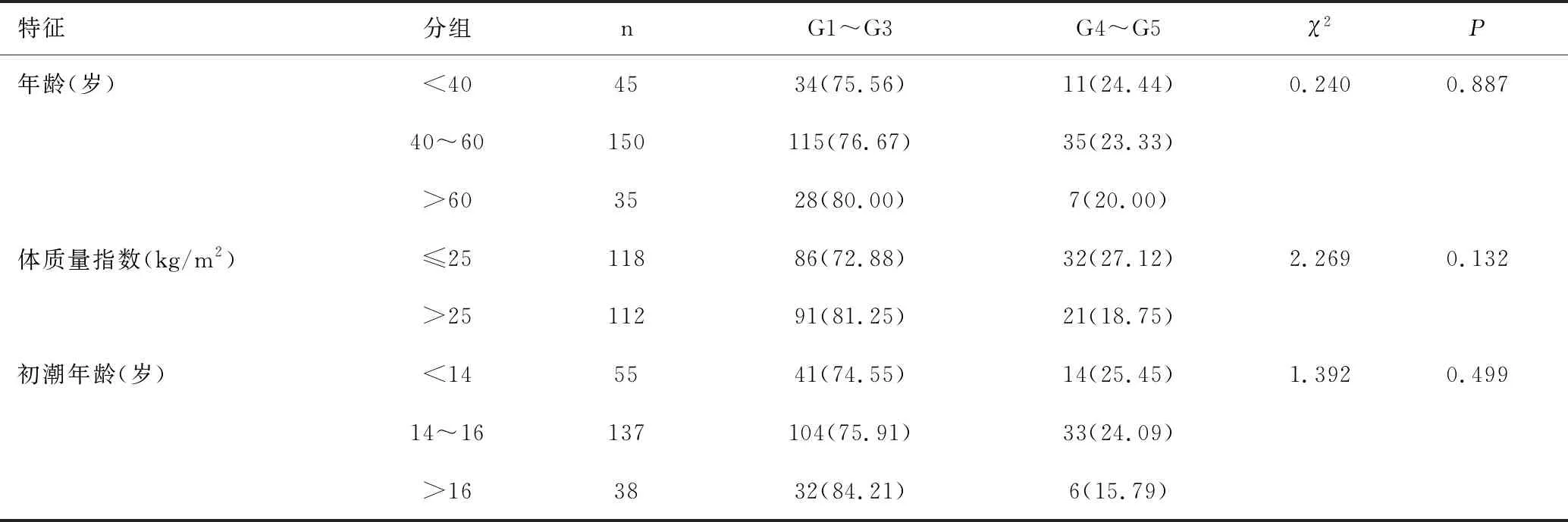
表2 臨床病理特征與原發腫瘤新輔助化療反應關系 [n(%)]Table 2 Association between clinicopathological factors and NACT response in the primary tumor [n(%)]
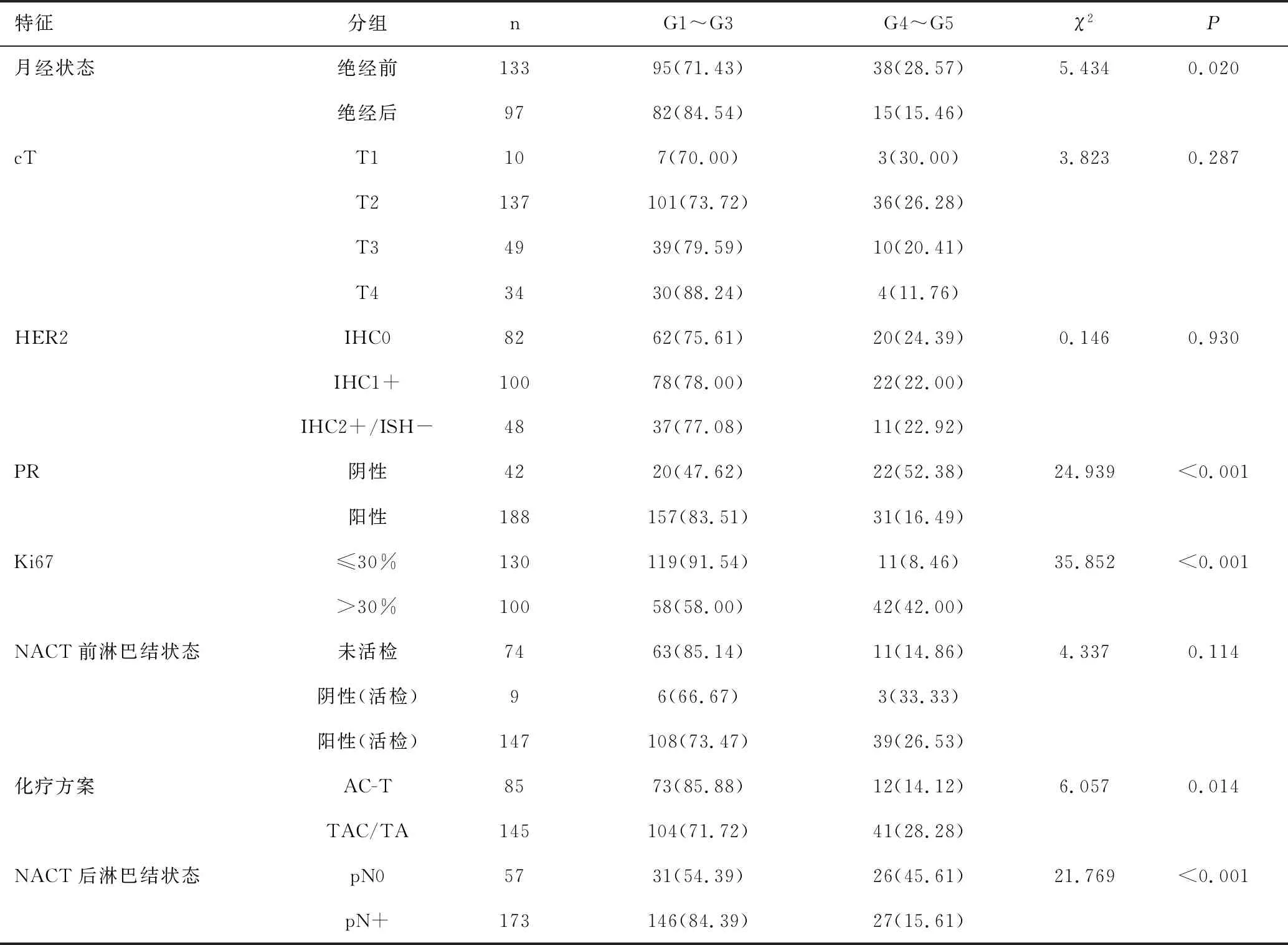
特征分組nG1~G3G4~G5χ2P月經狀態絕經前13395(71.43)38(28.57)5.4340.020絕經后9782(84.54)15(15.46)cTT1107(70.00)3(30.00)3.8230.287T2137101(73.72)36(26.28)T34939(79.59)10(20.41)T43430(88.24)4(11.76)HER2IHC08262(75.61)20(24.39)0.1460.930IHC1+10078(78.00)22(22.00)IHC2+/ISH-4837(77.08)11(22.92)PR陰性4220(47.62)22(52.38)24.939<0.001陽性188157(83.51)31(16.49)Ki67≤30%130119(91.54)11(8.46)35.852<0.001>30%10058(58.00)42(42.00)NACT前淋巴結狀態未活檢7463(85.14)11(14.86)4.3370.114陰性(活檢)96(66.67)3(33.33)陽性(活檢)147108(73.47)39(26.53)化療方案AC-T8573(85.88)12(14.12)6.0570.014TAC/TA145104(71.72)41(28.28)NACT后淋巴結狀態pN05731(54.39)26(45.61)21.769<0.001pN+173146(84.39)27(15.61)
2.3 腫瘤新輔助化療反應多因素分析
將月經狀態、PR、Ki67、化療方案、NACT后淋巴結狀態納入二元Logistic回歸分析,結果顯示PR陰性、Ki67>30%、pN0為腫瘤新輔助化療反應的保護因素,其OR值及95%CI分別為0.268(0.128~0.562)、0.188(0.098~0.362)、0.277(0.141~0.544),見表3。
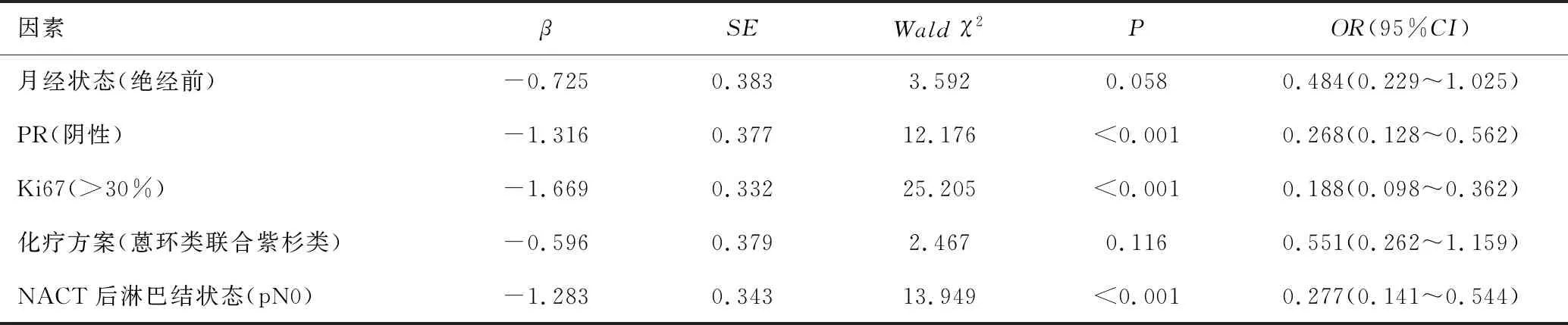
表3 腫瘤新輔助化療反應多因素分析
3 討論
該研究納入的230例乳腺癌患者均為ER陽性、HER2陰性。按照原發腫瘤新輔助化療M-P分級,分為G1~G3、G4~G5兩組進行分析。單因素分析顯示,ER陽性、HER2陰性的乳腺癌患者原發腫瘤新輔助化療效果可能與月經狀態、PR、Ki67、化療方案、NACT后淋巴結狀態有關,即絕經前、PR陰性、Ki67>30%、蒽環類聯合紫杉類化療、NACT后淋巴結陰性,新輔助化療效果較好。多因素分析顯示PR陰性、Ki67>30%、NACT后淋巴結陰性,新輔助化療效果較好。
3.1 新輔助化療優勢與風險
新輔助治療具有多個臨床優勢,包括減小腫瘤體積、降低腋窩分期、提高乳房保留率,以及根據殘留病灶的情況明確藥物敏感性,為后續的治療和預后分析提供指導。目前已成為局部晚期乳腺癌患者的標準治療方法。此外,有證據表明NACT后達到pCR提示預后良好[7-8]。紫杉類和蒽環類有不同的作用機制,且二者不會產生交叉耐藥,臨床試驗和Meta分析顯示,在蒽環類藥物的基礎上加上紫杉類藥物的治療方案,無病生存率和總生存率均提高。分析顯示,添加紫杉類藥物的方案能夠降低ER陽性乳腺癌患者的復發率,并改善預后。相較于HER2陽性乳腺癌,化療藥對HER2陰性乳腺癌的抑制作用較差,了解患者在NACT后可能的反應是確定治療方案的重要因素。但另一方面,新輔助化療延遲切除原發腫瘤,有發生腫瘤進展的風險,治療期間出現腫瘤播散,特別是那些對NACT無反應的患者,ER陽性患者達到pCR是非常有限的。這部分患者將從預測標記物中獲益最大。找尋預測因子,避免無效治療,將是我們努力的方向。
3.2 乳腺癌亞型與臨床病理相關研究
乳腺癌亞型是乳腺癌患者疾病進展的重要預測因子。雖然以多基因表達分析的腫瘤分型越來越多地被使用,但以免疫組化為基礎的分型仍然是最常用的、最可靠的預測乳腺預后的方法。乳腺癌亞型是根據ER、PR、HER2等分子標記進行分類的,四種主要亞型包括Luminal A型、Luminal B型、三陰型和HER2陽性型。在不同分子分型患者中選擇適當的新輔助治療方案,能夠給乳腺癌患者帶來最大獲益。盡管如此,并不是所有的患者都能從NACT中受益。研究表明,三陰性、HER2陽性型乳腺癌pCR率較高,HR陽性乳腺癌pCR率較低[9]。一些國家,如美國、丹麥、愛爾蘭等使用了癌癥登記數據系統,發現ER陽性乳腺癌發病率增加,而ER陰性乳腺癌的發病率正在下降。ER陽性乳腺癌pCR率接近10%,與其他亞型相比,對化療相對不敏感。傳統上,風險評估主要依賴于臨床病理因素,如月經狀態、年齡、Ki67、細胞學分級、HER2和激素受體表達等[10]。近期的研究表明,激素陽性、淋巴結陰性、PR陰性的乳腺癌患者生存率很高,但同時具有更強的侵襲性特征,預后較差,pCR率低[11-12]。因此,患者盲目接受NACT治療,可能導致疾病惡化,或者出現化療毒性和不良反應。因此需要可靠的敏感性預測因子,從而篩查出那些能從NACT中受益的人。
已有研究表明臨床病理特點與化療效果相關,如ER表達水平、Ki67增殖指數與化學敏感性相關[13]。Ki67的表達水平反映腫瘤細胞的增殖能力,與化療敏感性密切相關[14]。HR陽性、HER2陰性、Ki67越高,表示處于增殖期的細胞越多,對化療更敏感,因此,這些病人可能受益于化療,預期有更高的pCR率[15]。此外,腫瘤微環境與腫瘤的發生和轉移有關,在這種環境下,炎癥反應起著重要作用。研究顯示,孕激素受體陰性狀態與較高的pCR率相關[16-17]。Kim等[18]研究表明,年齡小、PR陰性、絕經前、淋巴結陽性的乳腺癌患者(ER陽性、HER2陰性),新輔助化療取得了更好的臨床有效率,且在高增殖腫瘤,即Ki67>20%時,反應的差異甚至更高。Omranipour等[19]進行多因素分析,結果顯示ER+/HER2-乳腺癌患者中,年齡較小、PR陰性、Ki67評分較高,則NACT后pCR率較高。當以22.5%作為Ki67表達的臨界值,高Ki67可以預測新輔助化療反應,預測術后的pCR。一些臨床特征也與化療的效果有關,包括腫瘤大小、BMI和腋窩淋巴結轉移等[20]。
2020年,ASCO/CAP的建議進行了改進,增加了一個新的類別,對于ER低陽性,即1%~9%ER核染色的患者,內分泌治療的潛在好處是有爭議的[21]。ER陽性乳腺癌中,這種亞類占2%~3%,根據最近關于生存率或對新輔助治療的反應報告分析,其臨床特征與ER陰性乳腺癌是相似的[22-23],重新定義ER陰性閾值的問題有待解決。另一方面,ER陽性、PR陰性乳腺癌可被視為復發高風險的標志,可能從內分泌治療方法中獲得不同的益處[24]。
3.3 本文研究意義
本文通過回顧性匯總分析發現,對于ER陽性、HER2陰性乳腺癌患者,絕經前、PR陰性、Ki67>30%,新輔助化療效果較好。基于這一認識,對于高反應的患者,臨床上可選擇進行新輔助化療。對于絕經后、PR陽性、Ki67≤30%等低反應患者,如可行手術,應調查首選手術還是新輔助化療,通過多基因檢測明確患者對化療的敏感性;如手術無法切除,NACT聯合新輔助內分泌治療(neoadjuvant endocrine therapy,NAET)或單用NAET可能是有效的治療方法。一篇包含20項研究的薈萃分析顯示,NAET聯合NACT與單用NACT治療ER陽性乳腺癌有同樣的療效,且副作用較少[25]。從臨床角度來看,作為NACT的替代品,NAET是一種可行和有效的治療方法,特別是在ER陽性、HER2陰性絕經后患者中[26]。
3.4 展望與局限性
我國乳腺癌大部分為Luminal型,且NACT效果較其他類型欠佳。此外,接受NACT治療過程中,可能出現疾病進展惡化,或者出現嚴重化療毒性和不良反應。因此需要可靠的敏感性預測因子,評估篩選出該群體中能從NACT中受益的人。通過尋找這一亞型乳腺癌患者新輔助化療效果的影響因素,預估腫瘤對治療的反應,避免患者接受無效治療,篩選出獲益群體,并提高這一患者群體的診療效果,是至關重要的。當然,這需要更大樣本量、更長時間的隨訪。本研究存在一定局限性,這是一項回顧性分析,由于受限于已有的數據,且樣本量偏少,沒有將ER、PR等指標分層研究,未來可基于此進一步研究。

