人參多糖注射液聯合信迪利單抗對晚期非小細胞肺癌化療患者的作用
袁航,魏娜,任統偉
(南陽張仲景醫院 腫瘤內科,河南 南陽 473000)
非小細胞肺癌(non-small cell lung cancer,NSCLC)起病隱匿,通常患者就診時已為晚期,單純手術治療效果不佳,而紫杉醇聯合順鉑雖可一定程度縮小病灶,但仍存在較高毒副反應風險,影響患者生存質量,且癌細胞耐藥性可抵制化療藥物作用[1]。近年來研究顯示NSCLC發生、發展、轉移及復發與機體免疫缺陷有關,尤其是與T細胞免疫抑制密切相關[2]。程序性死亡受體1(programmed death-1,PD-1)/PD-1配體(PD-1 ligand,PD-L1)信號通路可通過負向信號限制、削弱或終止T細胞應答,參與腫瘤逃逸機制,進而參與NSCLC病情演變[3]。PD-1單抗藥物的出現延長了NSCLC患者生存時間,其可通過激活T細胞對腫瘤細胞反應,增強T細胞對腫瘤細胞的殺傷力[4],這與中醫學“治病治本”“正氣存內,邪不可干”不謀而合。研究指出,人參多糖注射液符合NSCLC中醫治療益氣養陰之原則,且具有增強免疫效果[5]。基于此,本研究旨在分析人參多糖注射液聯合信迪利單抗治療晚期NSCLC化療患者的效果。
1 對象與方法
1.1 臨床資料
選取南陽張仲景醫院2020年2月至2022年2月收治的106例NSCLC患者,隨機分為對照組和觀察組,各53例。納入標準:符合NSCLC診斷標準[6],并經病理學確診為Ⅲ~Ⅳ期;首次發病;簽署知情同意書。排除標準:預計生存期不足3個月;合并血液疾病或嚴重感染;伴有其他惡性腫瘤、免疫缺陷病或器質性疾病;近2個月內接受其他抗腫瘤治療;精神異常或認知障礙;妊娠期或哺乳期女性。兩組一般資料均衡可比(P>0.05)。見表1。本研究經醫院醫學倫理委員會審批。

表1 兩組臨床資料比較
1.2 治療方法
兩組均接受TP化療方案,第1天,135 mg·m-2的紫杉醇用500 mL生理鹽水稀釋,靜脈滴注;第1~3天,30 mg·m-2的順鉑采用500 mL生理鹽水稀釋,靜脈滴注。在此基礎上,對照組接受信迪利單抗,第1天,200 mg信迪利單抗采用100 mL生理鹽水稀釋,靜脈滴注45 min。在對照組基礎上觀察組接受人參多糖注射液,第1~15天,12 mg人參多糖注射液采用250 mL生理鹽水稀釋,靜脈滴注。1個周期21 d,連續3個周期。
1.3 觀察指標
(1)療效、不良事件、生活質量。參考實體瘤近期療效標準RECIST[7]:腫瘤完全消失,且4周內無復發為完全緩解;腫瘤病灶縮小50%及以上,且4周內穩定無復發為部分緩解;腫瘤病灶縮小不足50%或增大不足25%,無新發病灶為穩定;腫瘤病灶增加25%及以上,或出現新病灶為疾病進展。客觀緩解率為完全緩解、部分緩解之和占總例數的百分比;疾病控制率為完全緩解、部分緩解、穩定之和占總例數的百分比。參考美國國立癌癥研究所不良事件通用術語標準3.0版[8]記錄不良事件發生情況,分為0~4級。參考卡氏評分[9]評價生活質量改善情況,卡氏評分增加10分及以上為改善,無增減或增加、減少不足10分為穩定,減少10分以上為下降。(2)治療前后血清腫瘤標志物[癌胚抗原(carcinoembryonic antigen,CEA)、血管內皮生長因子(vascular endothelial growth factor,VEGF)、神經元特異性烯醇化酶(neuron-specific enolase,NSE)、糖類抗原19-9(carbohydrate antigen 19-9,CA19-9)]、調節性T細胞(regulatory T-cell,Treg)/輔助性T細胞(helper T cells,Th17)、PD-1/PD-L1信號通路相關指標。(3)生存情況。通過電話、微信及門診等方式隨訪1 a,統計對比兩組生存情況。
1.4 統計學方法
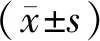
2 結果
2.1 療效
觀察組客觀緩解率、疾病控制率較對照組高(P<0.05)。見表2。

表2 兩組療效比較[n(%)]
2.2 不良事件
觀察組發生胃腸道反應14例,皮疹8例,肝功能損傷21例,白細胞降低13例,血紅蛋白降低10例,甲狀腺功能損傷11例;對照組發生胃腸道反應25例,皮疹6例,肝功能損傷24例,白細胞降低23例,血紅蛋白降低21例,甲狀腺功能損傷14例。觀察組各不良事件發生率均較對照組低(χ2=4.909,P=0.027;χ2=0.329,P=0.566;χ2=0.348,P=0.556;χ2=4.206,P=0.040;χ2=5.517,P=0.019;χ2=0.471,P=0.493)。
2.3 生活質量改善率
觀察組生活質量改善30例,穩定19例,下降4例;對照組生活質量改善16例,穩定18例,下降19例。觀察組生活質量改善率較對照組高(χ2=7.528,P=0.006)。
2.4 血清腫瘤標志物
兩組治療1、3個周期后血清CEA、VEGF、CA19-9及NSE水平較治療前下降(P<0.05),且觀察組低于對照組(P<0.05)。見表3。

表3 兩組血清腫瘤標志物比較
2.5 Treg/Th17水平
兩組治療1、3個周期后,Treg、Th17細胞及Treg/Th17水平均較治療前下降(P<0.05),且觀察組低于對照組(P<0.05)。見表4。

表4 兩組Treg/Th17比較
2.6 PD-1/PD-L1信號通路
兩組治療1、3個周期后PD-1、PD-L1水平較治療前下降(P<0.05),且觀察組低于對照組(P<0.05)。見表5。

表5 兩組PD-1/PD-L1信號通路相關指標比較
2.7 生存分析
觀察組失訪1例,1 a生存率為55.77%(29/52),對照組失訪3例,1 a生存率為46.00%(23/50),兩組生存率差異無統計學意義(χ2=0.973,P=0.324)。
3 討論
化療為晚期NSCLC主要治療手段,TP方案為最為常見,其中紫杉醇可抑制腫瘤細胞有絲分裂,鉑類藥物對腫瘤細胞DNA復制具有抑制作用,二者聯合應用可有效抑制腫瘤細胞增殖,但其同樣損傷機體正常細胞,抑制免疫功能[10]。研究發現腫瘤細胞免疫逃逸是晚期NSCLC患者腫瘤細胞難以徹底殺滅的主要因素之一[11]。信迪利單抗靶向性強,通過阻斷腫瘤細胞免疫逃逸,調節機體免疫功能,達到抗癌效果[12]。人參多糖注射液是由扶正中藥人參制成的免疫增強劑,已有研究證實,其具有抗腫瘤及增強免疫作用[13]。
本研究結果顯示,觀察組療效優于對照組,不良事件少于對照組,生活質量改善率高于對照組,提示二者聯合應用的效果較好,有助于改善患者生活質量。既往動物實驗表明,肺癌小鼠經中藥方及抗人細胞毒性T細胞抗原4單抗聯合治療可抑制病灶生長,延長生存時間[14]。值得注意的是,本研究中兩組1 a生存率比較無統計學差異,可能與本研究隨訪時間短有關,有待臨床日后延長隨訪時間,進一步證實。
CEA、VEGF、CA19-9及NSE屬于腫瘤標志物,是反映NSCLC病情程度及療效的特異性指標,其水平異常升高提示患者預后不佳。本研究中兩組治療后血清CEA、VEGF、CA19-9及NSE水平較治療前下降,而觀察組均較對照組低,證實二者聯合用藥抗腫瘤效果更為顯著。
CD4淋巴細胞在機體抗腫瘤免疫中發揮重要作用,特別是分化形成的Treg、Th17細胞。動物實驗表明,抑制PD-1/PD-L1信號通路可改善實驗動物Treg/Th17失衡狀態,增強其免疫調節能力[15]。PD-1/PD-L1信號通路可通過抑制T細胞增殖,促進凋亡,參與腫瘤免疫逃逸[16]。PD-1作為免疫抑制性受體,通常存在于T細胞中,其抑制T細胞介導的免疫反應是導致NSCLC發生免疫逃逸的主要機制之一;PD-L1作為PD-1主要配體,存在于T、B細胞、腫瘤細胞、間充質干細胞及腫瘤浸潤巨噬細胞等腫瘤微環境中,可通過結合PD-1阻斷下游T細胞活化,致使機體免疫低下[17]。本研究中兩組治療后PD-1、PD-L1、Treg、Th17細胞及Treg/Th17水平較治療前下降,且觀察組均較對照組低,說明二者聯合可增強機體免疫功能。分析原因,在于信迪利單抗是以PD-1為治療靶點的抗腫瘤藥物,可有效抑制PD-1、PD-L1活化,進而增強機體免疫力,抑制腫瘤惡性進展[18]。人參多糖注射液具有雙向免疫調節作用,可增強機體細胞免疫應答及體液免疫[19]。
4 結論
人參多糖注射液聯合信迪利單抗治療晚期NSCLC化療患者,可增強機體免疫力,發揮增效減毒作用,提高患者生存質量。

