木犀草素調控CTBP1-AS2/miR-493-5p對高糖誘導人視網膜血管內皮細胞損傷的影響
談麗麗 魏雪梅 韓崇嶺 陳平
(青海省第五人民醫院眼科,青海 西寧 810000)
糖尿病視網膜病變(DR)是糖尿病(DM)的主要微血管并發癥之一,也是全球致盲的重要原因。研究表明,人視網膜血管內皮細胞(hRECs)功能障礙是DR發展的初始事件,持續高糖刺激可增加活性氧的產生,誘導氧化應激增強和炎癥反應,損害血管屏障,導致hRECs損傷和凋亡〔1〕。因此,減輕hRECs損傷可能有助于臨床治療DR。木犀草素是一種在膳食植物、中草藥廣泛存在的天然黃酮類化合物,研究報道木犀草素預處理可激活內皮型一氧化氮合酶和抑制線粒體氧化應從而激減輕糖尿病早期大鼠心肌缺血再灌注損傷,減輕高糖誘導的心肌微血管內皮細胞凋亡〔2,3〕。木犀草素通過核因子相關因子2激活抗氧化蛋白表達還可減輕高糖誘導的腎臟系膜細胞損傷,延緩糖尿病腎病進展〔4〕。此外,木犀草素通過上調miR-21表達保護PC-12細胞免受過氧化氫誘導的氧化損傷〔5〕。然而,木犀草素是否對DR中hRECs損傷具有保護作用尚不清楚。長鏈非編碼RNA(lncRNA)是非編碼RNA的重要成員,研究報道lncRNA通過染色質修飾、表觀遺傳調控、miRNA調控等機制參與DR中多種病理過程,是DR診斷或預后的生物標志物以和潛在的治療靶點〔6〕。研究發現糖尿病腎病患者外周血及高糖誘導的人腎系膜細胞中lncRNA C-末端結合蛋白-1反義RNA2(CTBP1-AS2)表達下調,過表達CTBP1-AS2可抑制高糖誘導的人腎系膜細胞氧化應激、細胞外基質積累和炎癥反應〔7〕。靶基因預測顯示miR-493-5p是CTBP1-AS2的潛在靶點,既往研究證實抑制miR-493-5p表達可減輕高糖刺激誘導的成骨分化缺陷,緩解糖尿病小鼠的骨質疏松情況〔8〕。然而,CTBP1-AS2是否靶向miR-493-5p參與DR中hRECs損傷并不清楚。本研究采用高糖誘導hRECs建立細胞損傷模型〔9〕,通過分析木犀草素對DR中hRECs凋亡、凋亡相關蛋白B細胞淋巴瘤(Bcl)-2和Bcl相關X蛋白(Bax)表達及氧化應激標志物丙二醛(MDA)、超氧化物歧化酶(SOD)水平的影響,旨在探討木犀草素的潛在保護作用,并探討其作用與CTBP1-AS2/miR-493-5p途徑的關系。
1 材料與方法
1.1實驗材料 hRECs購于美國模式培養物保藏所;木犀草素(含量94.4%,111520-202006)購于中國食品藥品檢定研究院;miRNA熒光定量聚合酶鏈反應(PCR)試劑盒購于上海生工生物工程公司;PrimeScript逆轉錄試劑盒購于大連寶生生物公司;miRNA反轉錄PCR試劑盒購于廣州銳博生物公司;SYBR Green PCR Master Mix、膜聯蛋白Ⅴ-異硫氰酸熒光素(Annexin-Ⅴ-FITC)凋亡檢測試劑盒購于北京索萊寶生物公司;MDA檢測試劑盒、SOD活性檢測試劑盒購于北京百奧萊博生物公司;兔源Bcl-2多克隆抗體、羊抗兔IgG二抗、兔源磷酸甘油醛脫氫酶(GAPDH)單克隆抗體、兔源Bax單克隆抗體購自上海碧云天生物公司。
1.2方法
1.2.1細胞培養、轉染和實驗分組 hRECs細胞接種含有10%胎牛血清的DMEM培養基(含5.5 mmol/L葡萄糖)在97%濕度、37 ℃、含5% CO2培養箱中培養。每周換液2次。當細胞匯合度為80%時進行胰酶消化和傳代,選擇第5代對數期hRECs用于實驗。取2×105個hRECs接種6孔板,按照Lipofectamine2000使用說明將pcDNA-CTBP1-AS2、pcDNA、si-CTBP1-AS2分別轉染hRECs,收集轉染48 h時hRECs。
實驗分組:正常糖(NG)組:用含5.5 mmol/L葡萄糖培養液處理48 h的hRECs;甘露醇組(MA):用含5.5 mmol/L葡萄糖和25.5 mmol/L甘露醇培養液處理48 h的hRECs;高糖組(HG)組:用含30 mmol/L葡萄糖培養液處理48 h的hRECs〔9〕;HG+木犀草素低劑量組、HG+木犀草素中劑量組、HG+木犀草素高劑量組:采用含30 mmol/L葡萄糖和7.5或15.0或30.0 μmmol/L木犀草素〔3〕處理48 h的hRECs;HG+pcDNA組、HG+ pcDNA-CTBP1-AS2組:采用含30 mmol/L葡萄糖處理轉染pcDNA或pcDNA-CTBP1-AS2細胞48 h;HG+木犀草素+si-CTBP1-AS2組:采用含30 mmol/L葡萄糖和30.0 μmol/L木犀草素處理轉染si-CTBP1-AS2細胞48 h。
1.2.2實時定量聚合酶鏈反應(RT-qPCR)檢測CTBP1-AS2和miR-493-5p表達 用TRIzol試劑提取各組hRECs總RNA,按照PrimeScript逆轉錄試劑盒或miRNA反轉錄PCR試劑盒合成cDNA,采用SYBR Green PCR Master Mix或miRNA熒光定量PCR試劑盒檢測CTBP1-AS2或miR-493-5p表達。2-△△Ct法計算CTBP1-AS2(內參為GAPDH)和miR-493-5p(內參為U6)相對表達量。引物序列如下:CTBP1-AS2上游5′-CACGTGTGGAGCCCTTGTAG-3′,下游5′-ACCAACCACATCGTCCCTTC-3′;GAPDH上游5′-GGAGCGAGATCCCTCCAAAAT-3′,下游5′-GGCTGTTGTCATACTTCTCATGG-3′;miR-493-5p上游5′-TTGTACATGGTAGGCTTTCATT-3′;U6上游5′-CTCGCTTCGGCAGCACA-3′,下游5′-AACGCTTCA-CGAATTTGCGT-3′。
1.2.3流式細胞術檢測hRECs凋亡率 胰蛋白酶處理各組hRECs,磷酸鹽緩沖液(PBS)洗滌細胞兩次,用1×結合緩沖液調整為2×105個/ml的細胞懸液。向反應管內加入500 μl細胞懸液,依次加入Annexin-V-FITC、碘化丙啶各5 μl置于暗室內孵育細胞15 min。1 h內上流式細胞儀檢測細胞凋亡比例。
1.2.4Western印跡檢測Bax和Bcl-2蛋白表達 向各組hRECs中加入RIPA細胞裂解液提取細胞總蛋白,二喹啉甲酸(BCA)法測定蛋白濃度合格后進行十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)。隨后將分離的蛋白轉移到聚偏氟乙烯膜,室溫下用5%脫脂牛奶封閉1 h。隨后將膜與Bax、Bcl-2、GAPDH一抗溶液4 ℃孵育過夜。Tween-20-Tris緩沖鹽水(TBST)洗膜3次,用對應的二抗溶液室溫下孵育膜1 h。最后將膜置于塑料盒,滴加化學發光試劑置于黑暗環境下顯影、定影。Image-Pro Plus6.0軟件分析各條帶灰度值,以目的蛋白和內參GAPDH灰度值比值表示對應蛋白表達量。
1.2.5試劑盒檢測hRECs中MDA水平和SOD活性 收集各組hRECs至離心管,加入提取液超聲破碎細胞,獲得細胞上清液。按照試劑盒檢測說明書分析各組hRECs中MDA水平和SOD活性。
1.2.6雙熒光素酶報告實驗 根據starbase預測到的CTBP1-AS2與miR-493-5p之間的結合位點,合成含有miR-493-5p結合位點的CTBP1-AS2野生型(WT)序列,同時合成不含miR-493-5p結合位點CTBP1-AS2突變型(MUT)序列,分別將上述序列克隆到熒光素酶報告質粒pGL3以構建WT重組熒光素酶報告載體WT-circ_0010729和WT重組熒光素酶報告載體MUT-circ_0010729。按照脂質體轉染法將miR-493-5p mimics、miR-NC分別與上述報告質粒共轉染hRECs,采用雙熒光素酶活性檢測試劑盒分析轉染48 h后hRECs的相對熒光素酶活性。
1.3統計學分析 采用SPSS13.0軟件進行t檢驗、方差分析和SNK-q檢驗。
2 結 果
2.1木犀草素對高糖誘導的hRECs凋亡的影響 與NG組比較,HG組hRECs中CTBP1-AS2表達量、Bcl-2蛋白表達量顯著降低,miR-493-5p表達量、Bax蛋白表達量、細胞凋亡率顯著升高(P<0.05);與HG組比較,HG+木犀草素低劑量組、HG+木犀草素中劑量組、HG+木犀草素高劑量組hRECs中CTBP1-AS2表達量、Bcl-2蛋白表達量顯著升高,miR-493-5p表達量、Bax蛋白表達量、細胞凋亡率顯著降低(P<0.05)。HG+木犀草素低劑量組、HG+木犀草素中劑量組、HG+木犀草素高劑量組3組間上述指標差異均有統計學意義。見圖1、表1、圖2。
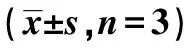
表1 木犀草素對高糖誘導的hRECs凋亡及氧化應激的影響

圖1 木犀草素對高糖誘導的hRECs凋亡的影響

1~6:NG組、MA組、HG組、HG+木犀草素低劑量組、HG+木犀草素中劑量組、HG+木犀草素高劑量組圖2 Western印跡檢測各組Bcl-2和Bax蛋白表達
2.2木犀草素對高糖誘導的hRECs氧化應激的影響 與NG組比較,MA組hRECs中SOD活性、MDA含量變化無統計學意義,這可排除高滲對hRECs氧化應激的影響。與NG組比較,HG組hRECs中SOD活性顯著降低,MDA含量顯著升高,差異有統計學意義(均P<0.05);與HG組比較,HG+木犀草素低劑量組、HG+木犀草素中劑量組、HG+木犀草素高劑量組hRECs中SOD活性顯著升高,MDA含量顯著降低,差異有統計學意義(均P<0.05)。HG+木犀草素低劑量組、HG+木犀草素中劑量組、HG+木犀草素高劑量組3組間上述指標差異均有統計學意義(均P<0.05)。見表1。
2.3過表達CTBP1-AS2對高糖誘導的hRECs凋亡及氧化應激的影響 與HG組、HG+pcDNA組比較,HG+pcDNA-CTBP1-AS2組hRECs中CTBP1-AS2表達量,Bcl-2蛋白表達量、SOD活性顯著升高,miR-493-5p表達量、凋亡率、Bax蛋白表達量、MDA含量顯著降低,差異有統計學意義(均P<0.05)。見表2、圖3。
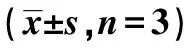
表2 CTBP1-AS2對高糖誘導的hRECs凋亡及氧化應激的影響

1~3:HG組、HG+pcDNA組、HG+pcDNA-CTBP1-AS2組
2.4CTBP1-AS2靶向miR-493-5p Starbase預測到miR-493-5p與CTBP1-AS2序列間存在特異結合靶點,見圖4。熒光素酶活性實驗結果顯示,與轉染miR-NC(1.00±0.09)比較,轉染miR-493-5p mimics后hRECs中WT-CTBP1-AS2的相對熒光素酶活性明顯下降,差異有統計學意義(0.41±0.05,P<0.01),而MUT-CTBP1-AS2的相對熒光素酶活性變化差異無統計學意義(0.98±0.07 vs 0.95±0.10,P>0.05)。

圖4 CTBP1-AS2和miR-493-5p的互補序列
2.5抑制CTBP1-AS2逆轉木犀草素對高糖誘導的hRECs凋亡的影響 與HG組比較,HG+木犀草素組hRECs中CTBP1-AS2表達量、Bcl-2蛋白表達量顯著升高,凋亡率、Bax蛋白表達量、miR-493-5p表達量顯著降低(均P<0.05);與HG+木犀草素組比較,HG+木犀草素+si-CTBP1-AS2組hRECs中CTBP1-AS2表達量、Bcl-2蛋白表達量顯著降低,凋亡率、Bax蛋白表達量、miR-493-5p表達量顯著升高(均P<0.05)。見圖5、表3。
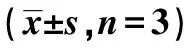
表3 抑制CTBP1-AS2對逆轉木犀草素對高糖誘導的hRECs凋亡及氧化應激損傷的影響

1~2:HG組、HG+木犀草素組、HG+木犀草素+si-CTBP1-AS2組
2.6抑制CTBP1-AS2逆轉木犀草素對高糖誘導的hRECs氧化應激損傷的影響 與HG組比較,HG+木犀草素組hRECs中SOD活性顯著升高,MDA含量顯著降低(P<0.05);與HG+木犀草素組比較,HG+木犀草素+si-CTBP1-AS2組hRECs中SOD活性顯著降低,MDA含量顯著升高(P<0.05)。見表3。

3 討 論
近年研究表明,木犀草素具有廣的細胞保護作用。Hong等〔10〕研究表明,在大鼠腎缺血再灌注損傷過程中,木犀草素降低缺血再灌注大鼠氧化應激、中性粒細胞浸潤、炎癥反應、腎細胞凋亡改善腎功能障礙和組織學損傷。Chen等〔11〕指出,木犀草素可提高過氧化氫作用下皮膚角質形成細胞的活力,提高抗氧化酶的表達,保護皮膚角質形成細胞免受ROS誘導的損傷。Yu等〔12〕證實,木犀草素可抑制核苷酸結合寡聚化結構域樣受體(NLRP)3炎癥小體形成,抑制高糖誘導的足細胞凋亡,對糖尿病腎病具有潛在治療作用。糖尿病中過量活性氧的產生可氧化細胞蛋白、膜脂和核酸,加重hRECs受損,SOD是清除氧自由基的內源性抗氧化劑,其水平是機體氧化應激水平的陰性標志物〔13〕。本研究結果表明,木犀草素通過增強細胞抗氧化能力,抑制凋亡,進而保護hRECs免受高糖誘導的細胞損傷。
lncRNA是缺乏蛋白編碼潛能的RNA轉錄本,其通過吸附miRNA間接影響miRNA靶mRNA的穩定性和翻譯能力從而影響多種人類疾病進展,例如lncRNA H19可靶向miR-93上調xbp1表達進而抑制高血糖下視網膜上皮細胞的炎癥反應〔14〕。已有研究證實,木犀草素通過下調致癌基因絲氨酸/蘇氨酸蛋白激酶(BANCR)激活lncRNA(lnc-BANCR)表達抑制下游促甲狀腺激素受體/細胞周期蛋白D1基因信號通路進而誘導甲狀腺癌細胞G0/G1期阻滯,抑制細胞增殖〔15〕。木犀草素可抑制脂多糖誘導的肺泡上皮細胞活力喪失、細胞凋亡和炎癥因子的表達,其機制與抑制miR-132表達有關〔16〕。本研究提示,木犀草素對高糖誘導的hRECs損傷的保護作用可能與調控CTBP1-AS2和miR-493-5p表達相關。目前關于CTBP1-AS2研究多集中在癌癥中,研究表明CTBP1-AS2在宮頸癌、肝癌、胃癌中表達增加,參與癌細胞的增殖、遷移、侵襲和耐藥,具有致癌因子作用〔17~19〕。此外,有報道稱lncRNA CTBP1-AS2可能通過抑制氧化低密度脂蛋白處理后血管平滑肌細胞的增殖并促進其自噬進而抑制動脈粥樣硬化進展〔20〕。本研究表明,過表達CTBP1-AS2顯著減弱高糖刺激對hRECs細胞SOD活性、MDA水平、細胞凋亡及Bax和Bcl-2蛋白表達的影響,保護hRECs免受高糖誘導的氧化應激損傷和凋亡,這與木犀草素對高糖誘導的hRECs的保護效果一致。進一步研究證實,CTBP1-AS2與miR-493-5p存在直接作用,過表達CTBP1-AS2可減弱高糖刺激對miR-493-5p表達的誘導作用,這表明在高糖誘導的hRECs中可能存在CTBP1-AS2/miR-493-5p調控途徑。本研究結果表明,抑制CTBP1-AS2表達顯著削弱木犀草素處理對高糖誘導的hRECs凋亡和氧化應激損傷的保護作用,表明木犀草素可能通過上調CTBP1-AS2/miR-493-5p途徑進而對高糖誘導的hRECs損傷發揮保護作用。然而,本研究存在一定的局限性,木犀草素下游是否存在其他lncRNA/miRNA調控途徑、miRNA的下游可能靶點仍需進一步確認。
綜上所述,木犀草素可有效抑制高糖誘導的hRECs凋亡和氧化應激損傷,其機制可能是通過上調CTBP1-AS2/miR-493-5p途徑實現的,這首次揭示了木犀草素在高糖誘導的hRECs損傷中的保護作用和分子機制。

